Артериальная гипертензия (АГ) по-прежнему остается одной из наиболее актуальных медицинских и социальных проблем, так как является одним из самых распространенных заболеваний во всем мире. Несмотря на значительное количество исследований в данной области, патоморфоз АГ еще остается малоизученным [1, c. 581]. Кроме того, следует отметить, что АГ является одним и ведущих факторов смертности населения, по данным ВОЗ, так как приводит к серьезным сердечно-сосудистым осложнениям, таким как инфаркт миокарда и инсульт [2, 3]. У больных АГ до 7 раз чаще проявляется инсульт и в 3–4 раза чаще формируется ишемическая болезнь сердца [2, 4]. Группой исследователей из США (В.Л. Роджер, А.С. Го, Д.М. Ллойд-Джонс) установлено, что у 69% пациентов, впервые столкнувшихся с инфарктом миокарда, а также у 77% страдающих от сердечной недостаточности и у 77% пациентов, которые перенесли инсульт, диагностирована артериальная гипертензия в анамнезе, которая длительное время протекала без медикаментозного контроля [5].
Также наблюдается мировая тенденция к росту числа больных, страдающих АГ, среди пациентов детского возраста (до 18% от всей популяции страдающих АГ людей) [6, 7], согласно статистическим данным, даже дети младше 7 лет имеют артериальную гипертензию в 1–14% случаев [6, 7]. Кроме того, известен факт, описанный белорусскими исследователями профессором А.В. Сукало и доцентом А.К. Ткаченко, что у детей с рождения снижена скорость клубочковой фильтрации (СКФ), эффективной СКФ становится к возрасту 18 месяцев [8], что дает основания предполагать, что в детском возрасте при развитии почек структуры формируются неравномерно, соответственно, отклонения от нормы, способные привести к развитию артериальной гипертензии, могут возникнуть на разных этапах формирования почек.
Особенный интерес в контексте артериальной гипертензии для исследования представляет формирование юкстагломерулярного аппарата (далее ЮГА) в онтогенезе, так как именно данная структура играет важную роль в регулировании артериального давления за счет своей эндокринной функции [9]. Исследование ЮГА началось с открытия ренина в конце XIX в., и до настоящего момента эти исследования не завершены [10].
В почечной паренхиме различают три типа нефронов – субкортикальные, промежуточные, околомозговые, строение которых имеет значительные отличия. Единого мнения о том, какой вклад вносит каждый тип нефронов в эндокринную функцию почек в связи с особенностями строения этих нефронов, до настоящего времени нет.
В связи с вышеизложенным исследование особенностей развития и формирования почек как основного органа, отвечающего за регулирование артериального давления (АД), а именно изучение развития эндокринного аппарата нефронов в детском возрасте в зависимости от типа их строения и возрастной принадлежности, является весьма актуальным.
Цель исследования. Изучить динамику роста и дифференцировки ренин-продуцирующего аппарата почек в период постнатального онтогенеза в зависимости от типа нефронов.
Материал и методы исследования. Исследование было проведено на аутопсийном, гистологическом материале почек пациентов детского возраста из практики патологоанатомического отделения ГУЗ УОДКБ им. политического и общественного деятеля Ю.Ф. Горячева, с разрешения законных представителей пациентов. Дизайн исследования соответствовал принципам научных исследований, изложенным в WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects, и был одобрен локальным Этическим комитетом и научно-координационным советом Института медицины, экологии и физической культуры УлГУ (протокол № 3/19 от 20.11.2019). Всего было проанализировано 60 аутопсийных случаев пациентов детского возраста от 2 месяцев до 10 лет, все случаи были разделены на 6 возрастных групп без учета половой принадлежности: 1-я группа – 2–4 месяца, 2-я группа – 6–9 месяцев, 3-я группа – 10–12 месяцев, 4-я группа – 3 года, 5-я группа – 6 лет, 6-я группа – 10 лет. В каждую группу было включено по 10 аутопсийных случаев пациентов соответствующего возрастного диапазона, не имеющих заболеваний сердечно-сосудистой, эндокринной, мочевыделительной систем.
Исследуемый материал подготавливали по стандартной гистологической методике: фиксировали в нейтральном забуференном формалине, затем заливали парафиновые блоки с последующей окраской препаратов гематоксилином-эозином, что позволило провести морфометрическое исследование и определить все структуры коркового и мозгового вещества.
Для морфометрического определения ЮГА использовали иммуногистохимическую (далее ИГХ) методику визуализации с помощью первичных поликлональных антител к ренину. Парафиновые срезы монтировали на предметные стекла с поли-L-лизином, срезы инкубировали с первичными моноклональными антителами Antirenin antibody («CloudClone»). Рабочую концентрацию антител определяли исходя из рекомендаций производителя на материале с достоверной экспрессией данных антител. Иммуногистохимическое окрашивание производили с использованием системы детекции Cell Marque DAB 3s kit. После доокрашивания гематоксилином препараты подвергались дегидратации, просветлению и заключению под покровные стекла.
Морфометрию проводили с помощью исследовательского микроскопа Levenhuk Med 900, фотовидеокамеры для микроскопа Levenhuk M800Plus и программного обеспечения LevenhukLite. В ходе исследования проводился подсчет суммарной площади (S) всех ренин-позитивных клеток ЮГА в субкортикальной и в околомозговой зонах коркового вещества почек на увеличении х80 в каждом из 10 случаев во всех возрастных группах. Далее высчитывали среднюю арифметическую (μ) суммы для субкортикальной и околомозговой зоны из 10 случаев в каждой возрастной группе.
Статистическую обработку полученных данных проводили в программе Statistica 8.0. Все результаты были проверены на соответствие закону о нормальном распределении (критерий Шапиро–Уилка). Для показателей с нормальным распределением был использован критерий Стьюдента, для показателей, не совпадающих с нормальными значениями, был применен критерий Манна–Уитни. Данные представлены в виде среднего арифметического значения ± стандартная ошибка среднего (М±m). Значимыми считали отличия при р<0,05. Аутопсийный материал пациентов, страдающих почечными патологиями, заболеваниями сердечно-сосудистой системы, сахарным диабетом и другими эндокринными патологиями, в работе не использовался.
Результаты исследования и их обсуждение
При проведении макро- и микроскопического исследований в изучаемых образцах почек отсутствовали видимые повреждения и признаки патологических изменений. Почки имели типичное для своего возраста строение [11], границы коркового и мозгового вещества были хорошо различимы, на ранних сроках (2 месяца – 12 месяцев) сохранялись признаки дольчатого строения. В качестве примера на микрофотографиях субкортикальной зоны и околомозговой зоны (рис. 1) представлен один из образцов исследуемого материала с обозначениями ультраструктур.
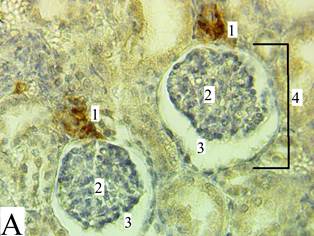
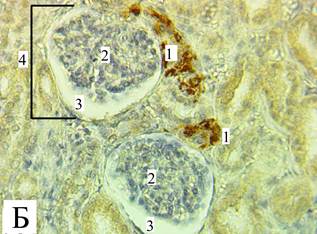
Рис. 1. Микрофотография корковой зоны «А» и околомозговой зоны «Б», увеличение х80). Под цифрой (1) обозначены скопления ренин-позитивных клеток ЮГА, под цифрой (2) обозначен клубочек нефрона, под цифрой (3) – мочевое пространство капсулы Боумена–Шумлянского, под цифрой (4) обозначено тело нефрона
В течение изученного периода онтогенеза (с 2 до 6и лет) происходит прогрессивный рост площади, занимаемой клетками юкстагломерулярного аппарата, продуцирующими ренин. Ренинпозитивные клетки образуют поля и скопления в стенках приносящих артериол и в меньшей степени – в стенках выносящих артериол клубочков (рис. 1). В возрасте 6 лет суммарная площадь ренинпозитивных клеток становится максимальной (рис. 2), а к 10-летнему возрасту наблюдается относительное снижение этого показателя, что может быть следствием активного роста канальцевого аппарата нефронов и относительного снижения площади ранее сформированных структур. О периодах наиболее интенсивного роста почечной паренхимы, которые приходятся на первые 1,5–2 года жизни и 8–10 лет, свидетельствуют и данные Р.И. Айзмана [12], объясняющие снижение площади эндокринного аппарата относительно канальцевых структур почки.
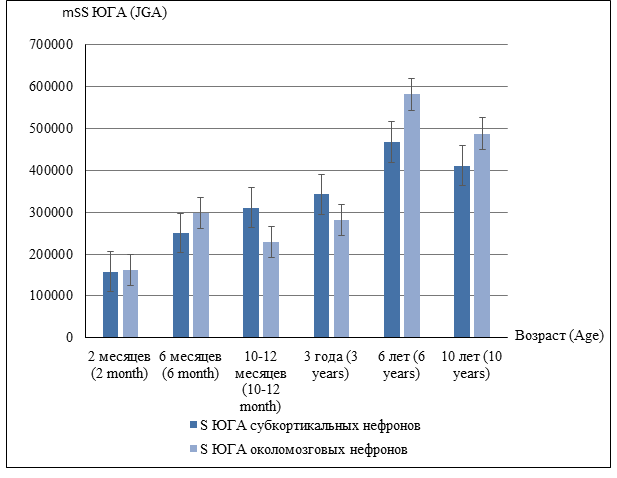
Рис. 2. Средняя сумма площади ренин-позитивных клеток юкстагломерулярного аппарата
Однако процесс роста и дифференцировки юкстагломерулярного аппарата происходит с различной скоростью и интенсивностью в разных типах нефронов – субкортикальных и околомозговых. Так, суммарная площадь ренинпозитивных клеток в почечных тельцах субкортикальных нефронов начиная с 2-месячного возраста растет прогрессивно линейно до 6-летнего возраста, когда достигает максимальных значений. К возрасту 10 лет происходит ее относительное снижение, однако достоверных различий между показателями в эти возрастные периоды выявлено не было (таблица). Некоторое снижение значений суммарной площади ренинпозитивных клеток в 10-летнем возрасте, по-видимому, связано с замедлением нарастания объема эндокринной ткани в составе стенок приносящих и выносящих артериол при сохраняющемся росте других элементов почечной паренхимы (в частности, канальцев и интерстиция).
Показатели средней суммы площади ренинпозитивных клеток юкстагломерулярного аппарата
|
Возрастные группы |
S ЮГА субкортикальных нефронов |
S ЮГА околомозговых нефронов |
|
2 месяца 2 month |
157785 (± 47643,21) |
162671 (± 36652,32) |
|
6 месяцев 6 month |
249261 (± 46659,12) |
297989 (± 36652,54) |
|
10–12 месяцев 10–12 month |
310942 (± 42689,32) * |
228632 (± 31487,44) * |
|
3 года |
342168 (± 48576,31) |
281576 (± 37687,62) |
|
6 лет 6 years |
467342 (± 48471,21) * |
581576 (± 38543,41) * |
|
10 лет 10 years |
411020 (± 47432,13) |
487634 ± 37432,63 |
Примечание* – различия достоверны для сравнения средней суммы площади (μΣS) субкортикальных и околомозговых нефронов (р≤0,05) в одном возрастном периоде.
Рост и дифференцировка юкстагломеруллярного аппарата околомозговых нефронов происходят несколько сложнее. В возрасте 2 месяцев суммарная площадь ренинпозитивных клеток околомозговых нефронов не отличается от данного показателя субкапсулярных нефронов, но быстро возрастает к возрасту 6 месяцев (рис. 2). Затем скорость роста значительно снижается (суммарная площадь ренинпозитивных клеток в возрасте 1 года и 3 лет), а к 6 годам наблюдается резкий скачок данного показателя, когда суммарная площадь ренинпозитивных клеток околомозговых нефронов достоверно превышает показатель, полученный для субкапсулярных нефронов. Данные факты соотносятся с данными исследователей Цю Сяо, Вэй Жунфэй, Чжан Линцян, Хэ Фучу (2015), которые в своей работе «Роль сигнальных путей в регуляции развитии почек» также говорят о неравномерном развитии различных ультраструктурных элементов паренхимы почек [13].
К 10-летнему возрасту происходят некоторое снижение и стабилизация суммарной площади ренинпозитивных клеток околомозговых и субкортикальных нефронов, но юкстагломерулярный аппарат околомозговых нефронов достигает большей площади, что может свидетельствовать о большей вовлеченности данных нефронов в процесс синтеза и секреции ренина. Неравномерность роста юкстагломерулярных клеток в структурах околомозговых нефронов связана с основными тенденциями развития паренхимы почек у детей – преимущественным увеличением длины и диаметра почечных канальцев, особенно тонкого отдела петли Генле, возрастанием удельного объема канальцев и уменьшением доли клубочков (к 9–10 годам) [11].
Выводы. Таким образом, увеличение суммарной площади ренинпозитивных клеток юкстагломерулярного аппарата в субкортикальных и околомозговых нефронах происходит с различной скоростью. В субкортикальном слое данный процесс на протяжении первых 6 лет идет прогрессивно линейно, стабилизируясь к 10 годам, тогда как в околомозговой зоне суммарная площадь, занимаемая ренинпозитивными клетками, с 10–12 месяцев до 3 лет оказывается ниже значений, как полученных для субкортикального слоя того же возраста, так и данного показателя в более раннем возрасте (6 месяцев). Это свидетельствует о значительном росте канальцевых структур околомозгового и мозгового вещества с 1 года до 3 лет и более поздней дифференцировке почечных тел в околомозговой зоне.
Начиная с 6-летнего возраста суммарная площадь ренинпозитивных клеток в околомозговых нефронах становится больше, чем в субкортикальных, что подтверждает выдвинутую нами гипотезу о преимущественно эндокринной функции юкстамедулярных нефронов и их основном участии в осуществлении почечных механизмов регуляции артериального давления.
Библиографическая ссылка
Сологуб А.А., Слесарева Е.В., Кузнецова Т.И., Смирнова Е.В. АНАЛИЗ РАЗВИТИЯ ЮКСТАГЛОМЕРУЛЯРНОГО АППАРАТА ПОЧЕК В ДЕТСКОМ ВОЗРАСТЕ // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31613 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31613



