Лекарственный препарат допамин, являющийся аналогом естественного медиатора дофамина, благодаря своему влиянию на трансмембранные метаботропные G-белок-опосредованные клеточные дофаминовые рецепторы не только в центральной нервной системе, но и в периферических органах производит в организме двоякое действие: прямое на α- и β-адренорецепторы, а также и дофаминовые рецепторы, и непрямое, способствуя высвобождению норадреналина из нервных окончаний. Активация постсинаптических дофаминовых D1-рецепторов вызывает стимуляцию аденилатциклазы, расслабление гладкомышечных клеток сосудов и их дилатацию [1, 2, 3]. В настоящее время выявлены пять подтипов дофаминовых рецепторов, образующих два семейства: первый – D2 и D3 пресинаптически расположенные и участвующие в синтезе и секреции самого дофамина; второй – D1, D4 и D5 находящиеся постсинаптически и непосредственно производящие дофаминергическую передачу [4, 5].
Дофамин часто используется при лечении больных с острой и хронической сердечной недостаточностью, особенно при сопутствующем поражении почек, так как он способствует восстановлению почечной гемодинамики, увеличению экскреции электролитов и диуреза, что оказывает благоприятное влияние на клиническое состояние больных. Эти изменения функции почек связаны со стимуляцией D1-дофаминовых рецепторов гладкой мускулатуры сосудов и клеток проксимальных канальцев с угнетением активности Na+/H+-обменника 3-го типа и Na+, K+-АТФазы, приводящей к торможению реабсорбции натрия и, как следствие, к повышению выделения мочи [6, 7, 8].
Однако в настоящее время многие эффекты дофамина на водо-, азото- и ионовыделительные функции почек как через непосредственное влияние на сами почки, так и опосредованно через почечные нейрогуморальные системы раскрыты и изучены не до конца, особенно в условиях патологии почек. Рассмотрение этого вопроса будет целью наших исследований в дальнейшем.
Целями работы были экспериментальное выяснение влияния дофамина на водовыделительную функцию почек и вскрытие механизмов, влияющих на этот процесс.
Материалы и методы исследований. Исследования проводили на 40 половозрелых крысах линии Вистар примерно одинакового веса (от 170 до 210 г, 195±8 г) и возраста (от 7 до 9 месяцев), которые были разделены на контрольную (20 крыс) и опытную (20 крыс) группы.
Применяемое в клиниках введение больным дофамина внутривенно капельно относительно длительное время неприемлемо для крыс. Но, так как дофамин нельзя вводить в/м или per os, то для максимально приближенного к внутривенному введению мы использовали его внутрибрюшинное введение в дозе 2,5 мкг/кг/мин, аналогичной применяемой в клинике у ренальных больных. В качестве дофамина использовали препарат «Дофамин-Ферейн» (Россия). Хотя при проведении экспериментов на животных допустимо вводить дозы препаратов в несколько раз больше тех, которые назначают больным, мы специально не увеличивали дозу дофамина исходя из того, что при получении в дальнейшем положительных результатов влияния этого катехоламина на функцию почек в условиях почечной недостаточности их можно было бы рекомендовать профильным больным. К тому же дофамин в дозе 10–15 мкг/кг/мин через стимуляцию α1-адренорецепторов вызывает сужение почечных сосудов, повышение общего сосудистого сопротивления, частоты сердечных сокращений и артериального давления [9].
После первой инъекции дофамина через 15, 30 и 45 минут мы повторяли его введение, т.е. за 1 час делали 4 раза. Количество вводимого препарата при одной инъекции было равно 37,5 мкг/кг (если доза 2,5 мкг/кг/мин, то за 15 минут это будет 37,5 мкг, или 150,0 мкг/кг за 1 час). Введение через каждые 15 минут позволяло в течение 1 часа постоянно поддерживать относительно одинаковую концентрацию допамина в крови, так как период его полувыведения из плазмы крови – около 2 минут, а из организма – 8 минут, так как инактивируется под действием моноаминоксидазы и катехол-О-метилтрансферазы до неактивных метаболитов [10]. Всасывание из брюшной полости крыс происходит по трем сосудистым сетям (мезентериально-портальной, мезентериально-экстрапортальной и экстра-мезентериальной) и лимфатическим сосудам, при этом довольно быстро, так как у взрослых крыс площадь поверхности брюшины составляет около 125 см2 [11]. Конечно, применяемый препарат не вводился в чистом виде, а растворялся в физиологическом растворе (0,1 мл в 199,9 мл, в 1 мл такого раствора было 20,0 мкг катехоламина), из которого отбирали для введения по 0,19 мл на 100 г веса. Контрольным животным в таком же объеме внутрибрюшинно вводили физиологический раствор.
Крыс помещали в закрывающиеся пластиковые воронки диаметром 18 см, в которых вся выделяющаяся моча в чистом виде стекала в мочеприемник (каловые массы туда не попадали). Мочу собирали за 3 часа, отдельно за каждый час.
Для исследования водовыделительной функции почек в плазме крови и моче методом Поппера спектрофотометрически (UNICO 2000, США) определяли содержание эндогенного креатинина с последующим расчетом скорости клубочковой фильтрации и канальцевой реабсорбции воды [12]. Уровень мочевины в плазме крови и моче определяли наборами «Лахема» (Чехия), а в ткани почек – в нашей модификации [13]. Содержание натрия в слоях ткани почек определялось пламенной фотометрией (ПФА-378, Россия), а процент воды рассчитывали по разнице веса влажной и высушенной ткани. Об уровне общего белка в плазме крови и моче судили по результатам, определяемым спектрофотометрически (APEL PD-303, Япония) с использованием биуретовой реакции и метода Лоури [12]. Объемную скорость почечного кровотока выясняли инвазивным способом с помощью ультразвукового флуориметра (Transonic НТ 313, США).
Содержание крыс, постановку опытов, их выведение из экспериментов проводили в соответствии с приказом Минздрава России от 01.04.2016 № 199н «Об утверждении Правил лабораторной практики». Разрешение на проведение экспериментов было выдано этическим комитетом академии 29.11.2018 № 8.7.
Полученные результаты статистически обрабатывали с помощью программ «GraphPad Prizm 8.01» и «Statistica 10», степень достоверности с применением параметрического метода сравнения средних величин оценивали по t-критерию Стьюдента, принимая за статистически значимое отличие от данных контроля при значении 0,05 и меньше. Нормальность распределения данных оценивали на основании критерия Шапиро–Уилка.
Результаты исследования и их обсуждение. Изучение водовыделительной функции почек крыс, получавших дофамин, показало, что диурез за первый час был 1,82±0,11 мл/час/100 г, что статистически значимо (р<0,001) отличалось от контроля, равного 1,32±0,09 мл/час/100 г. За второй час, когда ни опытным, ни контрольным крысам не вводили ни дофамин, ни физраствор, диурез у первых все-таки оставался повышенным (р<0,01), а за третий час отличий между ними не было, но средний диурез за 3 часа оставался статистически значимо больше – на 23,0% (р<0,05) после введения катехоламина (табл. 1).
Таблица 1
Диурез и основные процессы мочеобразования после введения дофамина
|
Исследуемые показатели |
Стат. показ. |
1 час |
2 часа |
3 часа |
Среднее за 3 часа |
|
|
Контроль |
||||
|
Диурез |
М±m |
1,32±0,09 |
0,68±0,04 |
0,31±0,03 |
0,77±0,06 |
|
Клубочковая фильтрация |
М±m |
16,34±1,13 |
12,08±0,84 |
10,37±0,62 |
12,93±0,86 |
|
Канальцевая реабсорбция |
М±m |
91,86±0,76 |
94,37±0,85 |
97,01±0,63 |
94,41±0,75 |
|
|
|
Введение дофамина |
|||
|
Диурез (мл/час/100 г) |
М±m |
1,82±0,11 |
0,90±0,06 |
0,29±0,03 |
1,00±0,07 |
|
р |
<0,001 |
<0,01 |
* |
<0,05 |
|
|
Клубочковая фильтрация (мл/час/100 г) |
М±m |
22,56±1,31 |
15,97±0,95 |
10,85±0,69 |
16,46±0,98 |
|
р |
<0,001 |
<0,01 |
* |
<0,05 |
|
|
Канальцевая реабсорбция (%) |
М±m |
91,93±0,82 |
94,36±0,92 |
97,32±0,58 |
94,53±0,77 |
|
р |
* |
* |
* |
* |
|
|
Примечание: * – отсутствие статистически значимых отличий от данных контроля |
|||||
Причиной повышения диуреза после введения дофамина за первые 2 часа было ускорение клубочковой фильтрации (табл. 1), скорость которой статистически значимо превысила контроль на 27,57% (р<0,01) и 24,36% (р<0,05) соответственно. За третий час отличий не было, но средняя скорость клубочковой фильтрации за 3 часа у крыс, получавших дофамин, превышала контрольные данные с введением физраствора на 21,45% (р<0,05). Это говорит о том, что изменение количества выделившейся мочи полностью было обусловлено объемом воды, профильтровавшейся в клубочках почек. Данные канальцевой реабсорбции воды после введения катехоламина не отличались от результатов контроля (табл. 1).
Что могло вызвать повышение скорости клубочковой фильтрации? Одной из основных причин, оказывающих непосредственное влияние на этот процесс, является скорость почечного кровотока, определение которой мы проводили после сбора мочи за каждый час. Введение крысам по 0,1 мл/100 г анестетика общего действия золетила (Франция) позволяло через несколько минут определять скорость почечного кровотока, которая у контрольных животных за первый час был 11,45±0,72 мл/мин, а у опытных – 15,68±1,12 мл/мин (р<0,001). Повышенной скорость почечного кровотока оставалась и за второй час, хотя катехоламин крысам уже не вводили (рис. 1). Очевидно, что повышенная скорость почечного кровотока за второй час была следствием остаточного влияния часового введения дофамина с вовлечением более долго текущих метаботропных процессов. За третий час контрольные и опытные данные не отличались друг от друга, но средняя скорость почечного кровотока за 3 часа статистически значимо (р<0,05) превосходила контроль – на 22,03% (рис. 1).
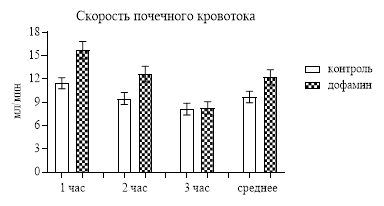
Рис. 1. Скорость почечного кровотока после введения дофамина
Так как канальцевая реабсорбция не влияла на изменение диуреза, то закономерно возникает вопрос о состоянии осмотического давления в ткани почек. Поэтому было исследовано содержание таких осмотически активных веществ, как мочевина и натрий, которые оказывают выраженное влияние на процесс обратного всасывания воды в дистальных канальцах и собирательных трубочках [14, 15].
Полученные данные выглядели следующим образом. После четырехкратного внутрибрюшинного введения дофамина в течение 1 часа содержание мочевины в слоях ткани почек не отличалось от данных контрольных крыс. И это наблюдалось во всех слоях почек (табл. 2).
Таблица 2
Содержание мочевины, натрия и воды в слоях ткани почек после введения дофамина
|
Исследуемые слои почек |
Стат. показат. |
Мочевина (мкмоль/г влажного веса) |
Натрий (мкмоль/г сухого веса) |
Вода (%) |
|
|
|
Контроль |
||
|
Корковое вещество |
М±m |
24,35±1,87 |
21,66±1,42 |
76,85±0,62 |
|
Мозговое вещество |
М±m |
48,92±3,45 |
35,78±2,15 |
80,33±0,84 |
|
Почечный сосочек |
М±m |
128,37±10,42 |
86,23±5,38 |
86,24±0,92 |
|
|
|
Введение дофамина |
||
|
Корковое вещество |
М±m // р |
24,16±1,26 // * |
22,08±1,21 // * |
77,05±0,49 // * |
|
Мозговое вещество |
М±m // р |
49,50±3,47 // * |
36,02±1,88 // * |
81,04±0,60 // * |
|
Почечный сосочек |
М±m // р |
126,72±8,13 // * |
89,23±4,55 // * |
85,63±0,74 // * |
|
Примечание: * – отсутствие статистически значимых отличий от данных контроля |
||||
Не было отличия и по содержанию натрия ни в корковом веществе, ни в мозговом, так же как и в почечном сосочке (табл. 2). При этом как в контроле, так и в опыте сохранялся градиент содержания и мочевины, и натрия в слоях почек. В частности, у опытных крыс содержание мочевины в мозговом веществе было в 2,05 раза больше, чем в корковом, а в почечном сосочке – в 5,24 раза. Градиент натрия мозговом веществе и почечном сосочке превосходил уровень коркового вещества в 1,63 и 4,04 раза соответственно. Введение дофамина не повлияло и на содержание воды в слоях почек (табл. 2).
Отсутствие изменений содержания осмотически активных веществ и воды в ткани слоев почек после введения крысам дофамина свидетельствует о том, что в них не меняется осмотическое давление, способное повлиять на обратное всасывание профильтровавшейся воды, поэтому показатели канальцевой реабсорбции не отличались от контрольных данных. Это также подтверждало и отсутствие изменений содержания воды в слоях почек (табл. 2) при сохранении отличий от коркового вещества (76,85±0,62%) до почечного сосочка (86,24±0,92%) в контроле и опыте (77,05±0,49% и 85,63±0,74% соответственно).
Не было выявлено изменений содержания в плазме крови креатинина, мочевины и общего белка после введения дофамина в течение 1 часа и взятия крови после этого, а также еще раз через 1 и 2 часа, т.е. за 3 часа (табл. 3).
Таблица 3
Содержание в плазме крови креатинина, мочевины и общего белка после введения дофамина
|
Исследуемые показатели |
Стат. показат. |
1 час |
2 часа |
3 часа |
|
|
|
Контроль |
||
|
Креатинин (мкмоль/л) |
М±m |
67,82±3,12 |
68,60±2,77 |
67,35±3,62 |
|
Мочевина (ммоль/л) |
М±m |
4,25±0,32 |
4,58±0,35 |
4,82±0,54 |
|
Общий белок (г/л) |
М±m |
59,72±3,28 |
61,84±3,92 |
64,20±4,86 |
|
|
|
Введение дофамина |
||
|
Креатинин |
М±m // р |
68,12±3,56 // * |
67,08±3,21 // * |
67,08±4,29 // * |
|
Мочевина |
М±m // р |
4,75±0,44 // * |
4,82±0,38 // * |
5,12±0,42 // * |
|
Общий белок |
М±m // р |
60,25±4,23 // * |
62,33±4,15 // * |
64,03±5,74 // * |
|
Примечание: * – отсутствие статистически значимых отличий от данных контроля |
||||
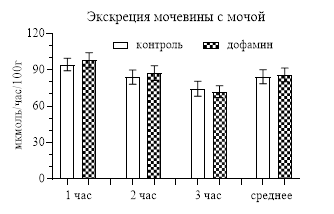
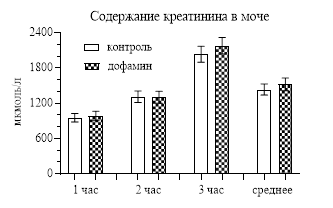
При исследовании влияния дофамина на содержание креатинина в моче было выявлено, что оно не менялось как за первый час, когда непосредственно вводился дофамин (954,45±48,92 мкмоль/л – контроль, 984,15±77,16 мкмоль/л – опыт), так и за остальные часы (рис. 2). То же происходило и с экскрецией мочевины: она практически не отличалась от контроля (рис. 2).
Рис. 2. Содержание креатинина в моче и экскреция мочевины после введения дофамина
Интересным оказалось влияние дофамина на обмен белка. Если на содержание общего белка в плазме крови катехоламин не оказывал влияния, то степень протеинурии после введение дофамина за первые 2 часа, особенно за первый (р<0,001), была статистически значимо меньше, чем у контрольных крыс, и, хотя за третий час отличий не было, но в среднем за 3 часа степень протеинурии была меньше контроля (р<0,05), т.е. создавалось впечатление, что дофамин снижает протеинурию (рис. 3). Но с учетом того, что диурез после введения дофамин повышался, то протеинурия была не истинной, а за счет разбавления большим объемом мочи. Поэтому, когда мы рассчитали экскрецию белка, то отличий между контрольными и опытными результатами не выявили (рис. 3), и в общем можно сказать, что часовое введение дофамина не оказывает влияния на выделение белка с мочой.
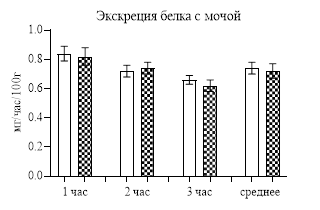
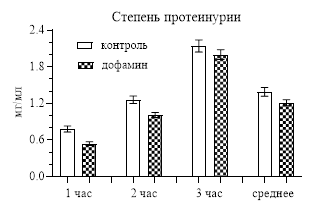
Рис. 3. Степень протеинурии и экскреция белка с мочой после введения дофамина
Заключение
Внутрибрюшинное введение крысам линии Вистар дофамина в дозе 2,5 мкг/кг/мин в течение 1 часа (150,0 мкг), ускоряя почечный кровоток, стимулирует скорость клубочковой фильтрации и повышает диурез в течение 2 часов, особенно первого часа. Увеличение диуреза обусловлено ускорением клубочковой фильтрации, в основе которого лежит увеличение скорости почечного кровотока. Канальцевая реабсорбция воды не влияет на диурез, что подтверждается отсутствием изменений осмотического давления в слоях почек, создаваемого в них мочевиной и натрием, но с сохранением градиента в слоях. Введение дофамина не оказало влияния на содержание креатинина, мочевины и общего белка в плазме крови и моче.
Библиографическая ссылка
Джиоев И.Г., Медоева Н.С., Гулиев М.А., Наниева А.Р., Авсанова О.Т. ВЛИЯНИЕ ДОФАМИНА НА МЕХАНИЗМ ВОДОВЫДЕЛИТЕЛЬНОЙ ФУНКЦИИ ПОЧЕК КРЫС // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31612 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31612



