Метаболический синдром (МС) и ассоциированное с ним ожирение относятся к числу наиболее распространенных заболеваний во всем мире как среди взрослых, так и детей. По оценке ВОЗ, более 1 млрд человек имеют избыточную массу тела, a более 300 млн человек – ожирение. За последние 10 лет потеря ВВП в России из-за преждевременных смертей от сердечно-сосудистых заболеваний, их лечения, а также нахождения работников из-за этого на больничных составила 8,2 трлн рублей. Осложнения, связанные с лишним весом и ожирением, обходится российским страховым компаниям в сумму от 21,6 до 22,1 млрд рублей в год. По данным Mc Kinsey Global Institute, экономический ущерб от ожирения в мире составляет около 2 трлн долларов [1].
Ожирение можно рассматривать как болезнь и как последствие воздействия современной цивилизации. Дети, подростки предпочитают высококалорийную пищу, много времени проводят у телевизора, компьютера, игровых приставок и др. У них не остается времени, а часто и желания на умственную и физическую активность, необходимую для нормального роста и развития [2].
Важную роль в возникновении массового ожирения на планете играют производство консервов, полуфабрикатов с длительным сроком хранения, фаст-фуд [3]. Повышенное потребление фруктозы с безалкогольными напитками, соками и предварительно упакованными продуктами питания увеличивает риск возникновения метаболического синдрома [4, 5]. Гормональные препараты и их аналоги применяют в птицеводстве и скотоводстве для сокращения сроков роста и созревания молодняка, а также стимуляции процессов яйцеобразования у птиц. При потреблении такого мяса у человека нарушается естественный баланс гормонов и, как следствие, появляется лишний вес [5].
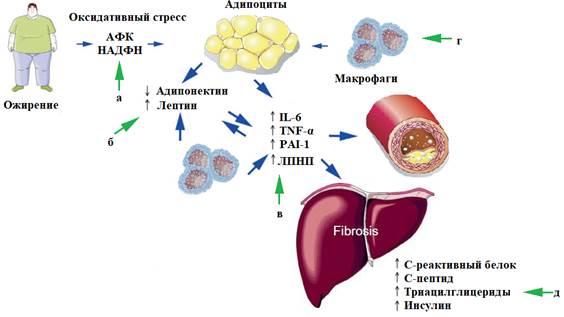
Рис. 1. Схема роли медиаторов воспаления и окисления в патогенезе атеросклероза и неалкогольной жировой болезни печени при метаболическом синдроме. Зелеными стрелками обозначены возможные механизмы лечебных эффектов фитоадаптогенов
Также важным фактором в развитии эпидемии ожирения является недостаточная продолжительность сна, следовательно, снижение выработки мелатонина, который влияет на все виды обмена, в том числе и липидный [6].
Метаболический синдром, или синдром-Х, характеризуется резистентностью к инсулину, гипергликемией, дислипидемией, гипертонией и ожирением; на его фоне увеличивается риск развития диабета 2-го типа и сердечно-сосудистых заболеваний [4]. Также повышается риск повреждения и возникновения неалкогольной жировой болезни печени [7], так как в силу своего стратегического положения (между кишечником и системой кровообращения) печень выступает в роли буферного органа для регуляции метаболических процессов [8]. При патологических состояниях происходит быстрое повышение в печени маркеров окислительного стресса. Например, при гипергликемическом состоянии печень подвергается повреждению, опосредованному повышенной выработкой активных форм кислорода (АФК) [9].
Избыточная масса висцерального жира обусловливает высокое содержание циркулирующих свободных жирных кислот и способствует поглощению их клетками. Снижение высвобождения адипонектина из разрастающейся белой жировой ткани брюшной полости уменьшает поглощение и окисление митохондриями жирных кислот во многих тканях [9, 10]. Несмотря на повышенную выработку лептина висцеральным жиром, который обычно усиливает окисление жирных кислот, устойчивость тканей к лептину дополнительно способствует накоплению жирных кислот в цитозоле. В результате накапливается избыток внутриклеточных жирных кислот и их метаболитов (ацетил-КоА, диацилглицерида), что вызывает резистентность к инсулину [10, 11].
МС является провоспалительным и протромботическим состоянием, при этом жировая ткань играет основную роль в его возникновении [12, 13]. Жировая ткань в настоящее время считается биологически активным эндокринным и паракринным органом. Усиливается глюконеогенез в печени и снижается поглощение глюкозы скелетными мышцами; последнее повышает содержание глюкозы в плазме и стимулирует высвобождение инсулина поджелудочной железой, что приводит к гиперинсулинемии [7]. Повышение содержания глюкозы в плазме в сочетании с высоким уровнем инсулина замыкают порочный круг, происходит дальнейший липогенез. Адипоциты подвергаются гипертрофии и гиперплазии в ответ на избыток питательных веществ, и, как следствие, клетки начинают испытывать гипоксию. Гипоксия может привести к некрозу клеток с инфильтрацией макрофагами и продукцией адипоцитокинов, которые включают провоспалительные медиаторы интерлейкин-6 (IL-6) и фактор некроза опухоли α (ФНО-α), а также ингибитор активатора плазминогена-1 (PAI-1) (рис. 1). Эти цитокины вызывают воспалительную реакцию и повышают резистентность адипоцитов к инсулину [4].
При отсутствии лечения ожирение быстро прогрессирует с развитием метаболических нарушений и возникновением сопутствующих заболеваний. Поэтому актуальными являются исследования по поиску новых способов лечения и профилактики метаболического синдрома, снижению риска возникновения побочных эффектов от проводимой терапии. Сложность патогенеза метаболического синдрома диктует необходимость разработки лекарственных препаратов широкого спектра фармакологической активности, которые бы воздействовали на несколько патогенетических звеньев и этиологических факторов данной патологии. Применение лекарственных растений с адаптогенными свойствами может стать значительным шагом в профилактике и лечении метаболического синдрома. Биологически активные вещества фитоадаптогенов (ФА), или модификаторы биологического ответа, воздействуют на центральные и местные регуляторные механизмы, модулируют состояние центральной нервной и эндокринной систем, чувствительность клеточных рецепторов к действию нейромедиаторов и гормонов [14–16]. ФА регулируют гомеостатические реакции через нейроэндокринную систему, контролируют стресс-активированные молекулярные шапероны (Hsp70), фактор транскрипции белка DAF-16. Адаптогены в условиях стресса повышают функциональную активность эпифиза [17]. ФА обладают индивидуальной терапевтической активностью и переносимостью, возрастающей с течением времени. ФА, применяемые в комплексе, модулируют биологические процессы. Среди известных и широко используемых фитоадаптогенов – солодка голая, родиола розовая, элеутерококк колючий (Glycyrrhiza glabra, Rhodiola rosea, Acanthopanax senticosus).
Целью исследования является обзор литературы за последние 10 лет в системах e-library и Pub-med, касающейся применения лекарственных растений в лечении и профилактике метаболического синдрома и ожирения.
Материалы и методы исследования. Проанализированы базы данных PubMed и e-library за период 2011–2021 гг. с использованием ключевых слов: «абдоминальное ожирение», «инсулинорезистентность», «метаболический синдром», «ожирение», «Acanthopanax senticosus», «Glycyrrhiza glabra», «Rhodiola rosea».
Результаты исследования и их обсуждение. Элеутерококк колючий (Acanthopanax senticosus) (AS) – лекарственное растение, относящееся к семейству аралиевых, произрастающее в России, Китае, Корее и Японии. Ранее из AS были выделены различные химические соединения, в том числе тритерпеноидные сапонины, хлорогеновая кислота, изофраксидин, элеутерозид В, элеутерозид Е и флавоноиды [18]. AS оказывает противовоспалительное, антиоксидантное, стресс-лимитирующее действие [15, 18, 19].
Ряд исследователей доказали, что AS эффективен в качестве профилактического средства против ожирения и диабета [19, 20]. Введение экстракта AS крысам, которые находились на диете с высоким содержанием жиров в течение 4 недель, значительно уменьшило прирост массы по сравнению с контрольными крысами, которые содержались на стандартной диете вивария [20], что указывает на его возможную роль в улучшении липидного профиля и предотвращении отложения жира в организме. Доказано, что потребление листьев AS позволяет регулировать уровень триглицеридов (ТГ) и холестерина в плазме крови мышей [21]. Предполагают, что уровень липидов в крови снижается за счет пищевых волокон в листьях AS, содержащих значительное количество клетчатки [21]. Было показано, что пищевые волокна снижают уровень ТГ в плазме и уровень холестерина, ингибируя всасывание пищевого холестерина или реабсорбцию желчных кислот [22]. Кроме того, Парнелл и Реймер выявили, что пищевые волокна увеличивали экскрецию желчных кислот с калом за счет повышения уровня экспрессии мРНК 7
Библиографическая ссылка
Дзампаева Ж.В., Нартикоева М.И. ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ КОМПЛЕКСНЫХ ФИТОАДАПТОГЕНОВ В ЛЕЧЕНИИ И ПРОФИЛАКТИКЕ МЕТАБОЛИЧЕСКОГО СИНДРОМА // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31581 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31581



