В настоящее время COVID-19 рассматривается как системное заболевание снарушением функции иммунной системы, поражением впервую очередь легких, атакже сердца, почек, кишечника. Кфакторам риска развития тяжелого течения COVID-19 относятся преимущественно возраст (старше 65 лет) икоморбидные состояния [1]. Одним из таких заболеваний является сахарный диабет [2]. Диабетическое поражение сосудов микроциркулярного русла и гликозилирование гемоглобина усугубляют нарушение газообмена в легких и гипоксию. СД 2-го типа характеризуется дисбалансом системы агрегатного состояния крови (повышение коагуляционной активности и уменьшение фибринолиза), что повышает риск возникновения жизненно угрожающих осложнений COVID-19 [3].
Любое тяжелое заболевание, в том числе COVID-19, у пациента с СД 2-го типа повышает риск развития острых состояний, прежде всего диабетического кетоацидоза и гиперосмолярного синдрома, которые еще в большей степени ухудшают прогноз пациента [2, 4]. Гипергликемия дополнительно повышает образование провоспалительных цитокинов, активированных кислородных метаболитов, ингибирует пролиферацию лимфоцитов [4, 5], что определяет более тяжелое течение COVID-19. По данным литературы, гипергликемия способна усиливать репликацию респираторных вирусов в клетках легких [2, 4, 6]. Таким образом, между COVID-19 и сахарным диабетом создается порочный круг, в котором COVID-19 приводит к увеличению гипергликемии, а сахарный диабет, в свою очередь, усугубляет тяжесть COVID-19.
В комплексной терапии COVID-19 широко применяются глюкокортикостероиды. Самый частый и нежелательный эффект при лечении препаратами данной группы – гипергликемия и развитие сахарного диабета. Глюкокортикостероиды замедляют метаболизм инсулина в печени, увеличивают глюконеогенез, снижают синтез инсулина клетками поджелудочной железы. Таким путем происходят еще больший рост глюкозы в крови и повышение инсулинорезистентности [4, 6].
Большинство исследований COVID-19 направлены на изучение патологических изменений легких, и лишь в редких исследованиях описаны морфологические изменения печени. Анализ литературы показал, что морфологические и морфометрические исследования ткани печени у пациентов с COVID-19 в условиях лекарственно-индуцированной гипергликемии и при фоновом заболевании «сахарный диабет 2-го типа» немногочисленны, это и определило цель исследования.
Цель исследования – изучить морфологические особенности повреждения печени при COVID-19 у пациентов с сахарным диабетом и лекарственно-индуцированной гипергликемией.
Материал и методы исследования
Проведена морфологическая оценка образцов печени от 40 пациентов (аутопсийный материал), умерших от коронавирусной инфекции в период октябрь – декабрь 2020 г. в УКБ № 1 СГМУ им. В.И. Разумовского г. Саратова. У всех пациентов основным заболеванием была выставлена коронавирусная инфекция, вызванная COVID-19 (вирус идентифицирован методом ПЦР, U07.1).
Весь секционный материал был разделен на 3 группы: 1-ю группу составили пациенты с фоновым заболеванием «сахарный диабет 2-го типа»; 2-ю группу составили пациенты, у которых среди осложнений основного заболевания отмечалась транзиторная гипергликемия, индуцированная глюкокортикостероидами; 3-ю группу составили пациенты, не имевшие эндокринной патологии.
Характеристика пациентов, вошедших в исследование, представлена в таблице 1.
Таблица 1
Клиническая характеристика пациентов
|
Параметр |
1-я группа – сахарный диабет n=14 |
2-я группа – гипергликемия, индуцированная глюкокортикостероидами n=12 |
3-я группа – группа сравнения n=14
|
|
Возраст, лет Медиана [25;75] |
59 [40;87] |
80 [65;85] |
69 [40;95] |
После стандартной гистологической проводки в спиртах возрастающей концентрации материал заливали в парафин. Срезы готовили с использованием ротационного микротома. Затем срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином.
Морфометрический анализ гистологических препаратов проводили с помощью микроскопа Micros МС 100 (TXP) и программы ImageView. В 10 полях зрения каждого случая при увеличении х40 подсчитывали следующие показатели: количество гепатоцитов, количество двуядерных гепатоцитов, площадь гепатоцита и площадь ядра, высчитывали ядерно-цитоплазматическое отношение. Фотографирование проводили с помощью микровизора медицинского проходящего света µVizo-101 (ЛОМО).
Статистический анализ выполняли в программе Exсel с расчетом медианы и межквартильного размаха (25-й и 75-й перцентили). При проверке количественных признаков на нормальность распределения большая часть их не подчинялась закону нормального распределения, поэтому морфометрические показатели попарно сравнивали с помощью критерия Манна–Уитни. Различия считали статистически достоверными при р<0,05.
Результаты исследования и их обсуждение
При микроскопии ткани печени пациентов 1-й группы во всех случаях наблюдали расширение синусоидов, отек и венозное полнокровие, умеренный перипортальный фиброз и лимфоидную инфильтрацию портальных трактов. В 10 случаях (75%) наблюдали рассеянную крупнокапельную и мелкокапельную жировую дистрофию, в 7 случаях (50%) отмечали центролобулярные некрозы, внутриклеточное скопление бурого пигмента липофусцина (рис. 1).
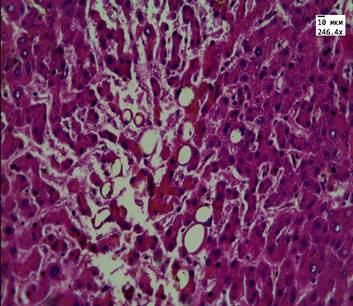
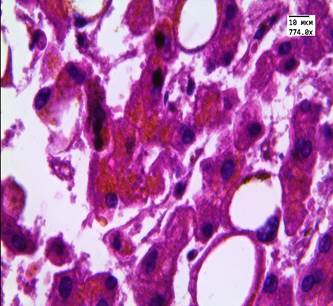
Рис. 1. Ткань печени пациента 1-й группы. Жировая дистрофия, очаги некроза гепатоцитов, накопление пигмента липофусцина. Ув. 246,4, 774. Окраска: гематоксилин-эозином
При микроскопии ткани печени в группе пациентов с гипергликемией также наблюдали признаки нарушения кровообращения в виде расширения пространств Диссе, перипортальный фиброз и лимфоидную инфильтрацию портальных трактов. В 7 случаях (58%) отмечали мелкокапельную жировую дистрофию и накопление в клетках пигмента липофусцина, в 4 случаях (33%) – очаги некроза (рис. 2).
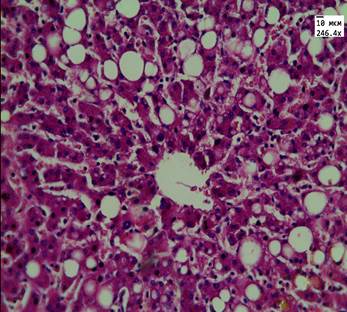
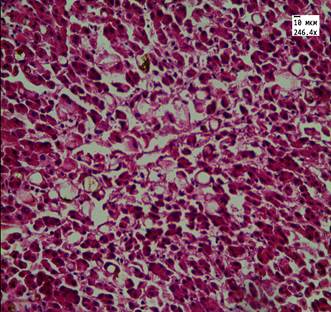
Рис. 2. Ткань печени пациента 2-й группы. Мелкокапельное и крупнокапельное ожирение ткани печени, очаги повреждения гепатоцитов. Ув. 246. Окраска: гематоксилин-эозином
При морфометрическом исследовании количество гепатоцитов в поле зрения колебалось от 30 до 77 (медиана 60), количество двуядерных гепатоцитов в среднем составило 3, площадь гепатоцита колебалась в пределах от 145 до 213,1 мкм2, а площадь ядра – от 11,8 до 18,9 мкм2, ядерно-цитоплазматическое соотношение было равно 0,09 (табл. 2).
В группе сравнения во всех случаях, так же как и в опытных группах, наблюдали признаки нарушения кровообращения, фиброз и очаговую лимфоидную инфильтрацию. В 2 случаях (14%) отмечали скопление бурого пигмента, единичную микровезикулярную жировую дистрофию, иных повреждений не было выявлено (рис. 3).
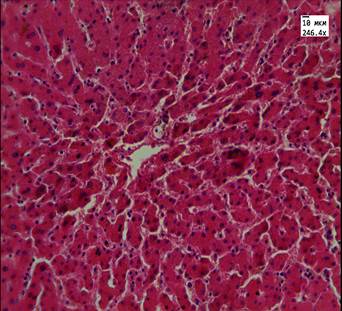
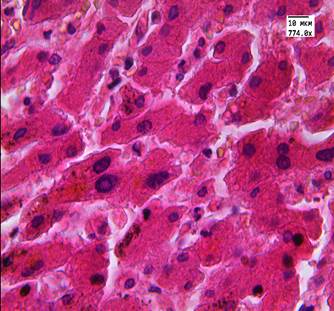
Рис. 3. Ткань печени пациента 3-й группы. Отложение пигмента липофусцина, увеличение ядер отдельных гепатоцитов, двуядерные клетки. Ув. 246,4, 774.
Окраска: гематоксилин-эозином
При морфометрическом исследовании количество гепатоцитов в поле зрения в среднем составило 86, количество двуядерных гепатоцитов – 4, площадь гепатоцита колебалась от 110,3 до 172,6 мкм2, а площадь ядра – от 10,4 до 17,9 мкм2, ядерно-цитоплазматическое соотношение было равно 0,1 (табл. 2).
Таблица 2
Морфометрические показатели исследуемых групп
|
Морфометрические показатели |
1-я группа (сахарный диабет) Me [25;75] |
2-я группа (гипергликемия) Me [25;75] |
3-я группа (сравнения) Me [25;75] |
Критерий Манна-Уитни (p1, p2)* |
|
Количество гепатоцитов в поле зрения |
18 [20;82] |
60 [30;77] |
86 [45;118] |
р1=0,1; р2=0,09; |
|
Количество двуядерных гепатоцитов в поле зрения |
9 [4;13] |
3 [2;8] |
4 [2;5] |
р1=0,07; р2=0,1; |
|
Площадь гепатоцита (мкм²) |
104 [79,7;134,1] |
181 [145;213,1] |
132 [110,3;172,6] |
р1=0,04; p2=0,05; |
|
Площадь ядра (мкм²) |
24,1 [16,1;41] |
15,1 [11,8;18,9] |
13,7 [10,4;17,9] |
р1=0,02; р2=0,1; |
|
Ядерно-цитоплазматическое соотношение |
0,25 [0,2; 0,6] |
0,09 [0,07;0,11] |
0,1 [0,08;0,16] |
р1=0,008; р2=0,09; |
Р1 – при сравнении 1-й и 3-й групп; р2 – при сравнении 2-й и 3-й групп
По результатам микроскопического исследования выявлено, что во всех 3 группах наблюдались: отек, венозное полнокровие, лимфоцитарная инфильтрация портальных трактов, накопление бурого пигмента липофусцина. Данные повреждения печени могут являться следствием прямого действия COVID-19, гипоксии или же быть связаны с лекарственным повреждением печени, о чем свидетельствуют результаты других авторов [7, 8].
Наиболее высокий рискнеблагоприятного исхода COVID-19 имеют пациенты ссахарным диабетом 2-го типа, ожирением, артериальнойгипертензией. Данные заболевания выступают главными причинами альтерации печени упациентов сCOVID-19. [9].
В нашем исследовании при морфометрическом анализе ткани печени в группе лиц с сахарным диабетом количество гепатоцитов в поле зрения и их площадь были наименьшими, что можно связать с массивными очагами некроза.
В то же время такие морфометрические показатели, как количество двуядерных гепатоцитов и площадь ядра, были выше, чем в группе сравнения, что может свидетельствовать о компенсаторной реакции ткани печени на повреждение.
ГипергликемияупациентовсCOVID-19 встречается достаточно часто. Это может быть связано с назначением глюкокортикостероидов, а также с деструкцией панкреатических β-клеток [8, 9].
При сравнении морфометрических показателей группы пациентов с индуцированной гипергликемией и пациентов 3-й группы было выявлено уменьшение количества гепатоцитов в поле зрения и снижение количества двуядерных гепатоцитов, однако эти различия были статистически не значимы. Статистически значимые различия наблюдались в показателе «площадь гепатоцита». Увеличение размеров гепатоцитов в группе стероидиндуцированной гипергликемии можно связать с компенсаторной гипертрофией клеток печени при инфекции.
Заключение
В результате исследования было установлено, что у пациентов всех групп в ткани печени наблюдаются умеренный перипортальный фиброз и лимфоцитарная инфильтрация портальных трактов, жировая дистрофия разной степени выраженности и внутриклеточное накопление липофусцина.
Максимально выраженное повреждение печени отмечали в группе больных сахарным диабетом (очаги некрозов, паренхиматозная жировая дистрофия, снижение количества и уменьшение площади гепатоцитов). Наряду с повреждением в ткани печени наблюдались и компенсаторно-приспособительные процессы в виде увеличения количества двуядерных гепатоцитов, увеличения ядра и ядерно-цитоплазматического соотношения в клетках.
При гипергликемии, которая у данных пациентов может быть связана как с приемом глюкокортикостероидов, так и с цитопатическим действием на клетки поджелудочной железы коронавирусной инфекции, отмечались деструктивные процессы в печени, но в меньшей степени выраженности, чем при сахарном диабете.
Библиографическая ссылка
Палатова Т.В., Воронина Е.С., Коромысленко Ю.Р., Кондратьева Е.В., Ивлиев И.И., Маслякова Г.Н. МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В ПЕЧЕНИ ПРИ COVID-19 У ЛИЦ, СТРАДАВШИХ САХАРНЫМ ДИАБЕТОМ // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31576 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31576



