Лечение остеомиелитических дефектов метаэпифизарной области требует особого подхода, это обусловлено следующими факторами: риском распространения воспалительного процесса в суставную полость, быстрым формированием обширных костных дефектов, ограниченными возможностями радикальной резекции костной ткани данной области, опасностью патологического внутрисуставного перелома [1]. Одним из способов замещения приобретенных дефектов, в том числе в условиях активной гнойной инфекции и остеомиелитического процесса, является техника индуцированной мембраны, предложенная А.Masquelet в 1986 году. Она включает в себя проведение последовательного двухэтапного хирургического вмешательства. На первом этапе производят радикальную хирургическую обработку гнойного очага и заполняют дефект костным цементом с антибиотиком. Антибактериальный спейсер поддерживает стабильность в зоне дефекта, способствует санации гнойного очага за счет высвобождения антибиотиков и индуцирует тканевую мембрану. Согласно проведенным исследованиям, индуцированная мембрана образуется с 4-й недели после установки спейсера. Ее структура представлена васкуляризованным матриксом на основе коллагена [2]. Иммуногистохимические исследования подтвердили наличие в мембране факторов роста: костного морфогенетического белка 2, трансформирующего фактора роста бета, фактора роста эндотелия сосудов, ангиогенного фактора Виллебранда и CD31 [3; 4]. Данные особенности индуцированной мембраны создают благоприятные условия для репаративных процессов без риска рассасывания аутотрансплантата на следующем этапе реконструкции дефекта [5; 6]. Все известные работы по применению эффективной двухэтапной методики касаются замещения диафизарных дефектов [7; 8]. Основой для формирования мембраны в диафизарной области является надкостница и окружающие мягкие ткани. Метаэпифизарная область лишена надкостницы, посттравматические изменения в этой области часто сопровождаются потерей мягких тканей и нарушением кровоснабжения [1; 9]. Мы проанализировали собственные данные хирургического лечения остеомиелита у 628 пациентов за 3 года и получили следующие результаты. Оказалось, что в общей структуре остеомиелита 48% рецидивов наблюдается в метаэпифизе и лишь 7% в диафизе. Исследования по применению метода индуцированной мембраны при хроническом остеомиелите метаэпифизарной области в научной литературе представлены лишь единичными клиническими примерами [10; 11]. Эта локализация остеомиелитического процесса требует поиска альтернативного метода лечения.
Цель исследования: в эксперименте определить возможность образования индуцированной мембраны в условиях хронического очагового остеомиелита метаэпифизарной области.
Материалы и методы исследования
Эксперимент проводили в виварии ФГБОУ ВО «ПИМУ», сертифицированном Государственной ветеринарной службой Нижегородской области согласно Приказу Минздравсоцразвития РФ № 708н от 23.08.2010 г. «Об утверждении правил лабораторной практики», в соответствии с «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург, 18.05.2014 г.) и оборудованном по категории «Specific pathogen free» (SPF).
Экспериментальное исследование выполнено на 20 кроликах породы шиншилла, мужского пола, массой тела 2000-2500 граммов. Возраст 6-8 месяцев. Первоначально всем животным формировали очаг хронического остеомиелита метаэпифизарной области по отработанной методике (Патент 2720838).
Оперативное вмешательство проводили под комбинированным обезболиванием в положении животного на спине. По внутренней поверхности проксимальной трети голени удаляли волосяной покров, производили трехкратную обработку операционного поля 0,5%-ным спиртовым раствором хлоргексидина. Выполняли разрез кожи 2,0 см с последующим доступом через все слои мягких тканей к проксимальному метаэпифизу большеберцовой кости. Производили гемостаз раны. Затем формировали стандартизированный костный дефект четырехгранным конусовидным сверлом диаметром 0,5 см с ограничителем на глубину 0,5 см. В зону дефекта погружали предварительно импрегнированную микробной взвесью аллокость, подготовленную путем погружения аллогенной кости весом 1 грамм на 15 минут в раствор микробной взвеси с концентрацией микробных клеток 6×108 КОЕ/мл по стандарту для оптической стандартизации бактерий 1 МакФарланда (McF), с плотностью раствора 1 г/мл. Рану послойно ушивали. На 3-й день после оперативного вмешательства производили удаление части швов из средней трети раны и разведение её краев для инициирования свищевого хода. На 21-й день формировался очаг хронического остеомиелита, подтвержденный данными клинического наблюдения, бактериологического, рентгенологического, патоморфологического исследований.
Первый этап оперативного вмешательства включал радикальную хирургическую обработку остеомиелитического очага и имплантацию антибактериального спейсера. Животным под комбинированным обезболиванием выполняли трансфистулезный доступ к зоне остеомиелитического очага. Производили хирургическую обработку с иссечением нежизнеспособных тканей, удалением свищевых ходов, секвестров, рубцовых, грануляционных тканей. Для дополнительной санации выполняли промывание костной полости и окружающих мягких тканей 0,05%-ным раствором хлоргексидина биглюконата. После тщательного гемостаза в костную полость имплантировали спейсер из костного цемента с добавлением Ванкомицина и Цефбактама. Дополнительно для окрашивания спейсера добавляли 1%-ный раствор метиленового синего. Раны ушивали узловыми швами.
Через 4 недели выполняли второй этап оперативного вмешательства - удаление антибактериального спейсера и костную аутопластику дефекта. Доступ к зоне ранее установленного спейсера осуществляли по старому послеоперационному рубцу. Мембрану аккуратно рассекали скальпелем и разводили ее края крючками, осуществляя доступ к спейсеру (рис. 1а). Путем фрагментации производили его удаление с сохранением мембраны (рис. 1б). Часть капсулы иссекали для гистоморфологического исследования. Затем выполняли доступ к гребню подвздошной кости и производили взятие аутотрансплантата. Рану послойно ушивали. Костную полость заполняли измельченным костным трансплантатом (рис. 1в) и покрывали капсулой. Производили ушивание раны.
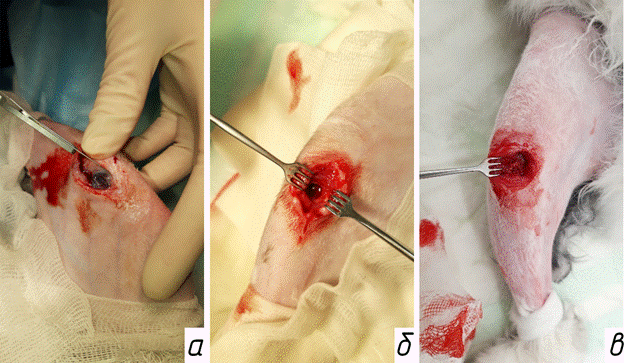
Рис. 1: а - осуществление доступа к спейсеру с сохранением мембраны; б - вид костного дефекта после удаления спейсера; в - заполнение костного дефекта аутотрансплантатом из гребня подвздошной кости
Для определения пролиферативной активности и наличия новообразованных сосудов проводили иммуногистохимическое исследование иссеченных участков капсулы с маркерами Ki-67 и CD-31. Экспериментальный материал фиксировали в 10%-ном формалине. После фиксации образцы отправляли в стандартную гистологическую проводку на аппарате Excelsior ES (Thermo Scientific, USA). Заливка в парафиновые блоки с использованием заливочной станции HistoStar (Thermo Scientific, USA). После проводки изготавливали парафиновые блоки. Серийные срезы толщиной 4-6 микрон получали на микротоме Microm HM 325 (Thermo Scientific, USA). Срезы окрашивали гематоксилином и эозином при помощи станции для окраски Gemini AS (Thermo Scientific, USA). Для морфометрической обработки полученного материала использовали микроскоп Leica 2500 (Leyca Biosystems, UK).
Иммуногистохимическое окрашивание проводили вручную. Протокол окрашивания включал предварительную депарафинизацию срезов и демаскировку в течение 20 минут при температуре 98-99 °С. Далее проводили инкубацию срезов с первичными антителами, были использованы моноклональные мышиные антитела к Ki67, clone MIB-1 (Dako, Дания), и вторичными козьими антимышиными антителами Goat Anti-Mouse IgG H&L, Alexa Fluo ® 488 (Abcam, USA). Ядра клеток докрашивали красителем DAPI (BD Pharmingen, USA).
Результаты исследования и их обсуждение
При формировании модели остеомиелита у животных к 3-му дню после оперативного вмешательства наблюдалось снижение физической активности, повышение температуры тела, нарушение функции оперированной конечности. С 3-го дня после снятия части швов и разведения краев послеоперационной раны выделялось умеренное количество геморрагического отделяемого, которое к 7-10-му дню сменялось гнойным отделяемым жидкой или творожистой консистенции. На 14-й день эксперимента формировался незаживающий свищевой ход. На 21-й день эксперимента сохранялся функционирующий свищевой ход, восстанавливалась опороспособность оперированной конечности, отмечалось улучшение аппетита, температура тела нормализовалась (рис. 2а). По данным компьютерной томографии, на 21-й день после операции визуализировали полость с неровными склерозированными краями, заполненную множественными костными секвестрами, отеком прилежащих мягких тканей и наличием свищевого хода (рис. 2б).
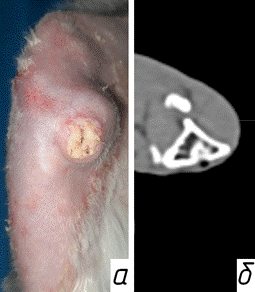
Рис. 2: а - вид раны на 21-е сутки после оперативного вмешательства; б - компьютерная томография остеомиелитического очага проксимального метаэпифиза правой большеберцововй кости на 21-е сутки после оперативного вмешательства
После первого этапа оперативного вмешательства у животных наблюдалось снижение физической активности, нарушение функции оперированной конечности. В области послеоперационной раны в течение 3-х дней отмечалось незначительное геморрагическое отделяемое. К 7-му дню опороспособность восстанавливалась. Рана заживала первичным натяжением, без признаков воспаления.
Через 4 недели на втором этапе оперативного вмешательства интраоперационно визуализировали формирование мембраны. Она имела вид тонкого, белесоватого цвета тяжа, плотно прилегающего к поверхности спейсера. Бактериологическое исследование раневого отделяемого после извлечения антибактериального спейсера демонстрировало отсутствие роста микрофлоры. Микроскопическое исследование экспериментального материала показало формирующуюся мембрану, состоящую из нежноволокнистой фиброзной ткани, внутренняя часть которой содержала фрагменты синовиальной оболочки, а внешняя часть состояла из фибробластов, миофибробластов и коллагена (рис. 3 а, б). Отмечен диффузный отек и полнокровие сосудов (рис. 3в). Многоядерные гигантские клетки типа инородных тел не обнаруживались. Мембрана была обильно васкуляризована многочисленными мелкими капиллярами, присутствующими во всех слоях образца. Для характеристики васкуляризации мембраны и пролиферативной активности новообразованной фиброзной ткани проводилась иммуногистохимическая реакция к СD 31 (рис. 4а) и Ki-67 (рис. 4б).
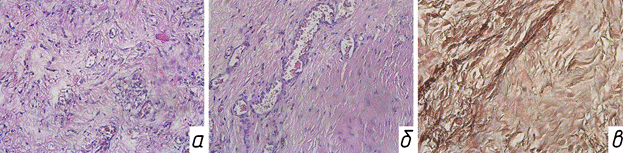
Рис. 3: а - экспериментальный материал. Ув. Х200. Окраска гематоксилином и эозином. Фрагмент мембраны, состоящий из нежноволокнистой фиброзной ткани с множеством капилляров; б - экспериментальный материал. Ув. Х200. Окраска гематоксилином и эозином. Нежноволокнистая фиброзная ткань с признаками отека и полнокровия сосудов; в - экспериментальный материал. Ув. Х200. Окраска трихром по Массону, показывающая нежноволокнистые соединительнотканные волокна
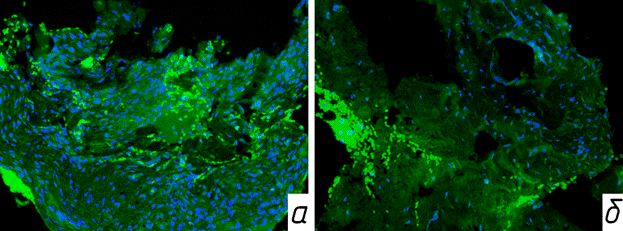
Рис. 4: а - иммуногистохимическое окрашивание с использованием антитела к Ki67 - Goat Anti-Mouse IgG H&L, Alexa Fluo ® 488. Ув. Х600. Активность Ki-67 в индуцированной мембране; б - иммуногистохимическое окрашивание с использованием антитела к CD31 - Goat Anti-Mouse IgG H&L, Alexa Fluo ® 488. Ув. Х600. Активность неоангиогенеза в индуцированной мембране
Методика реконструкции кости, описанная A. Masquelet, сочетает в себе индукцию мембраны с помощью цементного спейсера с последующей аутотрансплантацией из губчатой ткани [5; 12; 13]. Первая роль спейсера - механическая, поскольку он устраняет инвазию фиброзной ткани в реципиентный участок. Вторая роль - биологическая, путем индукции окружающей мембраны, гистологическая характеристика которой уже изучена. Мембраны, образовавшиеся на границе раздела кости, имеют определенные гистологические и гистохимические характеристики. В нашем исследовании мембрана также имела вид синовиальной оболочки с небольшим количеством воспалительных клеток. Окружающая волокнистая капсула была в основном расположена параллельно поверхности спейсера. Мы также наблюдали в исследовании очень слабую реакцию на инородное тело. Ангиогенез в настоящее время признан важным этапом в остеогенезе, и клетки микрососудов идентифицированы как имеющие прямое отношение к образованию кости [14; 15] из-за их близости к остеобластам и остеопродуктивным клеткам в местах образования новой кости, обеспечивая адекватную васкуляризацию, а затем формирование кости. Что и было показано нами в исследовании. Через 4 недели от начала эксперимента доказаны активная пролиферация клеток индуцированной мембраны и неоангиогенез.
Выводы
1. Индуцированная мембрана активно формируется в остеомиелитическом очаге метаэпифизарной области через 4 недели после имплантации антибактериального спейсера.
2. Пролиферативная активность клеток индуцированной мембраны и их склонность к неоангиогенезу могут способствовать васкуляризации аутотрансплантата и дальнейших регенеративных процессов в нем.
3. Полученные данные позволяют использовать данный способ как альтернативный вариант лечения метаэпифизарных остеомиелитических дефектов.
Библиографическая ссылка
Королев С.Б., Митрофанов В.Н., Живцов О.П., Орлинская Н.Ю., Юлина Д.П., Рассихин Н.Е. КЛИНИКО-МОРФОЛОГИЧЕСКАЯ И ИММУНОГИСТОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ИНДУЦИРОВАННОЙ МЕМБРАНЫ ПРИ ХРОНИЧЕСКОМ ОЧАГОВОМ ОСТЕОМИЕЛИТЕ МЕТАЭПИФИЗАРНОЙ ОБЛАСТИ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31563 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31563



