Рак шейки матки (РШМ) является распространенным видом рака среди женщин во всем мире. Наиболее высокую нагрузку РШМ дает на страны с низким и средним уровнями доходов из-за ограниченного доступа к услугам общественного здравоохранения. ВОЗ признала РШМ глобальной проблемой общественного здравоохранения. [1]. В России, которая является страной со средним уровнем доходов [2], уровень заболеваемости РШМ значительно превышает целевой уровень, установленный ВОЗ для его элиминации [3]. Для профилактики РШМ и его раннего выявления в России бесплатно 1 раз в 3 года среди женщин проводится цитологический скрининг [4]. Однако заболеваемость РШМ и смертность от него в России на протяжении более чем 10 последних лет не снижаются [5].
Причиной РШМ является вирус папилломы человека (ВПЧ). Этот факт был признан в 1996 г. Всемирной организацией здравоохранения, Европейской исследовательской организацией по генитальным инфекциям и новообразованиям (European Research Organization on Genital Infection and Neoplasia) и Национальными Институтами Здравоохранения США на их совместной конференции по РШМ (National Institutes of Health Consensus Conference on Cervical Cancer) [6]. В 2021 г. ВОЗ выпустила новое руководство по профилактике РШМ, в котором отмечено, что тестирование методом выявления ДНК ВПЧ в рамках профилактики РШМ зарекомендовало себя как более эффективный метод по сравнению с другими используемыми в текущее время методами скрининга [7].
Скрининг на РШМ проводится в соответствии с установленным порядком через достаточно длительные временные промежутки, и его целью в первую очередь является профилактика РШМ. Выявление РШМ во время скрининга в России происходит немногим более чем в трети его случаев – по информации интернет-портала Государственного бюджетного учреждения здравоохранения Республики Карелия «Республиканский онкологический диспансер», РШМ в 2020 г. был выявлен во время профилактических медицинских осмотров у 39,3% заболевших им в Карелии, и это соответствует среднероссийскому показателю [8]. На этом же интернет-портале указано, что в Карелии РШМ на ранних стадиях диагностируется в 69% случаев. Следовательно, в оставшемся 31% случаев (немногим менее чем треть) РШМ диагностируется на стадиях, в которых успешность его лечения снижается. Возможно, это частично связано с тем, что женщины уклоняются от психологически некомфортной процедуры гинекологического осмотра. Известно, что перед гинекологическим осмотром все пациентки испытывают тревогу [9].
Поэтому актуальны исследования, посвященные раннему выявлению РШМ с помощью малоинвазивных процедур. Поиск маркеров РШМ в крови для его раннего выявления является одним из направлений таких исследований. Можно ожидать, что пациентки будут меньше уклоняться от тестов, определяющих маркеры РШМ в крови, чем от гинекологического осмотра, так как при венепункции уровень тревоги низкий [10]. Исследователи предлагают для раннего выявления РШМ определять циркулирующую опухолевую ДНК РШМ. Существует мнение, что признаком наличия опухолевой ДНК РШМ в крови является обнаружение циркулирующей ДНК ВПЧ, так как полагается, что циркулирующая внеклеточная ДНК, содержащая одну или несколько копий генома ВПЧ, происходит из трансформированных клеток и может быть ранним биомаркером РШМ [11].
В основном циркулирующую ДНК ВПЧ для выявления РШМ определяют в образцах плазмы и сыворотки с помощью ПЦР в различных ее модификациях, используя праймеры для амплификации фрагмента ДНК, кодирующего участок белка E7 ВПЧ (ДНК Е7 ВПЧ), так как считается, что ДНК Е7 ВПЧ является оптимальным кандидатом в маркеры РШМ [12]. На примере кератиноцитов было показано, что белок E7 стимулирует репликацию и клеточное деление таким образом, что клетки остаются способными к репликации даже после их дифференцировки [13]. В исследовании E. Jeannot и соавт. с использованием праймеров для амплификации ДНК Е7 ВПЧ чувствительность способа с помощью капельной цифровой ПЦР (Droplet Digital PCR) составила 87% [14]. А в исследовании P. Rungkamoltip и соавт. чувствительность с помощью схожего способа составила 31%, а после его модификации выросла до 100% [15].
Цель исследования. В этой статье мы представляем результаты проведенного нами стартового исследования по созданию малоинвазивного молекулярно-генетического теста для раннего выявления РШМ, который будет основан на детекции в крови определенных фрагментов циркулирующей ДНК. Поскольку для широкого использования тест должен быть легко воспроизводим и экономически доступен, были поставлены следующие задачи: во-первых, провести исследование методом ПЦР-РВ, который осуществляется на универсальном, широко распространенном лабораторном оборудовании, и, во-вторых, использовать в исследовании праймеры, которые широко применяются в клинических и лабораторных исследованиях, а значит, должны быть доступны, в том числе по их стоимости. В рамках этих задач было запланировано выполнить детекцию ДНК в крови у пациентки с РШМ, используя праймеры для амплификации фрагмента ДНК, кодирующего участок белка L1 ВПЧ (ДНК L1 ВПЧ). Также было решено выполнить детекцию фрагмента ДНК, кодирующего участок β-глобина генома человека, в крови у этой же пациентки. Детекцию указанных фрагментов ДНК осуществили во фракциях крови, практически не содержащих клеточных ядер, а именно в плазме и эритроцитарной фракции.
Опираясь на результаты научных работ сторонних исследователей и нашего анализа этих работ, ниже мы приводим доводы для обоснования принятых решений о совместной детекции этих фрагментов ДНК как возможного маркера РШМ в указанных фракциях крови.
Во-первых, хотя известно, что при развитии РШМ изменения в инфицированной клетке прерывают репликацию ВПЧ, поэтому вирионы-потомки не продуцируются [16] и экспрессия L1 плохо поддерживается [17], все-таки не все инфицированные клетки у пациентов с РШМ подвергаются раковой трансформации, соответственно репликация ВПЧ при РШМ может все-таки присутствовать.
Во-вторых, есть вероятность, что ВПЧ может связываться с эритроцитами на их поверхности. На примере эксперимента с мышами показано связывание с поверхностными рецепторами их эритроцитов вирусоподобных частиц, имеющих белок L1, полученный из вируса папилломы крупного рогатого скота типа 1 [18]. К тому же рецептор ВПЧ – гепарансульфат [19] – идентифицирован на эритроцитах человека [20].
В-третьих, поскольку в исследовании C.E. Cocuzza и соавт. показано, что ДНК L1 ВПЧ может быть обнаружена в плазме женщин не только с РШМ, но и с дисплазиями шейки матки [21], в качестве возможного показателя малигнизации клеток шейки матки мы посчитали факт присутствия в безъядерных фракциях крови у пациенток с РШМ вместе с фрагментами ДНК ВПЧ также фрагментов ДНК β-глобина генома человека, так как известно, что ген β-глобина человека активно экспрессируется клетками карциномы шейки матки [22].
В-четвертых, эритроциты способны нести на своей поверхности экстрацеллюлярные везикулы [23], часть которых представлена экзосомами [24], в том числе, по нашему мнению, опухолевыми экзосомами. Имеются доказательства наличия в экзосомальной ДНК опухолевого происхождения всего генома опухолевых клеток [25]. Поэтому мы не исключили присутствия в эритроцитарной фракции заключенных в экзосомы фрагментов ДНК, кодирующих белок L1 ДНК ВПЧ, и фрагментов ДНК, кодирующих β-глобин генома человека.
В-пятых, эритроциты способны нести на своей поверхности ДНК, связанную с поверхностью клетки (сell-surface-bound extracellular DNA), которая, как было показано, образуется не без участия опухолевых клеток [26]. И поэтому, по нашему мнению, при РШМ не исключается возможность присутствия на поверхности эритроцитов ДНК, которая включает гены, кодирующие белок L1 ДНК ВПЧ, и гены, кодирующие β-глобин генома человека.
Материалы и методы исследования. Исследование было проведено в соответствии с этическими принципами Хельсинкской декларации Всемирной медицинской ассоциации (WORLD MEDICAL ASSOCIATION, DECLARATION OF HELSINKI). Также на него было получено одобрение Местного комитета по биомедицинской этике Северо-Восточного федерального университета имени М.К. Аммосова (Якутск, Республика Саха (Якутия), Россия) в соответствии с протоколом № 13 от 4 апреля 2018 г., Решение № 2.
Материалом для исследования явилась венозная кровь пациентки с впервые выявленным РШМ, жительницы Якутии. На момент забора крови к пациентке не был применен ни один из видов лечения РШМ. Пациентка дала письменное информированное согласие на проведение исследования.
Венозная кровь была забрана путем венепункции в вакуумные контейнеры для забора крови с K3-EDTA. Из крови были подготовлены 3 вида биоматериала – образцы плазмы (1), эритроцитарной взвеси (2) и эритроцитарной взвеси, обработанной трипсином (3). Третий вид биоматериала служил контролем присутствия искомых фрагментов ДНК на поверхности эритроцитов, а также контролем чистоты эритроцитарной взвеси. Если после обработки трипсином в эритроцитарной взвеси будут обнаружены фрагменты ДНК β-глобина генома человека, то это не будет исключать наличия в ней ядерных клеток, например нейтрофилов.
Для разделения крови на фракции ее сначала центрифугировали при 1600 об/мин в течение 10 минут. На этом этапе были получены образцы плазмы (1) и эритроцитарная фракция. Затем эритроцитарную фракцию объемом 1 мл трижды отмыли фосфатным буфером для получения образца эритроцитарной взвеси (2). Образец эритроцитарной взвеси, обработанной трипсином (3), получили следующим образом: в половину объема образца эритроцитарной взвеси, приготовленной способом, который описан выше, добавили 0,25%-ный раствор трипсина в соотношении 1:1 и инкубировали при температуре 37°С в течение 10 минут, после инкубации центрифугировали для получения осадка; затем нижнюю часть осадка трижды отмыли фосфатным буфером, и этот биоматериал был включен в исследование как образец эритроцитарной взвеси, обработанной трипсином.
Все образцы до выделения ДНК и проведения ПЦР-РВ хранились в морозильнике при температуре –20°С.
ДНК из образцов была выделена с помощью фенол-хлороформного метода. Концентрацию и качество выделенной ДНК определяли с использованием наноспектрофотометра, следуя инструкции производителя [27].
ПЦР-РВ проводилась на амплификаторе CFX96 (Biorad) с использованием готовой реакционной смеси qPCRmix-HS SYBR+LowROX (Evrogen) согласно параметрам, рекомендуемым производителем [28].
Для детекции фрагментов ДНК, кодирующих белок L1 ДНК ВПЧ, и фрагментов ДНК, кодирующих β-глобин генома человека, использовались праймеры MY09/11 (5'-CGTCCMARRGGAWACTGATC-3'/5'- GCMCAGGGWCATAAYAATGG-3') и PC03/04 (5'-ACACAACTGTGTTCACTAGC-3'/5'-CAACTTCATCCACGTTCACC-3') соответственно.
Длину ампликонов определяли методом электрофореза в агарозном геле.
Результаты исследования и их обсуждение. Во всех 3 образцах ДНК была обнаружена и выделена в достаточной концентрации: в образцах плазмы и эритроцитарной взвеси, обработанной трипсином, концентрация ДНК была выше верхней границы чувствительности наноспектрофотометра, а в эритроцитарной взвеси концентрация имела значение 3773 нг/мл.
В результате проведения ПЦР-РВ с праймерами MY09/11 и PC03/04 было выявлено следующее:
– для ДНК, извлеченной из плазмы: фрагмент ДНК, кодирующий белок L1 ДНК ВПЧ, и фрагмент ДНК, кодирующий β-глобин генома человека, обнаружены не были (рис. 1);
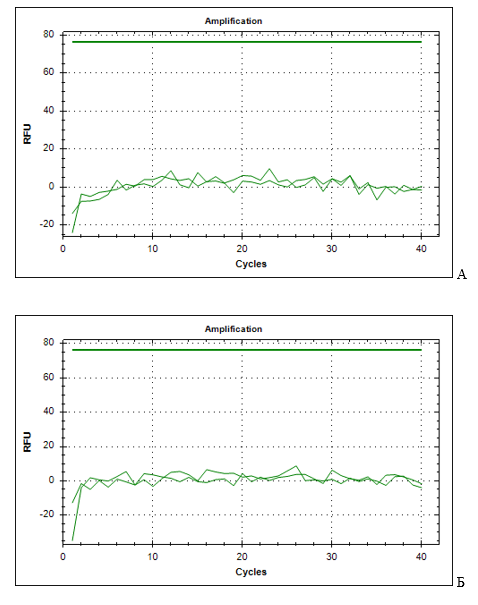
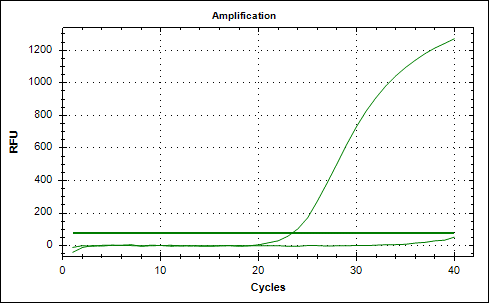
Рис. 1. Графики накопления флуоресцентного сигнала амплификации фрагментов ДНК, выделенной из плазмы пациентки с РШМ. А – амплификация фрагмента ДНК, кодирующего белок L1 ДНК ВПЧ, и Б – кодирующего β-глобин генома человека – для ДНК, извлеченной из эритроцитарной взвеси: для фрагмента ДНК L1 ВПЧ был получен сомнительный результат амплификации, в то время как фрагмент ДНК, кодирующий β-глобин генома человека, был обнаружен (рис. 2);
 А
А
 Б
Б
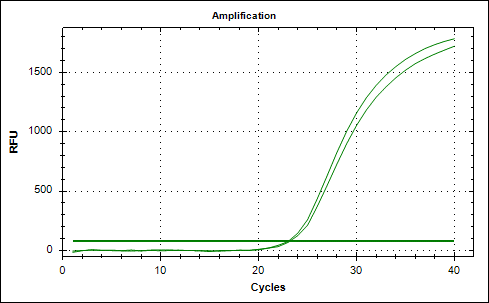
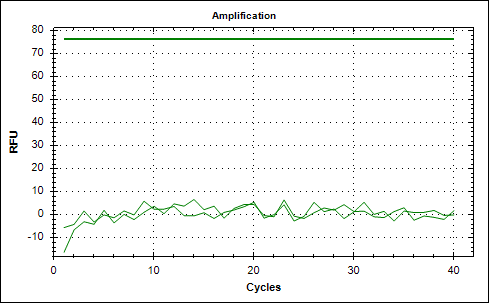
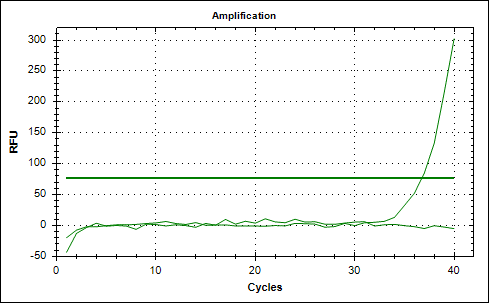
Рис. 2. Графики накопления флуоресцентного сигнала амплификации фрагментов ДНК, выделенной из эритроцитарной взвеси пациентки с РШМ. А – амплификация фрагмента ДНК, кодирующего белок L1 ДНК ВПЧ, и Б – кодирующего β-глобин генома человека – для ДНК, извлеченной из эритроцитарной взвеси, обработанной трипсином: фрагмент ДНК L1 ВПЧ не обнаружен, а для фрагмента ДНК, кодирующего β-глобин генома человека, был получен сомнительный результат амплификации (рис. 3).
 А
А
 Б
Б
Рис. 3. Графики накопления флуоресцентного сигнала амплификации фрагментов ДНК, выделенной из эритроцитарной взвеси, обработанной трипсином, у пациентки с РШМ. А – амплификация фрагмента ДНК, кодирующего белок L1 ДНК ВПЧ, и Б – кодирующего β-глобин генома человека
Проведенный электрофорез подтвердил наличие продуктов амплификации в образцах, где в результате ПЦР-РВ произошла амплификация изучаемых фрагментов исходной ДНК, а также подтвердил отсутствие продуктов амплификации фрагментов ДНК, с которыми при проведении ПЦР-РВ не произошло накопления флуоресцентного сигнала. В образцах с сомнительным результатом амплификации проведенной ПЦР-РВ было выявлено следующее: электрофорез показал наличие продуктов амплификации для извлеченного из эритроцитарной взвеси фрагмента ДНК, который кодирует L1 ДНК ВПЧ, и показал отсутствие продуктов амплификации для извлеченного из эритроцитарной взвеси, обработанной трипсином, фрагмента ДНК, который кодирует участок β-глобина генома.
Электрофорез выявил, что продукты ПЦР-РВ имеют размеры от 50 пн до 200 пн. Этот размер соответствует рекомендуемым размерам ампликонов для получения последовательных и надежных результатов ПЦР-РВ [29].
Таким образом, у пациентки с впервые выявленным РШМ в эритроцитарной взвеси не наблюдалось безусловного отсутствия продуктов амплификации с праймерами для ДНК L1 ВПЧ и подтвердилось наличие генов β-глобина генома человека. Так как в эритроцитарной взвеси, обработанной трипсином, присутствие продуктов амплификации изучаемых генов исходной ДНК не было подтверждено, можно предположить, что циркулирующая ДНК, которая может быть маркером РШМ, прикреплена к поверхности эритроцитов с помощью рецепторов.
Возможность прикрепления ДНК, в том числе опухолевой ДНК, к поверхности эритроцитов была обсуждена выше. Однако в этом эксперименте ДНК, пусть даже в которой не произошла детекция изучаемых генов, была обнаружена в эритроцитарной взвеси после обработки ее трипсином. Мы упомянули в самом начале раздела, что ДНК была выявлена в этом образце в достаточной концентрации, и это будет являться предметом обсуждения для продолжения исследования. Вероятно, обнаружение ДНК в эритроцитарной взвеси после обработки ее трипсином связано с неспецифическим связыванием ДНК с поверхностью эритроцитов. Во всяком случае, на примере ядерных клеток в исследовании Д.Н. Беляева показана адсорбция фаговой и плазмидной ДНК к мышиным фибробластам и клеткам миеломы, при этом дополнительная предобработка клеток трипсином не влияла на эффективность адсорбции ДНК [30].
Заключение. Конечно, наше исследование имеет ограничения – мы не исключаем технических ошибок. Поэтому исследование должно быть расширено – требуется большее количество пациенток как с РШМ, так и с неоплазиями шейки матки и здоровых пациенток. Важным сейчас для продолжения исследования представляется использование других праймеров для ДНК ВПЧ и ДНК человека наряду с использованными в этой работе. Также необходимо собрать более широкую личную, в том числе медицинскую, информацию о пациентках.
Тем не менее, наша стартовая экспериментальная работа показала, что исследование по обнаружению в безъядерных фракциях крови фрагментов циркулирующей ДНК с помощью ПЦР-РВ с использованием доступных праймеров для ДНК ВПЧ и ДНК человека должно быть продолжено. Такое исследование может лечь в основу создания доступного по стоимости и легко воспроизводимого малоинвазивного молекулярно-генетического теста для раннего выявления РШМ.
Библиографическая ссылка
Кононова И.В., Мамаева С.Н., Алексеев В.А., Васильев И.В., Николаева Н.А., Иноземцева Л.О. ОБНАРУЖЕНИЕ ЦИРКУЛИРУЮЩЕЙ ДНК В БЕЗЪЯДЕРНЫХ ФРАКЦИЯХ КРОВИ У ПАЦИЕНТКИ С РАКОМ ШЕЙКИ МАТКИ // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31543 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31543



