Обзор научной литературы свидетельствует о многочисленных результатах исследований во всем мире, демонстрирующих частое повышение показателей гликемии у пациентов без предшествующих нарушений углеводного обмена, а также декомпенсацию гликемии у пациентов с сахарным диабетом на фоне заболевания COVID-19. Было показано, что острая гипергликемия у обеих групп пациентов является важным фактором риска смерти при COVID-19. Сообщалось, что острая гипергликемия встречается примерно у 50% пациентов, госпитализированных с COVID-19, в то время как распространенность диабета в той же популяции составила около 7% [1]. Возможно несколько вариантов объяснения гипергликемии у пациентов с COVID-19.
В первую очередь возможна стресс-индуцированная гипергликемия, которая может нормализоваться после разрешения острой ситуации [2]. Вторым фактором гипергликемии может служить действие лекарственных препаратов, а именно глюкокортикостероидов (ГКС), ингибиторов протеазы ВИЧ первого поколения, а также фторхинолоновых антибиотиков. Применяемая у пациентов с COVID-19 терапия ГКС может спровоцировать развитие СД (так называемый стероид-индуцированный СД) и увеличить уровень гипергликемии у пациентов, уже имеющих в анамнезе СД. При применении ГКС наблюдается увеличение постпрандиальной гликемии, а уровень глюкозы натощак остается в норме или повышается незначительно. У пациентов с COVID-19, принимающих ГКС, повышен риск возникновения таких острых опасных состояний, как диабетический кетоацидоз или гиперосмолярное гипергликемическое состояние, поэтому очень важно своевременно корригировать гипергликемию, возникшую на фоне терапии ГКС [3]. Совокупный вклад приема лекарственных препаратов, используемых при лечении COVID-19, в наблюдаемое увеличение концентрации глюкозы в сыворотке крови еще предстоит оценить.
Третьей причиной гипергликемии может являться повреждение клеток поджелудочной железы. В работах C. Steenblock с соавторами было экспериментально доказано, что SARS-CoV-2 избирательно заражает β-клетки островков человека in vitro и обнаруживается в клетках поджелудочной железы умерших от COVID-19 пациентов. Они также продемонстрировали, что инфекция SARS-CoV-2 ослабляет уровень и секрецию инсулина поджелудочной железы и индуцирует апоптоз β-клеток. Анализ фосфопротеомных путей инфицированных островков указывает на апоптотическую сигнализацию β-клеток, аналогичную той, которая наблюдается при диабете 1-го типа. В то же время инфекция также сопровождается огромной выработкой цитокинов, которые могут вызывать резистентность к инсулину [4].
Частота выявления гипергликемии у пациентов с COVID-19 требует мониторинга и последующего наблюдения за данными пациентами с целью исследования и установления в данной патологии роли каждой из перечисленных выше причин. Большинству пациентов при выписке из стационара моноинфекционного госпиталя рекомендуется получение консультации врача-эндокринолога с целью уточнения диагноза нарушения углеводного обмена, а также дальнейшего динамического наблюдения.
Уже более 10 лет общепризнанным показателем выраженности и степени компенсации нарушений углеводного обмена является уровень HbA1c. Было разработано множество тестов для определения концентрации HbA1c, основанных как на методах разделения, так и на химических методах. На сегодняшний день для определения HbA1c наибольшую распространенность получил метод высокоэффективной жидкостной хроматографии (ВЭЖХ) стандартизированный NGSP (The National Glycohemoglobin Standartization Program). Он является референсным методом, что подтверждает высокую точность и надежность получаемых результатов, обусловленных низким коэффициентом вариации, отсутствием интерференции с другими фракциями гемоглобина, а также прямым определением HbA1c [5].
В работах ученых Национального медицинского исследовательского центра эндокринологии во главе с М.В. Шестаковой описан повышенный уровень HbA1c (≥6,5%) у пациентов с COVID-19, впервые выявленный в остром периоде инфекции, в сочетании с нормальными показателями глюкозы крови натощак (без сахароснижающей терапии) и глюкозы крови при поступлении, что не соответствует критериям истинного СД. Ими было выдвинуто предположение, что, возможно, вирус SARS-CoV-2 может непосредственно повреждать молекулу гемоглобина, приникая внутрь эритроцитов. При этом метод высокоэффективной жидкостной хроматографии, используемый для анализа степени соединения глюкозы с молекулой гемоглобина, определяет не только процесс гликозилирования гемоглобина, но и гликозилированные спайки вируса, что и приводит к завышению уровня HbA1c в остром периоде заболевания и возможному снижению данного показателя после выздоровления и элиминации вируса [6].
Цель исследования – детальный анализ хроматограмм, полученных в ходе исследования уровня HbA1c пациентов с COVID-19.
Материалы и методы исследования. Исследование HbA1c выполнено референсным методом ВЭЖХ на анализаторе D-10 (Bio-Rad, USA) с использованием реагентов и контрольных материалов производителя. В исследование были отобраны 45 пациентов с лабораторно подтвержденной инфекцией COVID-19, находившихся на лечении в моноинфекционном госпитале на базе РКБ ФГБУЗ ЮОМЦ ФМБА России. Медиана возраста пациентов с COVID-19 составила 69 лет, соотношение мужчин/женщин (%) – 46,7/53,3. Сравнение производилось с хроматограммами 45 пациентов, направленных на обследование врачами поликлинического отделения РКБ ФГБУЗ ЮОМЦ ФМБА России в период, предшествовавший пандемии. Тем самым полностью исключен вариант включения в анализ контрольной группы хроматограмм пациентов, перенесших COVID-19. Медиана возраста пациентов в контрольной группе составила 66 лет, соотношение мужчин/женщин (%) – 46,7/53,3 соответственно.
Образцы венозной крови набирались в пробирки с ЭДТА и хранились при 4°С вплоть до анализа, который выполнялся не позднее чем через 2 дня. При этом согласно инструкции допускается максимально возможный срок хранения 7 дней. Перед самим анализом пробы стояли 30 минут на столе и нагревались до комнатной температуры, далее тщательно перемешивались. С целью исключения попадания микросгустков, согласно инструкции к набору, проводилась пробоподготовка образцов: во вторичные пробирки наливали 1,5 мл буфера для разведения, входящего в набор реактивов, и добавляли 5 мкл цельной крови. Образцы перемешивались, проходили визуальную оценку на наличие в пробе микросгустка и подвергались анализу с последующей распечаткой хроматограмм на встроенном в анализатор D-10 принтере. Параллельно в серии проводился контроль качества с использованием контрольного материала двух уровней фирмы-производителя Bio-Rad (США).
Накопление и систематизация исходной информации полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2016. Статистический анализ проводился с использованием онлайн-калькуляторов сайтов https://medstatistic.ru/, https://www.math10.com/.
Количественные показатели оценивались на предмет соответствия нормальному распределению, для этого использовался критерий Шапиро–Уилка. Описание количественных данных представлено в виде медианы (Me) и интерквартильного интервала [25;75]. Для определения статистической значимости различий средних величин использовался U-критерий Манна–Уитни. Различия показателей считались статистически значимыми при уровне значимости p<0,05.
Результаты исследования и их обсуждение. Полученные в ходе анализа на HbA1c хроматограммы пациентов с COVID-19 сопоставили с хроматограммами контрольной группы пациентов, направленных на данное исследование еще до возникновения пандемии. В используемом нами методе определения HbA1с методом ВЭЖХ прибор создает градиент концентрации за счет изменения скорости подачи буферов на хроматографическую колонку, благодаря чему происходит разделение различных фракций гемоглобина (Hb).
Значения pI HbA1c и Hb отличаются на 0,02 единицы. Этого различия достаточно, чтобы обеспечить отделение HbA1с от негликированного Hb с помощью ВЭЖХ. Наиболее распространенными помехами являются варианты Hb, повышенные уровни HbF и другие производные. Помимо HbA1c, наиболее распространенными производными являются HbCarb и пре-HbA1с (основание Шиффа). Было доказано, что при гликировании других форм гемоглобина pI меняется, что позволяет HbA1c элюироваться отдельно [7].
Известно, что на интерпретацию результатов также влияют нарушение обмена триглицеридов, билирубина, железа, анемия, избыточное применение определенных групп лекарственных препаратов. Кроме того, у пациентов с аномальными формами гемоглобина, например у больных с серповидными эритроцитами, уровень гликированного гемоглобина будет занижен. Кроме того, если человек страдает анемией, сильными кровотечениями, результаты анализа у него тоже могут быть заниженными. Напротив, завышенными показатели А1с бывают при недавно перенесенном переливании крови [8].
Метод ВЭЖХ позволяет также выявить аномальные формы гемоглобина, так как любая модификация молекулы белка отражается на его заряде и, соответственно, будет видна на графике отдельной фракцией либо «ступенью» на стандартно имеющемся пике. Результаты исследования представляются в виде распечатки с хроматограммой и сообщением, идентифицирующим все обнаруженные пики и относительный процент каждого. Поэтому ложно сниженным также считалось бы определение уровня HbA1c при обнаружении увеличения представленности других фракций [9]. Корректный график сбора фракций (рис. 1) и уровни значений минорных фракций, не критичных для интерпретации анализа, определены и указаны в наборе для определения HbA1с методом ВЭЖХ на анализаторе D-10 фирмы Bio-Rad (USA).
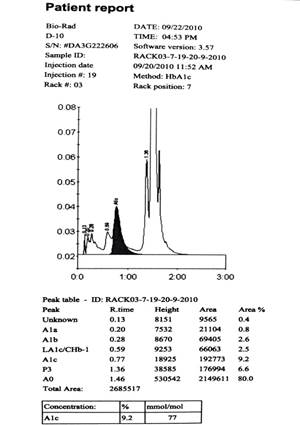
Рис. 1. Стандартный отчет и хроматограмма диабетического образца с повышенным уровнем HbA1c на анализаторе D-10 (инструкция Bio-Rad)
Наш анализ не выявил смазывания пиков, дополнительных пиков как в зоне выхода пика HbA1c, так и на всем графике хроматограммы (табл. 1, рис. 2).
Таблица 1
Содержание минорных фракций в хроматограммах контрольной и опытной групп
|
Показатель, % |
A1a |
A1b |
F |
LA1c/CHb-1 |
P3 |
|
контроль |
1,4 [1,2;1,7] |
1,3 [0,9;1,7] |
0,8 [0,7;0,95] |
1,8 [1,7;2,0] |
6,4 [6,2;6,7] |
|
COVID-19 |
1,5 [1,3;1,8] |
1,9 [1,5;2,1]* |
0,65 [0,28;0,85] |
1,8 [1,6;2,1] |
7,1 [6,7;7,5]* |
* – достоверные различия между группами, р<0,05.
У пациентов с COVID-19 выявлено достоверно значимое (р<0,05) увеличение представленности фракций A1b и P3 – на 27,1% и 10,9% соответственно. Однако сами значения этих минорных фракций у пациентов с COVID-19 составляют: 1,9% для A1b и 7,1% для P3, что не превышает критического порога в 10% и поэтому никак не влияет на достоверность расчета HbA1c. Более высокий уровень P3 может свидетельствовать об увеличении разрушенного Hb [10]. Чистота формы пиков и полная идентичность времени их сбора свидетельствуют об отсутствии интерференции в ходе анализа. Принимая во внимание высокую аналитическую значимость метода и его соответствие общепринятым стандартам, можно заключить, что вероятность столь точного совпадения pI HbA1c и с другими формами вирус-модифицированного гемоглобина крайне мала [10]. Это объясняется изменением pI любого белка в ходе всех посттрансляционных модификаций, будь это окисление или гликирование.
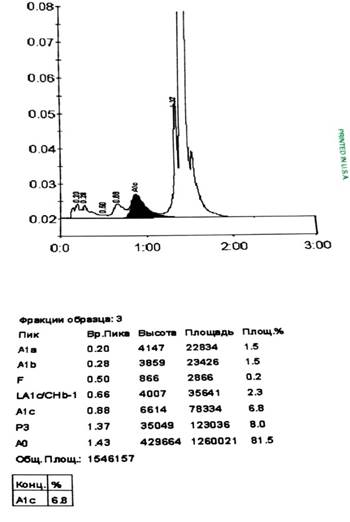
Рис. 2. Отчет и хроматограмма HbA1c пациента с COVID-19 на анализаторе D-10 (Bio-Rad)
Описаны клинические случаи существенного аномального снижения уровня HbA1c у пациентов, перенесших COVID-19, при повторном исследовании HbA1c через 6 недель, что не согласуется с общепринятым фактом об изменении HbA1c в соответствии со временем жизни эритроцита около 120 дней [11]. Старые эритроциты погибают, а молодые занимают их место ежедневно, а значит, необходимо интерпретировать полученные результаты уровня HbA1c у пациентов, перенесших COVID-19, с позиции изменений скорости эритропоэза.
Возникающее при COVID-19 снижение снабжения тканей кислородом детектируется почками, что приводит к выделению эритропоэтина и стимуляции эритропоэза. Эритропоэтин стимулирует пролиферацию и дифференциацию клеток-предшественников красного кровяного ростка, что приводит к ускоренному эритропоэзу в кроветворных тканях и увеличению выхода эритроцитов в кровь. В монографии Е.А. Липуновой и М.Ю. Скориной подробно описаны адаптационные системы крови. При хронической гипоксии адаптация сопровождается изменением содержания гемоглобина и его свойств, интенсивности дыхания и анаэробного гликолиза. Кроме того, изменяются геометрия и реология красных клеток крови, играющих ключевую роль в транспорте респираторных газов. Также отмечается снижение активности каталазы эритроцитов, что приводит к появлению эндогенной перекиси водорода, вызывающей окислительное разрушение гемоглобина, образование телец Гейнца,
эритродиерез. Продукты распада эритроцитов (свободный гемоглобин, его дериваты, фрагменты мембран и др.) также могут инициировать эритропоэз. Длительное стрессирование нарушает динамическое равновесие в системе эритрона, что приводит к сокращению жизненного цикла эритроцитов до 75 суток. Омоложение состава крови начинается на 15-е сутки [12].
Е.Д. Гольдберг показал, что гипоксия различного генеза приводит к выраженной гиперплазии эритроидного ростка кроветворения. При активации костномозгового компартмента системы эритрона наблюдается возрастание количества ретикулоцитов в периферической крови. Поступление большого количества молодых форм эритроцитов в кровь отражалось на снижении осмотической резистентности эритроцитов на фоне увеличения их объема [13].
Shima Shahbaz и соавторы обнаружили, что по мере усиления тяжести симптомов у пациентов с COVID-19 наблюдался выход незрелых форм эритроцитов из костного мозга в кровь, достигая 60% у тяжелых больных. Однако кислород способны переносить только зрелые эритроциты, время жизни которых составляет 120 дней. Для компенсации истощения здоровых незрелых эритроцитов организм вырабатывает их значительно больше, чтобы обеспечить организм достаточным количеством кислорода.
У пациентов с COVID-19 вначале наблюдается снижение оксигенации крови на раннем этапе дыхательной недостаточности. Предварительные отчеты о моделировании показали, что SARS-CoV-2 может ингибировать метаболизм гема и индуцировать денатурацию гемоглобина. Таким образом, изменение гемоглобина может привести к снижению кислородсодержащей способности эритроцитов у пациентов COVID-19, что приводит к гипоксии. Следовательно, истощение эритроцитов атипичной пневмонией при COVID-19 может привести к стрессовому эритропоэзу в качестве компенсаторного механизма для удовлетворения потребности в кислороде, что вызывает обилие предшественников эритроидов в крови [14].
С учетом вышеизложенного считаем, что при интерпретации уровня HbA1c у пациентов, переболевших COVID-19, необходимо учитывать доказанное усиление эритропоэза при гипоксии, обусловливающей степень тяжести течения данного заболевания. При COVID-19 происходит изменение или нарушение скорости обновления эритроцитов, и, следовательно, диагностика СД должна основываться на использовании критериев определения показателей гликемии.
Кроме того, следует учесть и усиление скорости гликирования в условиях гипергликемии при COVID-19. Чем выше концентрация глюкозы в крови, тем больше образуется гликированного гемоглобина. В опытах in vitro на коммерческих препаратах альбумина и гемоглобина показано, что скорость гликирования белка коррелирует с концентрацией глюкозы.
В работах А.А. Панариной и соавторов показано, что количество мембраносвязанного гемоглобина увеличивается прямо пропорционально степени гипергликемии и на уровне 20 мМ/л превышает содержание в условиях нормогликемии почти в 2 раза. Гликозилирование гемоглобина реально проявляется лишь в условиях высокой гипергликемии. Инкубация эритроцитов в среде с содержанием глюкозы 20 мМ/л сопровождается увеличением степени гликозилированности гемоглобина на 74% [15].
Выводы. Представленные в работе данные многочисленных исследований свидетельствуют о возможной разнонаправленности изменений уровня HbA1c у пациентов, перенесших COVID-19. С одной стороны, у пациентов развивается гипергликемия, что увеличивает скорость гликирования и уровень HbA1c. С другой стороны, оценить реальный уровень HbA1c можно только при учете усиления эритропоэза на фоне имеющейся у пациентов гипоксии. Поэтому мы считаем, что у пациентов, перенесших COVID-19, корректная интерпретация HbA1c и использование его в качестве общепринятого критерия в диагностике и оценке эффективности лечения СД возможны только после нормализации эритропоэза.
Библиографическая ссылка
Дурканаева О.А., Мирошниченко Ю.А. КОРРЕКТНОСТЬ ИСПОЛЬЗОВАНИЯ ГЛИКОЗИЛИРОВАННОГО ГЕМОГЛОБИНА В ДИАГНОСТИКЕ НАРУШЕНИЙ УГЛЕВОДНОГО ОБМЕНА У ПАЦИЕНТОВ, ПЕРЕНЕСШИХ COVID-19 // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31541 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31541



