Проблема высокой смертности населения в России от сердечно-сосудистых заболеваний остается довольно острой [1]. В основе сосудистых заболеваний, таких как гипертензия, лежит нарушение регуляции сократительных и электрических свойств гладкомышечных клеток (ГМК). Известно, что сократительная активность сосудистых ГМК изменяется при набухании или сжатии клеток [2]. В нормальных физиологических условиях изменение объема клеток наблюдается при пролиферации, росте, гибели клеток, при различных видах клеточной подвижности [Ошибка! Источник ссылки не найден.]. Также изменение клеточного объема может наблюдаться и при патологических состояниях. Так, было показано, что при развитии легочной гипертензии происходит увеличение объема гладкомышечных клеток легочной артерии [4]. Одним из основных регуляторов объема клеток является Na+, K+, 2Cl- -котранспорт (NKCC), который влияет как на электрическую, так и на сократительную активность ГМК [2; Ошибка! Источник ссылки не найден.]. Также предполагается, что в сократительных ответах ГМК на изменения объема участвуют неселективные механочувствительные калиевые каналы, реагирующие на растяжение. Изменение осмотического градиента при движении ионов через эти каналы может объяснять влияние растяжения и сжатия клеток на их электрофизиологические параметры [5].
Другим звеном регуляции сократительной активности сосудистых ГМК являются газотрансмиттеры (NO, CO, H2S) [6]. В наших работах и в работах других авторов [6; Ошибка! Источник ссылки не найден.] было показано вазодилятирующее действие этих молекул. Газотрансмиттеры синтезируются во многих типах клеток, включая эндотелиальные и гладкомышечные [6; Ошибка! Источник ссылки не найден.]. Обладая высокой липофильностью, газотрансмиттеры легко проходят через мембраны клеток и взаимодействуют с мембранными и внутриклеточными эффекторами, модулируя их активность [6]. Однако значение эндогенных газов в механизмах регуляции объема клеток, в том числе ГМК легочной артерии, изучено недостаточно. Это определяет необходимость выявления существующих взаимосвязей механизмов действия газотрансмиттеров и объем-зависимой системы регуляции сократительной функции ГМК легочной артерии.
Цель исследования: исследовать вклад калиевой проводимости мембраны в механизмы регуляции сократительной активности сегментов легочной артерии крысы при действии монооксида углерода в условиях моделирования набухания и стрикции гладкомышечных клеток.
Материал и методы исследования
Исследование проводили на кольцевых сегментах легочной артерии крысы (10 самцов линии Wistar массой 180–250 г) по стандартной методике, подробно описанной ранее в статье Баскакова М.Б. и соавт., 2013 [8]. Уход за животными и выведение их из эксперимента осуществляли в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных» и Европейской конвенции по защите позвоночных животных. После извлечения у животного ветвей легочной артерии, идущих вдоль бронхов крупных калибров, отпрепарировали жировую и соединительную ткань, нарезали кольцевые сегменты (2-3 мм), эндотелий удаляли механически. Далее сегменты помещали в ванночку с раствором Кребса. Механическое напряжение (МН) гладкомышечных кольцевых сегментов сосудов измеряли с помощью установки Myobath II (World Precision Instruments). Во время эксперимента в омывающем сегмент растворе поддерживалась температура 37 °C. Состав используемого раствора Кребса: 120,4 мМ NaCl, 5,9 мМ KCl, 2,5 мМ CaCl2, 1,2 мМ MgCl2, 5,5 мМ глюкозы, 15 мМ NH2C(CH2OH)3, pH 7,4. Гиперосмотическую стрикцию получали путем помещения сосудистого гладкомышечного сегмента (СГМС) в гиперосмотический раствор (добавление 120 мМ сахарозы в раствор Кребса). Для моделирования гипоосмотического набухания СГМС помещали в раствор Кребса, содержащий 40 мМ NaCl. Для получения изooсмотической стрикции СГМС инкубировали в течение 60 минут в гипоосмотическом растворе, а затем помещали в раствор Кребса. Гиперкалиевый раствор получали путем эквимолярного замещения в растворе Кребса 15 мM NaCl на KCl. Амплитуду сократительных ответов СГМС рассчитывали в процентах от амплитуды гиперкалиевого сокращения и/или от сокращения, индуцированного гиперосмотическим раствором. В экспериментах использовали реактивы (Sigma-Aldrich): донор монооксида углерода tricarbonyldichlororuthenium(II) dimer (CORM II), неселективный блокатор калиевых каналов тетраэтиламмоний (TЭA). Статистическую обработку результатов проводили с помощью программы IBM SPSS Statistics 17.0. Результаты представлены как медиана и межквартильный интервал (Q25–Q75). Различия показателей считали статистически значимыми при р<0,05 [9].
Результаты исследования и их обсуждение
Исследование влияния СО и калиевой проводимости на гиперкалиевое сокращение
Контрольное сокращение СГМК получали добавлением в камеру гиперкалиевого раствора Кребса (15 мМ KCl), который вызывает рецептор-независимую деполяризацию мембраны ГМК и активирует потенциал-зависимый вход Са2+. Для исследования калиевой проводимости мембраны использовали неселективный блокатор калиевой проводимости ТЭА (10 мМ). ТЭА увеличивал исходное МН сосудистых сегментов до 50,93 (29,22; 58,65) % от контрольного гиперкалиевого сокращения (p<0,05, n=8), а при аппликации во время фазы плато гиперкалиевого сокращения ТЭА повышал амплитуду сокращения до 107,33 (103,86; 111,36) % от контрольного гиперкалиевого сокращения (p<0,05, n=8) (рис. 1).
Донор монооксида углерода CORM II (50 мкМ) снижал амплитуду гиперкалиевого сокращения до 83,16 (73,96;87,70) % от контрольного сокращения (рис. 1). Предварительная обработка блокатором калиевых каналов уменьшала релаксирующее действие CORM II: величина гиперкалиевого сокращения составила 95,36 (91,48; 99,24) % от гиперкалиевого сокращения на фоне ТЭА (p<0,05, n=8) (рис. 1).
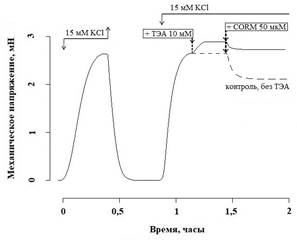
Рис. 1. Влияние ТЭА (10 мМ) и CORM II (50 мкМ) на амплитуду гиперкалиевого сокращения СГМС. Добавление и удаление тестирующих соединений показано стрелками
Исследование влияния СО и калиевой проводимости на гиперосмотическую стрикцию
Помещение СГМС в раствор, содержащий 120 мМ сахарозы (гиперосмотический раствор), приводило к развитию сократительного ответа, амплитуда которого составила 66,2 (57,3; 75,45) % от гиперкалиевого сокращения. Добавление в этих условиях CORM II (50 мкМ) приводило к снижению амплитуды гиперосмотической стрикции до 73,08 (60,36; 77,05) % от гиперосмотического сокращения (p<0,05, n=8). ТЭА (10 мМ) дополнительно увеличивал величину гиперосмотической стрикции до 128,74 (124,71; 129,86) % от контрольного сокращения, но устранял релаксирующий эффект CORM II (50 мкМ): МН составило 99,43 (97,26; 101,83) % от гиперосмотической стрикции в присутствии ТЭА (рис. 2А).
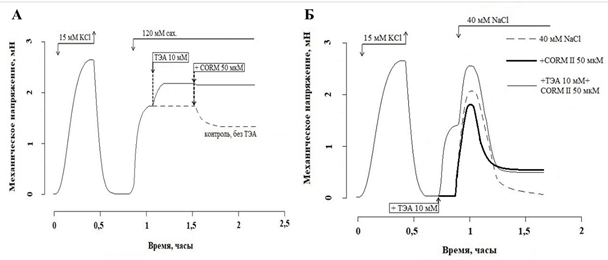
Рис. 2. Влияние ТЭА (10 мМ) и CORM II (50 мкМ) на амплитуду гиперосмотической (А) и гипоосмотической (Б) стрикции СГМС. Добавление и удаление тестирующих соединений показано стрелками
Исследование влияния СО и калиевой проводимости на гипоосмотическую стрикцию
Гипоосмотическую стрикцию получали помещением СГМК в гипоосмотический раствор, содержащий 40 мМ NaCl, при этом развивался транзиторный сократительный ответ амплитудой 80,7 (69,5; 91,6) % от контрольного гиперкалиевого сокращения. ТЭА достоверно увеличивал амплитуду гипоосмотической стрикции до 107,71 (103,95; 111,18) % от контрольного гиперкалиевого сокращения. Сокращение в присутствии ТЭА имело транзиторный характер, с выходом на поддерживаемый уровень амплитудой 8,53 (6,47; 11,86) % от контрольного гиперкалиевого сокращения (p<0,05, n=8) (рис. 2Б).
Добавление CORM II (50 мкМ) не оказывало статистически значимого влияния на величину гипоосмотической стрикции (МН составило 68,8 (66,4; 84,7) % от контрольного сокращения), однако сегмент не расслаблялся полностью: МН после расслабления составила 16,1 (11,43; 23,3) % от контрольного гиперкалиевого сокращения (рис. 2Б). ТЭА не влиял на эффекты CORM II в СГМС в условиях гипоосмотической стрикции.
Исследование влияния СО и калиевой проводимости на изоосмотическую стрикцию
Помещение СГМС в нормальный раствор Кребса (120 мМ NaCl) после 60-минутной инкубации в гипоосмотическом растворе приводило к развитию транзиторной изоосмотической стрикции амплитудой 56,9 (55,36; 58,45) % от контрольного гиперкалиевого сокращения и длительностью 42,5 (35,8; 55,0) минуты. Предобработка сосудистых сегментов ТЭА (10 мМ, 30 мин.) увеличивала амплитуду изоосмотической стрикции до 99,44 (92,30; 103,14) % от контрольного гиперкалиевого сокращения (p<0,05, n=8) (рис. 3А). CORM II (50 мкМ) достоверно (p<0,05, n=8) снижал амплитуду изоосмотической стрикции до 10,57 (8,3; 11,29) % от контрольного гиперкалиевого сокращения. ТЭА (10 мМ) уменьшал релаксирующее действие CORM II (50 мкМ): МН составило 25,93 (23,16; 27,13) % от контрольного гиперкалиевого сокращения (p<0,05, n=8) (рис. 3Б).
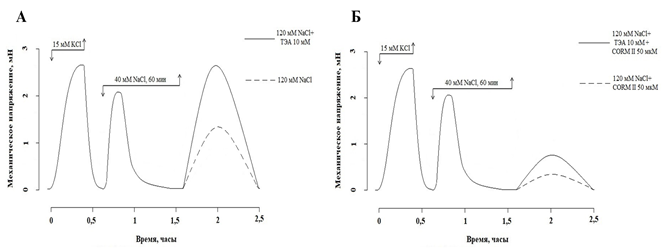
Рис. 3. Влияние 10 мМ ТЭА (А) и 50 мкМ CORM II (Б) на изоосмотическую стрикцию СГМС. Добавление и удаление тестирующих соединений показано стрелками
Заключение
Калиевые каналы возбудимых клеток участвуют в формировании потенциала покоя клетки, реполяризации мембраны во время потенциала действия, задействованы в регуляции клеточного объема и внутриклеточной сигнализации. Изменение сократительной активности сосудистых ГМК может быть опосредовано транспортом K+ через различные типы калиевых каналов [10]. Действие СО в сосудах связано со снижением их тонуса вследствие расслабления ГМК [6]. Согласно полученным ранее данным, расслабление СГМК при действии СО опосредовано активацией гуанилатциклазы и ковалентной модификацией Ca2+-чувствительных K+-каналов большой проводимости (ВKCa2+ каналы) [11]. Предполагается, что α-субъединица ВKCa2+ канала содержит участок, связанный с гемом. Взаимодействие СО с атомом железа гема нарушает связь гема с каналом, устраняя его ингибирующее действие и повышая чувствительность канала к Са2+. Таким образом, локальные транзиторные вспышки Са2+ и активация ВKCa2+ могут являться ключевым звеном в релаксирующем действии СО. Как ингибирование внутриклеточных вспышек Са2+, так и блокирование ВKCa2+ подавляют релаксирующее действие СО на ГМК [11]. Напротив, активация ВKCa2+ инактивирует потенциал-чувствительные Са2+-каналы, снижает входящие кальциевые токи и приводит к гиперполяризации мембран сосудистых ГМК [11]. Ранее нами было показано, что сосудорасслабляющее действие СO обусловлено активацией потенциал-зависимых калиевых каналов (Кv-каналов) [8]. Согласно данным, представленным в статье, СО не влиял на величину сокращения сегментов легочной артерии в гипоосмотической среде, однако достоверно снижал в условиях гиперосмотической и изоосмотической стрикции. Известно, что данные сократительные ответы связаны с активацией Na+, K+, 2Cl- -котранспорта: поддерживаемой в случае гиперосмотической стрикции и транзиторной – в случае изоосмотической [2; 3; 12].
Блокирование калиевых каналов приводило к увеличению амплитуды сократительных ответов во всех исследуемых условиях. При этом ТЭА (10 мМ) уменьшал релаксирующее действие СО при гиперосмотической и изоосмотической стрикции, но не влиял на его эффекты при гипоосмотической стрикции. Учитывая предыдущие работы, можно предположить, что СО приводит к активация Kv-каналов или харибдотоксин-чувствительных Са2+-активируемых K+-каналов [6-8] и, как следствие, реполяризации мембраны клетки. Подавление СО-индуцированного расслабления блокатором калиевых каналов подтверждает это предположение.
С другой стороны, снижение ТЭА-индуцированной деполяризации клеток при гипер- и изоосмотической стрикции может быть связано с активацией растворимой гуанилатциклазы и увеличением внутриклеточной концентрации цГМФ, активацией протеинкиназы G, которая снижает проницаемость для ионов Ca2+, модулирует активность Na+-K+-АТФазы и смещает мембранный потенциал в сторону гиперполяризации.
Нарушение регуляции объема клеток может стать причиной развития патологии сосудов малого круга кровообращения. Так, набухание ГМК сопровождает стойкое повышение давления в легочной артерии [4]. Полученные данные демонстрируют возможные механизмы поддержания тонуса сосудов при изменении осмолярности межклеточной среды и могут быть использованы для разработки способов лечения и коррекции артериальной и легочной гипертензии.
Исследование выполнено при финансовой поддержке РФФИ и Администрации Томской области в рамках научного проекта № 18-44-700009.
Библиографическая ссылка
Гусакова С.В., Гусакова В.С., Голованов Е.А., Смаглий Л.В., Зайцева Т.Н., Тотумачева Э.В., Киреева А.В., Зубова А.В. РОЛЬ КАЛИЕВЫХ КАНАЛОВ И МОНООКСИДА УГЛЕРОДА В РЕГУЛЯЦИИ СОКРАЩЕНИЙ ГЛАДКИХ МЫШЦ ЛЕГОЧНОЙ АРТЕРИИ КРЫСЫ ПРИ ИЗМЕНЕНИИ ОБЪЕМА КЛЕТОК // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31524 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31524



