Ушиб сердца существенно утяжеляет течение сочетанной травмы, летальность достигает 10% [1], нерешенными остаются вопросы его патогенетической терапии. Одна из причин – недостаточное понимание патогенеза тупой травмы сердца, наименее изученными аспектами которого, являются адаптивные реакции, формирующиеся в посттравматическом периоде [2]. В литературе нет данных об особенностях гематологических проявлений, сопровождающих стресс-реакцию в зависимости от исходного уровня стрессоустойчивости и стратегий адаптации, формирующихся в посттравматическом периоде ушиба сердца. Ранее в наших исследованиях было показано, что резистентная стратегия адаптации к ушибу сердца у животных с разным уровнем стрессоустойчивости характеризуется разной степенью напряжения адаптивных систем. В частности, у низкоустойчивых к стрессу животных в посттравматическом периоде наблюдается заметное напряжение стресс-реализующих систем, выраженный окислительный стресс, сопровождающийся нарушением редокс-гомеостаза кардиомиоцитов по сравнению с высокоустойчивыми особями [3]. Это может предопределять раннюю декомпенсацию кровообращения и менее благоприятное течение посттравматического периода ушиба сердца у животных с низкой стрессоустойчивостью. С одной стороны, изменение гормонального фона, отражающее баланс стресс-реализующих и стресс-лимитирующих реакций организма, может отразиться на показателях системы крови, которые в дальнейшем могут быть использованы как маркер для оценки характера протекания адаптивных процессов после травмы. С другой стороны, представляет интерес сравнение динамики реакции со стороны системы крови после травмы у животных с различной исходной стрессоустойчивостью и, соответственно, разными стратегиями адаптации. Своевременное применение патогенетически обоснованных подходов, направленных на поддержание механизмов саногенеза, может изменить течение посттравматического периода в благоприятную сторону. Это отвечает современной тенденции к персонификации медицинской помощи. Полученные в эксперименте данные могут в дальнейшем учитываться при разработке и выборе патогенетически обоснованных подходов в терапии пациентов с тупой травмой сердца с учетом особенностей адаптивных реакций.
Цель исследования – оценка изменений в системе крови у крыс с разным уровнем исходной стрессоустойчивости и разными стратегиями адаптации в посттравматическом периоде экспериментального ушиба сердца.
Материалы и методы исследования
Эксперименты выполнены на 130 белых нелинейных крысах-самцах массой 250-300 г, в соответствии с правилами проведения работ и содержания животных Приказа Минздрава России от 01.04.2016 №199н «Об утверждении правил надлежащей лабораторной практики». В качестве средства для наркоза на всех инвазивных этапах эксперимента использовали препарат Золетил 100 в дозе 30 мг/кг внутрибрюшинно [4]. Исследование одобрено локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России.
Для формирования экспериментальных групп всем животным была проведена оценка стрессоустойчивости при помощи теста принудительного плавания Порсолта [5]. К хвосту крепили груз массой 10% от веса животного. Тест проводился в прозрачной ёмкости квадратного сечения (30х30х80 см). Температура воды составляла 30±1°С. Время плавания фиксировали секундомером с точностью до 1 с. По времени плавания животные были разделены на 3 группы: низкоустойчивые (время плавания до 25 процентиля), высокоустойчивые (время плавания выше 75 процентиля) и среднеустойчивые (между 25 и 75 процентилями). Далее из числа крыс каждой группы случайным образом отобрали по 8 животных в опытную и контрольную группы. В результате были сформированы следующие группы: контрольная низкоустойчивые (КН), опытная низкоустойчивые (ОН), контрольная среднеустойчивые (КС), опытная среднеустойчивые (ОС), контрольная высокоустойчивые (КВ), опытная высокоустойчивые (ОВ).
Через 10 дней после плавания на втором этапе исследования у наркотизированных крыс опытных групп (ОН, ОС и ОВ) воспроизводили ушиб сердца при помощи оригинального устройства [6]. Механизм с зафиксированной в вертикальном положении крысой приводился в движение грузом, падающим с высоты. На пути движения устройства находилось препятствие с выступом на уровне проекции сердца. Столкновение грудной клетки животного с выступом вызывает компрессию сердца с формированием ушиба. Животные контрольных групп получали только наркоз. Через 24 часа осуществляли забор образцов крови для подсчёта общего количества лейкоцитов, лейкоцитарной формулы и определения уровня кортикостерона в плазме.
Общее количество лейкоцитов и соотношение трех субпопуляций клеток определяли на гематологическом анализаторе Mindray BC-3000Plus (Китай). Лейкоцитарную формулу подсчитывали в препаратах крови окрашенных по Романовскому–Гимзе. По данным лейкоцитарной формулы были рассчитаны следующие индексы: индекс сдвига лейкоцитов крови по И.И. Яблучанскому (ИСЛК) (эозинофилы (Э) + базофилы (Б) + нейтрофилы (Н)) / (моноциты (М) + лимфоциты (Л)) [7], индекс напряженности адаптации по Л. Х. Гаркави (отношение числа лимфоцитов к числу сегментоядерных нейтрофилов), индекс иммунореактивности по Д.О. Иванову (эозинофилы (Э) + лимфоциты(Л) / моноциты (М)), индекс ядерного сдвига (отношение молодых форм нейтрофилов к зрелым) [8]. Уровень кортикостерона в плазме крови определяли методом иммуноферментного анализа с использованием тест-систем ELISA Kit фирмы Cloud-Clone Сorp. (Китай).
Статистическая обработка данных проводилась методами описательной статистики и сравнения выборок (U-критерий Манна–Уитни). Уровень статистической значимости принят равным 0,05. Обработка данных проводилась с использованием программы IBM SPSSStatistics23. Результаты представлены в виде медианы и межквартильного диапазона.
Результаты исследования и их обсуждение
В группах ОН и ОС отмечены высокие уровни общего количества лейкоцитов (рис. 1), что согласуется с данными литературы о развитии нейтрофильного лейкоцитоза в ранние сроки после асептических повреждений [8, 9]. При этом в группе ОВ значительного прироста количества лейкоцитов не наблюдалось, что может свидетельствовать о менее выраженном стимулировании лейкопоэза и более благоприятном течении посттравматического периода ушиба сердца. Примечательно, что через 1 сутки после ушиба сердца количество лейкоцитов у животных в группе ОВ было статистически значимо ниже в сравнении с группой ОН (p<0,05), а группа ОС не продемонстрировала статистически значимого увеличения уровня лейкоцитоза в сравнении с ОВ вследствие значительного разброса показателей.
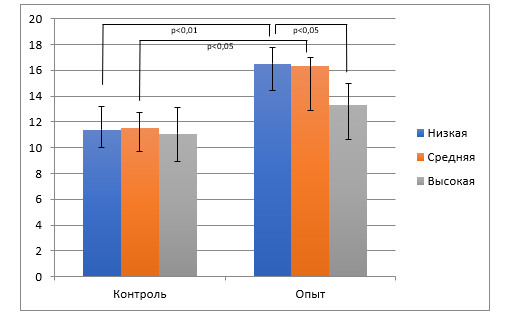
Рис. 1. Общее количество лейкоцитов периферической крови (х109 л-1) крыс с низкой, средней и высокой устойчивостью к стрессу через 24 часа после ушиба сердца
При анализе лейкоцитарной формулы в контрольных группах (КН, КС, КВ) статистически значимых различий не отмечено (табл. 1). Через 1 сутки после ушиба сердца процентное соотношение различных клеток в лейкоцитарной формуле в опытных группах статистически значимо отличалось от значений в контрольных группах (p<0,01). В опытных группах вне зависимости от уровня стрессоустойчивости наблюдался нейтрофильный лейкоцитоз с гипорегенеративным ядерным сдвигом влево, относительные лимфоцитопения и эозинопения. Моноцитопения наблюдалась только в группах ОН и ОС и была относительной. При анализе изменений в лейкоцитарной формуле было отмечено, что они различаются в группах ОН, ОС и ОВ. Самые высокие значения процентного содержания сегментоядерных и палочкоядерных нейтрофилов отмечались в группе ОН и были статистически значимо ниже в группе ОВ (p<0,05 и p<0,01 соответственно). В группе ОС доля сегментоядерных и палочкоядерных нейтрофилов была несколько ниже в сравнении с группой ОН, однако статистически значимых отличий в этих группах не отмечено. В тоже время статистически значимые различия в содержании палочкоядерных и сегментоядерных нейтрофилов отмечены между группами ОС и ОВ (p<0,05). Эти результаты подтверждают пригодность применения теста принудительного плавания Порсолта для ранжирования крыс по стрессоустойчивости, а также демонстрируют различия между реакцией на асептическое повреждение у животных с различной исходной стрессоустойчивостью, особенно между группами с полярно противоположными вариантами стрессоустойчивости – ОН и ОВ.
Таблица 1
Содержание лейкоцитов (%) в крови крыс с низкой, средней и высокой устойчивостью к стрессу через 24 часа после моделирования ушиба сердца [Me (LQ; HQ)]
|
Лейкоциты Группы |
Эозинофилы |
Палочко-ядерные нейтрофилы |
Сегменто-ядерные нейтрофилы |
Лимфоциты |
Моноциты |
|
КН |
2,5 (1,8 3,3) |
2,0 (1,0 2,0) |
21,0 (17,8 25,0) |
69,5 (65,8 74,0) |
4,5 (2,8 5,5) |
|
КС |
2,5 (2,0 4,0) |
2,5 (1,8 3,3) |
22,5 (18,5 25,5) |
69,5 (63,8 71,5) |
4,0 (3,0 5,0) |
|
КВ |
2,0 (2,0 3,3) |
2,0 (1,8 2,3) |
22,5 (19,5 23,8) |
69,5 (67,5 71,3) |
3,5 (2,0 6,0) |
|
ОН |
0,5 (0,0 1,0) к** |
11,5 (5,8 13,0) к*** |
39,0 (31,3 42,0) к*** |
49,5 (39,5 58,5) к*** |
2,0 (1,0 2,0) к** |
|
ОС |
1,0 (0,8 1,0) к** |
8,0 (5,8 10,3) к** |
36,0 (30,0 40,3) к** |
51,5 (47,5 59,3) к** |
2,0 (1,8 3,0) к** |
|
ОВ |
1,0 (1,0 1,3) к** н** с* |
4,5 (3,8 6,3) к** н** с* |
26,5 (25,0 32,5) к** н* с* |
64,0 (59,0 65,3) к** н** с* |
3,0 (1,8 5,0) н* |
|
Примечание. к**; к*** – наличие статистически значимых различий по отношению к контрольной группе (p<0,01 и 0,001 соответственно); н*; н** – наличие статистически значимых различий по отношению к группе с низким уровнем устойчивости к стрессу (p<0,05 и 0,01 соответственно); с* – наличие статистически значимых различий по отношению к группе со средним уровнем устойчивости к стрессу (p<0,05). |
|||||
На основании полученных данных нами были рассчитаны 4 лейкоцитарных индекса (табл.2). Индекс напряженности адаптации по Л.Х.Гаркави был статистически значимо ниже по отношению к контрольным значениям независимо от уровня стрессоустойчивости. Однако в опытной группе с низким уровнем стрессоустойчивости снижение индекса Гаркави было максимальным, а в опытной группе с высоким уровнем стрессоустойчивости – минимальным, статистически значимо отличаясь от значений в группах с низким и средним уровнем стрессоустойчивости (p<0,01 и 0,05 соответственно). Индекс напряженности адаптации в группах ОН и ОС показал значения ниже 1,6 за счёт процентного увеличения содержания нейтрофилов в лейкоцитарной формуле, что свойственно для выраженной стрессовой реакции.
Таблица 2
Значения лейкоцитарных индексов у крыс с низкой, средней и высокой устойчивостью к стрессу через 24 часа после моделирования ушиба сердца [Me (LQ; HQ)]
|
Индексы
Группы |
индекс напряженности адаптации |
индекс ядерного сдвига |
индекс иммунореактивности |
индекс сдвига лейкоцитов крови |
|
КН |
3,33 (2,68; 4,18) |
0,07 (0,06; 0,10) |
17,33 (13,90; 27,25) |
0,34 (0,29; 0,45) |
|
КС |
3,05 (2,56; 3,97) |
0,13 (0,06; 0,16) |
17,75 (15,00; 22,33) |
0,36 (0,33; 0,48) |
|
КВ |
3,14 (2,77; 3,66) |
0,08 (0,07; 0,11) |
21,33 (12,70; 35,38) |
0,36 (0,33; 0,40) |
|
ОН |
1,27 (0,94; 1,92) к*** |
0,27 (0,18; 0,37) к** |
28,00 (19,50; 43,25) к* |
0,92 (0,67; 1,43) к** |
|
ОС |
1,41 (1,22; 1,99) к*** |
0,21 (0,18; 0,26) к* |
24,80 (22,83; 30,63)
|
0,89 (0,63; 1,00) к** |
|
ОВ |
2,55 (1,83; 2,61) к*** н** с* |
0,18 (0,12; 0,20) к* н* |
21,95 (13,09; 39,63)
|
0,47 (0,42; 0,65) к** н** с* |
|
Примечание. к*; к**; к*** – наличие статистически значимых различий по отношению к контрольной группе (p<0,05; 0,01 и 0,001 соответственно); н*; н** – наличие статистически значимых различий по отношению к группе с низким уровнем устойчивости к стрессу (p<0,05 и 0,01 соответственно); с* – наличие статистически значимых различий по отношению к группе со средним уровнем устойчивости к стрессу (p<0,05). |
||||
Индекс ядерного сдвига в опытных группах статистически значимо повышался, следовательно, нейтрофильный лейкоцитоз, развивающийся в посттравматическом периоде ушиба сердца, по патогенезу является продукционным. Поскольку максимальные значения индекса ядерного сдвига наблюдались в группе с низким уровнем стрессоустойчивости, можно предполагать, что в группе ОН стимуляция миелоидного ростка цитокинами в костном мозге была максимальной. Индекс иммунореактивности по Д.О. Иванову, косвенно отражающий баланс лимфокинов и монокинов [10], продемонстрировал значительный разброс значений в исследуемых группах. Его статистически значимое увеличение зарегистрировано только в группе ОН. Индекс сдвига лейкоцитов крови по И.И. Яблучанскому статистически значимо возрастал во всех опытных группах. В группе с низким уровнем устойчивости к стрессу он увеличился практически в три раза в сравнении с контролем и был статистически значимо выше значений, рассчитанных в группе животных с высоким уровнем стрессоустойчивости (p<0,01).
Таким образом, в группе ОН наблюдались максимально выраженные изменения не только в общем количестве лейкоцитов и лейкоцитарной формуле, но и в значениях лейкоцитарных индексов. Описанные изменения в лейкоцитарной формуле в группе ОН могут быть связаны с последствиями значительного стресса, который подтверждался максимальным уровнем сывороточного кортикостерона (рис. 2) и был статистически значимо выше в сравнении с уровнем, зарегистрированным в группах ОВ и ОС.
Вследствие тупой травмы в сердце происходят разрывы мышечных волокон, наблюдается некроз и фрагментация клеток, очаговые кровоизлияния. Это влечёт за собой возникновение боли, а чуть позже циркуляторной гипоксии в результате нарушений ритма и сократимости сердца. Эти патогенетические факторы вызывают активацию тесно связанных между собой гипоталамо-гипофизарно-надпочечниковой и симпато-адреналовой систем, активация одной из которых подтверждена в нашем эксперименте повышением содержания кортикостерона в плазме крови у животных после травмы. Повышение содержания кортикостерона при стрессе сопровождается увеличением уровня катехоламинов под влиянием симпатической стимуляции надпочечников. По данным литературы, катехоламины могут вызвать повреждение сердца на клеточном уровне, вызывая перегрузку кардиомиоцитов ионами кальция, усиливая оксидативный стресс и повреждение митохондрий [11]. С другой стороны, высокие концентрации кортикостерона также могут усугублять повреждение миокарда. Известно, что глюкокортикоиды в высоких концентрациях способны связываться с минералокортикоидными рецепторами. На модели изолированного сердца показано, что высокие уровни глюкокортикоидов увеличивают зону инфаркта и активируют апоптоз кардиомиоцитов [12].
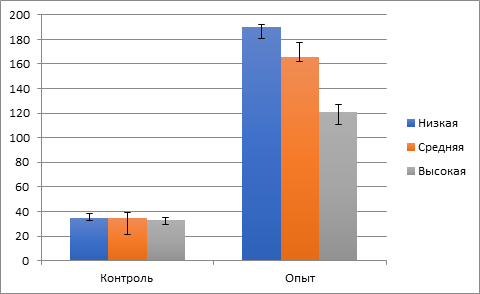
Рис. 2. Уровень кортикостерона (нг/мл) у животных контрольной и опытной групп с низкой, средней и высокой стрессоустойчивостью (Me(LQ;HQ))
Поскольку в нашем эксперименте в группе ОН был выявлен статистически значимый максимальный уровень кортикостерона в сравнении с группой ОВ (рис. 2), то можно предположить, что в группе ОН концентрация катехоламинов также была высокой. Это способствовало значительному повреждению миокарда в посттравматическом периоде и высвобождению большого количества молекул, ассоциированных с поврежденными тканями (Damage Associated Molecule Pattern – DAMP), например, ДНК, РНК, гистоновые белки, аденозин, фрагменты гиалуроновой кислоты, коллагена. DAMP, являясь главной причиной асептического воспаления, подвергаются фагоцитозу и инициируют высвобождение интерлейкина-1 (IL-1), фактора некроза опухолей-альфа (ФНОα) [13], что приводит к высвобождению других провоспалительных цитокинов, включая интерлейкин 6 (IL-6), интерлейкин 8 (IL-8) и интерферон-гамма. IL-6 индуцирует высвобождение острофазных белков, включая прокальцитонин и С-реактивный белок. IL-8, в свою очередь, является мощным хемокином, способствуя хемотаксису нейтрофилов в зону повреждения и их активации, сопровождающейся выделением активных форм кислорода [14]. Все вышеперечисленные патогенетические факторы могут замкнуть порочный круг "повреждение – стресс – гиперкатехоламинемия – повышение содержания активных форм кислорода в миокарде – DAMP – высвобождение цитокинов – хемотаксис и активация нейтрофилов – секреция нейтрофилами активных форм кислорода – повреждение". Низкая стрессоустойчивость животных может способствовать гиперкатехоламинемии, что, в свою очередь, может усилить процессы перекисного окисления липидов в миокарде способствуя увеличению масштабов повреждения. В свою очередь, DAMP-зависимая гиперпродукция IL-1 и ФНОα стимулирует пролиферацию и дифференцировку миелоидного ростка в костном мозге [15]. Подтверждением такой стимуляции может быть изменения в индексе ядерного сдвига у животных с разным уровнем стрессоустойчивости (табл. 2). В частности, в группе ОН индекс ядерного сдвига был статистически значимо выше не только по отношению к контрольной группе (p<0,01), но и в сравнении с группой ОВ (p<0,05), что косвенно может подтверждать максимальную стимуляцию миелоидного ростка цитокинами у животных с низким уровнем стрессоустойчивости вследствие значительной выраженности оксидативного стресса и более сильного нарушения редокс-гомеостаза кардиомиоцитов [3].
Заключение
Таким образом, отличия в степени выраженности нейтрофильного лейкоцитоза и лейкоцитарных индексов в крови у животных с неодинаковой стрессоустойчивостью могут объясняться, с одной стороны, разной степенью активации стресс-реализующих систем, с другой – разным масштабом вторичного повреждения в миокарде в посттравматическом периоде. Сравнительно низкий уровень нейтрофильного лейкоцитоза и индекса ядерного сдвига, индекс напряженности адаптации выше значения 1,6 в группе высокоустойчивых к стрессу животных является признаком низкоинтенсивного воспаления в ткани миокарда вследствие слабой активации гипоталамо-гипофизарно-надпочечниковой системы. В группе с низким уровнем стрессоустойчивости наблюдалась диаметрально противоположная ситуация – максимальный уровень нейтрофильного лейкоцитоза, максимальный индекс ядерного сдвига нейтрофилов и минимальные значения индекса напряженности адаптации по Л.Х.Гаркави, что может свидетельствовать о значительной активации стресс-реализующих систем и о воспалении высокой интенсивности в поврежденном миокарде.
Библиографическая ссылка
Приймак А.Б., Корпачева О.В., Таран Н.И., Золотов А.Н. РЕАКЦИЯ СИСТЕМЫ КРОВИ В ОСТРОМ ПОСТТРАВМАТИЧЕСКОМ ПЕРИОДЕ УШИБА СЕРДЦА У КРЫС С РАЗЛИЧНОЙ СТРЕССОУСТОЙЧИВОСТЬЮ // Современные проблемы науки и образования. 2022. № 1. ;URL: https://science-education.ru/ru/article/view?id=31519 (дата обращения: 21.02.2026).
DOI: https://doi.org/10.17513/spno.31519



