В исследованиях последних лет установлен коморбидный характер фибрилляции предсердий [1, 2]. Протекая манифестированно или скрытно, часто бессимптомно, она вызывает выраженные гемодинамические нарушения, что приводит к значительному снижению жизненного тонуса больных, потере работоспособности и инвалидизации [3, 4]. В последние годы многие исследователи указывают на необходимость изучения гемодинамических, электрофизиологических и тиреоидных механизмов возникновения фибрилляции предсердий, позволяющих определить тактику и стратегию проводимого лечения [5, 6]. Особое внимание клиницистов привлекают иммуноферментное определение тиреоидных гормонов и неинвазивное электрофизиологическое исследование сердца [7, 8]. Полученные данные используют для подбора адекватной терапии, которая базируется на результатах оценки эффективности медикаментозных средств.
Целью исследования явилось сопоставление основных показателей проводящей системы сердца и гемодинамики с функциональным состоянием щитовидной железы у больных с пароксизмальным вариантом фибрилляции предсердий при субклинических нарушениях щитовидной железы.
Материалы и методы исследования
Нами обследован 51 больной с пароксизмами фибрилляции предсердий (ПФП). Мужчин было 24, женщин – 27, возраст 49–71 года, средний возраст – 63,2±5,7 года. У 15 больных с эутиреозом (1-я группа) нарушение ритма возникало при значении ТТГ от 0,4 до 4 мМЕ/л. У 17 пациентов с субклиническом гипотиреозом (2-я группа) аритмия возникала при уровне ТТГ от 4,1 до 12 мМЕ/л. У 19 больных с субклиническим гипертиреозом (3-я группа) аритмия возникала при уровне ТТГ от 0,01 мМЕ/л до 0,39 мМЕ/л. Контрольную группу составили 20 человек в возрасте 60,5±4,8 года без нарушений сердечного ритма и предрасполагающих факторов их возникновения.
В исследование не включали больных с активным воспалительным процессом, поражениями клапанов и выраженной недостаточностью кровообращения. До включения в исследование все больные принимали антиаритмические препараты (пропафенон, соталол, бисопролол) в среднетерапевтических дозировках без видимого антиаритмического эффекта.
Всем больным проводили полное клинико-лабораторное обследование: собирали спецанамнез для больных с аритмиями сердца, выполняли эхокардиографию, рентгенологическое исследование органов грудной клетки, пробу с физической нагрузкой по стандартной методике во время чреспищеводной стимуляции сердца. Для идентификации выявленных аритмий у больных применяли суточный ЭКГ-мониторинг. Для оценки объема и архитектоники (структура, узлы) щитовидной железы выполняли ультразвуковое исследование.
Чреспищеводную электрокардиостимуляцию (ЧпЭКС) выполняли после полной отмены кардиотропных препаратов (не менее чем за 48 ч). Стимуляцию осуществляли с помощью электрофизиологического комплекса «Astrocard» (АО «Медитек»). Определяли следующие показатели: продолжительность исходного спонтанного сердечного цикла (R-R), время восстановления функции синусового узла (ВВФСУ), корригированное ВВФСУ (КВВФСУ). Антероградную атриовентрикулярную (АВ) проводимость оценивали, ступенчато учащая предсердный ритм до возникновения периодики Венкебаха–Самойлова (точка Венкебаха). Тест предсердной стимуляции считали положительным при горизонтальной или косонисходящей депрессии сегмента ST глубиной 2 мм и более. При сочетании ПФП с реципрокными тахикардиями определяли ее форму и зону, длину цикла, время антероградного (A-V) и ретроградного (V-A) проведения эхоимпульса.
Показатели гемодинамики оценивали методом ЭхоКГ на приборе Sonio Logiq V2 (ООО ИМК «Инсайт», РФ) на фоне синусового ритма [1, 3]. Были исследованы показатели систолической и диастолической функции левого желудочка.
Для купирования спонтанных пароксизмов ФП применялись парентеральное введение прокаинамида, электрическая кардиоверсия или медикаментозная терапия пропафеноном. Также проводилась антикоагулянтная терапия варфарином с 1 и более баллов по шкале ишемического инсульта и тромбоэмболических осложнений у пациентов с неревматической ФП.
Проводимая терапия включала в себе два направления. Вначале больным проводилась заместительная (2-я группа) и тиреостатическая (3-я группа) терапия до достижения эутиреоидного статуса. В дальнейшем всем больным, включенным в исследование, последовательно проводилась терапия бисопрололом, соталолом, пропафеноном с оценкой антиаритмической эффективности.
Критериями эффективности антиаритмической терапии являлись: снижение количества пароксизмов на 75% и более, полное исчезновение пароксизмов, а также невозможность индуцирования пароксизма, индуцирование неустойчивого пароксизма длительностью до 30 сек во время ЧПЭФИ [4, 7].
Полученные результаты обрабатывали при помощи пакета статистических программ Statistica 13.3. Для выбора статистического анализа определяли вариант распределения изучаемых параметров (симметричное/нормальное и асимметричное) с помощью теста Колмогорова–Смирнова / Шапирова. Для описания количественных переменных при нормальном распределении использовали среднее выборочное значение ± стандартное отклонение (M±SD). Для сравнения полученных результатов был применен t-критерий Стьюдента. Применяли стратификацию значений «р» <0,5, 0,1, 0,001. Различия считались достоверными при р<0,05.
При распределении переменных, отличающихся от нормального значения, для сравнительной оценки использовали непараметрические методы: U-критерий (Манна–Уитни).
Результаты исследования и их обсуждение
Исследование проводилась в два этапа. Первый этап включал сравнительную оценку тиреоидного статуса, гемодинамических и электрофизиологичеких показателей в группах больных с ПФП. Второй этап включал в себя заместительную (2-я группа) и тиреостатическую (3-я группа) терапию, а затем подбор антиаритмической терапии.
Сравнительная оценка тиреоидных, электрофизиологических и гемодинамических показателей в группах больных представлена в таблице.
Тиреоидные, гемодинамические и ЭФИ показатели в группах больных (M±SD)
|
Показатели |
Группа контроля (n=20) |
Группа №1 (n=15) |
Группа №2 (n=17) |
Группа №3 (n=19) |
p |
|||||
|
|
1 |
2 |
3 |
4 |
1–2 |
1–3 |
1–4 |
2–3 |
2–4 |
3–4 |
|
T3, нмoль/л |
1,34±0,04 |
1,28±0,06 |
0,92±0,15 |
1,9±0,21 |
>0,05 |
<0,05 |
<0,001 |
<0,05 |
<0,05 |
<0,001 |
|
T4, нмoль/л |
87,2±1,42 |
82,9±2,24 |
48,7±8,2 |
92,7±10,4 |
>0,05 |
<0,001 |
>0,05 |
<0,001 |
>0,05 |
<0,01 |
|
TTГ, мME/л |
1,66 ±0,12 |
1,52±0,24 |
8,6±0,64 |
0,08±0,03 |
>0,05 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
|
R-R , мc |
728,2±36,7 |
832,8±24,3 |
926,4±38,4 |
638,6±22,6 |
<0,05 |
<0,01 |
<0,05 |
<0,05 |
<0,001 |
<0,001 |
|
BBФCУ, мc |
1126,8±30,4 |
1252,4±42,1 |
1394,8±38,6 |
1025,3±34,1 |
<0,05 |
<0,001 |
<0,05 |
<0,05 |
<0,001 |
<0,001 |
|
KBBФCУ, мc |
297,3±20,6 |
424,2±16,1 |
474,6±15,6 |
244,1±12,4 |
<0,001 |
<0,001 |
<0,05 |
<0,05 |
<0,001 |
<0,001 |
|
ЭРПАВ узла, мc |
336,8±6,8 |
342,7±9,6 |
362,2±8,4 |
311,9±7,2 |
>0,05 |
<0,05 |
<0,05 |
>0,05 |
<0,05 |
<0,001 |
|
ЭPПЛП, мc |
242,6±3,6 |
224,9±3,1 |
213,7±2,6 |
215,2±2,3 |
<0,01 |
<0,001 |
<0,001 |
<0,05 |
<0,05 |
>0,05 |
|
т. Венкебаха, имп/мин |
172,4±3,7 |
173,6±5,8 |
156,4±5,2 |
186,4±3,1 |
>0,05 |
<0,05 |
<0,05 |
<0,05 |
<0,05 |
<0,001 |
|
ЛП, мм |
28,3±0,7 |
38,6±1,8 |
44,8±1,2 |
43,5±1,4 |
<0,001 |
<0,001 |
<0,001 |
<0,05 |
<0,05 |
>0,05 |
|
иKCO, мл/м2 |
22,7±1,2 |
28,1±1,5 |
32,6±1,8 |
31,8±1,4 |
<0,05 |
<0,001 |
<0,001 |
>0,05 |
>0,05 |
>0,05 |
|
иKДO, мл/ м2 |
60,3±1,6 |
71,8±3,0 |
75,2±2,4 |
72,1±2,6 |
<0,01 |
<0,001 |
<0,01 |
>0,05 |
>0,05 |
>0,05 |
|
ФB, % |
66,8±1,6 |
52,4±1,8 |
47,3±1,4 |
50,2±2,0 |
<0,001 |
<0,001 |
<0,001 |
<0,05 |
>0,05 |
>0,05 |
|
УИ, мл/м2 |
43,7±1,3 |
33,4±1,1 |
30,1±1,2 |
31,6±1,4 |
<0,001 |
<0,001 |
<0,001 |
<0,05 |
>0,05 |
>0,05 |
|
A, cм/c |
61,4±3,3 |
73,4±3,1 |
76,1±2,3 |
72,6±3,4 |
<0,05 |
<0,01 |
<0,05 |
>0,05 |
>0,05 |
>0,05 |
|
E, cм/c |
68,2±3,0 |
54,1±2,6 |
47,6±1,5 |
54,7±2,8 |
<0,01 |
<0,001 |
<0,01 |
<0,05 |
>0,05 |
<0,05 |
|
E/A |
1,27±0,07 |
0,82±0,05 |
0,59±0,06 |
0,74±0,04 |
<0,001 |
<0,001 |
<0,001 |
<0,01 |
>0,05 |
<0,05 |
Примечание: p1-2 – значимость различий между показателями контрольной группы и пациентов с эутиреозом, p1-3 – значимость различий между показателями контрольной группы и пациентов с гипотиреозом, p1-4 – значимость различий между показателями контрольной группы и пациентов с тиреотоксикозом, p2-3 – значимость различий между показателями группы эутиреоза и пациентами с гипотиреозом, p2-4 – значимость различий между показателями группы эутиреоза и пациентами с гипертиреозом, p3-4 – значимость различий между показателями группы гипотиреоза и пациентами с гипертиреозом.
Сопоставление значений ТТГ с тиреодными гормонами позволило установить состояние эутиреоза и диагноз субклинической дисфункции щитовидной железы. Кроме того, при физикальном обследовании щитовидной железы у 8 пациентов (42,1%) 2-й группы и 7 (41,2%) 3-й группы установлено увеличение 1-й степени, что подтвердилось проведенным УЗИ 3 (15,8%) больных 2-й группы и 2 (11,8%) – 3-й группы. Изменения архитектоники щитовидной железы были выявлены у 4 (21,1%) пациентов 2-й и у 3 (17,6%) – 3-й группы.
Анализ полученных данных показал тесную связь тиреоидных гормонов с электрофизиологическими и гемодинамическими показателями эутиреоза, субклинического тиреотоксикоза и субклинического гипотиреоза.
Анализ показателей проводящей системы сердца выявил, что у больных с субклиническим гипотиреозом (2-я группа) возникают условия для возникновения и закрепления ФП. Как видно из полученных данных, у больных данной группы по сравнению с контрольной ЧСС при синусовом ритме реже на 10,1% (р<0,05), корригированное значение ВВФСУ выше на 10,6% (р<0,05), а ЭРП левого предсердия короче на 5,0% (р<0,05).
Оценка диаметра ЛП в исследуемых группах пациентов выявила влияние на него основного заболевания. У пациентов 1-й группы по сравнению с контрольной выявлено увеличение диаметра ЛП на 26,7% (р<0,001), 2-й группы – на 36,8% (р<0,001), 3-й – на 35% (р<0,001). Результаты наших исследований свидетельствуют о тесной связи уровня тиреоидных гормонов с диаметром ЛП. Так, при сочетании субклинического гипотиреоза с ИБС диаметр больше на 13,8% (р<0,05), а с субклиническим тиреотоксикозом – на 11,3% (р<0,05).
Проведенный корреляционный анализ показал, что между диаметром ЛП и концентрацией ТТГ имеется зависимость. У пациентов 2-й группы она прямая (r=0,64, p<0,01), а 3-й группы – обратная (r= –0,48, p<0,05) (рис. 1, 2).
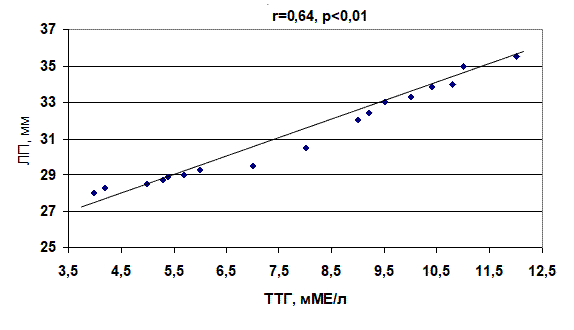
Рис. 1. Корреляционная зависимость между уровнем тиреотропного гормона и диаметром левого предсердия у больных с пароксизмами фибрилляции предсердий при субклиническом гипотиреозе
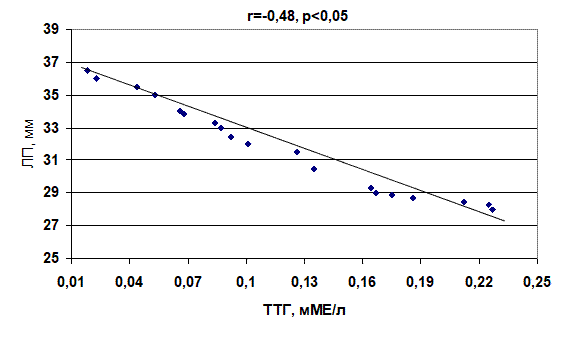
Рис. 2. Корреляционная зависимость между уровнем тиреотропного гормона и диаметром левого предсердия у больных с пароксизмами фибрилляции предсердий при субклиническом тиреотоксикозе
Анализ полученных данных показал, что имеется достоверное (p<0,05) уменьшение УИ и ФВ у больных с субклиническим гипотиреозом по сравнению с контрольной группой на 9,9% и 8,7%, соответственно. При анализе гемодинамических показателей и тиреоидной функции выявлена обратная корреляционная зависимость между уровнем ТТГ и УИ (r= –0,65, p<0,01), ТТГ и ФВ (r = –0,58, p<0,01) (рис. 3, 4).
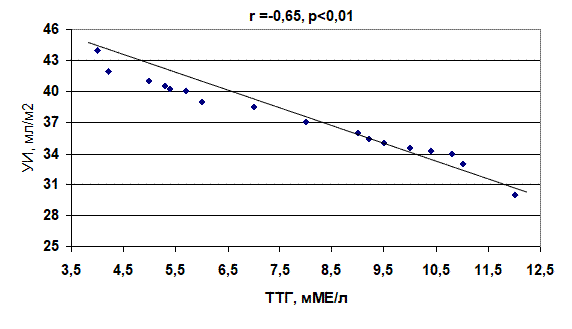
Рис. 3. Корреляционная зависимость между уровнем тиреотропного гормона и ударным индексом у больных с пароксизмами фибрилляции предсердий при субклиническом гипотиреозе
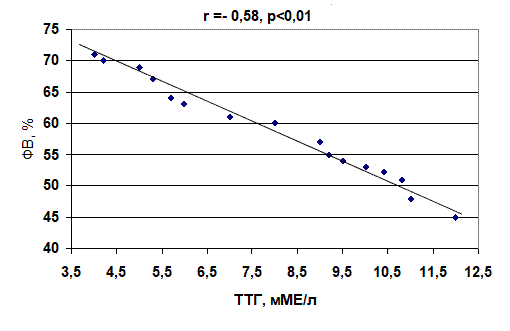
Рис. 4. Корреляционная зависимость между уровнем тиреотропного гормона и фракцией выброса у больных с пароксизмами фибрилляции предсердий при субклиническом гипотиреозе
В результате анализа диастолической функции ЛЖ установлено, что по сравнению с контрольной группой отношение максимальной ранней диастолической скорости на митральном клапане (E) к отношению максимальной поздней диастолической скорости на митральном клапане (A) у пациентов 1-й группы ниже на 35,4% (р<0,001), 2-й группы – на 53,5% (p<0,001), 3-й группы – на 41,7% (p<0,001). Также следует отметить зависимость диастолической дисфункции ЛЖ от уровня ТТГ. Интересно отметить, что отношение пика Е/А у пациентов 2-й группы было достоверно (р<0,05) ниже (0,59±0,06), чем 3-й группы (0,74±0,04). Проведенное корреляционное исследование показало четкую зависимость отношения пика Е/А от уровня ТТГ (r = –0,48, p<0,05). Суммируя полученные данные, можно заключить, что по сравнению с субклиническим тиреотоксикозом при субклиническом гипотиреозе чаще ухудшаются показатели систолической и диастолической функции ЛЖ.
С учетом рекомендаций по диагностике и лечению субклинического тиреотоксикоза и гипотиреоза всем больных проводилось этиопатогенетическое лечение. Пациентам с субклиническим гипотиреозом лечение L-тироксином проводилось в начальной дозе 12,5 (25) мкг под контролем тиреоидных гормонов. Время достижения эутиреоидного статуса при субклиническом гипотиреозе составило 45,6±2,8 дня. При субклиническом тиреотоксикозе проводилось лечение тиамазолом в стартовой дозе 20 мг в сутки под контролем уровня тиреоидных гормонов и общего анализа крови. Время достижения эутиреоидного статуса составило 37,6±4,8 дня.
После достижения эутиреоидного статуса во 2-й и 3-й группах больных проводилось серийное тестирование антиаритмических препаратов. Индивидуально подобранная доза соталола составила 80–160 мг в сутки (в среднем 120,3±5,6 мг), бисопролола – 2,5–7,5 мг (в среднем 4,6±0,25 мг), пропанорма – 450–600 мг (в среднем 520±7,4 мг). Также проводилась оценка эффективности комбинации соталола с пропанормом и бисопролола с пропанормом. В каждом случае средняя продолжительность антиаритмической терапии составила от 7 до 10 дней (в среднем 8,2±1,4 дня). Эффективность антиаритмической терапии оценивали по результатам ХМЭКГ и ЭФИ. Интересно отметить, что максимальная антиаритмическая эффективность была выявлена у больных 3-й группы по сравнению с больными 2-й группы. Также установлено, что побочные проявления антиаритмической терапии были выражены у больных 2-й группы.
Выводы
1. Проведенный корреляционный анализ показал, что между диаметром левого предсердия и концентрацией тиреотропного гормона у больных с субклиническим гипотиреозом существует прямая зависимость (r=0,64, p<0,01), а с субклиническим тиреотоксикозом – обратная (r= –0,48, p<0,05).
2. У больных с субклиническом гипотиреозом установлена обратная корреляционная зависимость между уровнем тиреотропного гормона и ударным индексом (r = –0,65, p<0,01), а также фракцией выброса (r = –0,58, p<0,01).
3. Отношение максимальной ранней диастолической скорости на митральном клапане (E) к максимальной поздней диастолической скорости на митральном клапане (A) у пациентов 1-й группы ниже на 35,4% (р<0,001), 2-й группы – на 53,5% (p<0,001), 3-й группы – на 41,7% (p<0,001). Проведенное корреляционное исследование показало зависимость отношения пика Е/А от уровня ТТГ (r = –0,48, p<0,05).
4. Антиаритмическую терапию пароксизмов фибрилляции предсердий у больных с дисфункцией щитовидной железы необходимо начинать после достижения эутиреоидного статуса. У пациентов с субклиническим гипотиреозом время достижения эутиреоидного статуса составляет 45,6±2,8 дня, а при субклиническом тиреотоксикозе – 37,6±4,8 дня. Препаратами выбора для профилактики пароксизмов фибрилляции являются соталол, бисопролол, пропафенон, а также их комбинации.
Библиографическая ссылка
Рахматуллов Р.Ф., Мельникова Л.В., Моисеева И.Я., Рахматуллов Ф.К., Бурмистрова Л.Ф. СОПОСТАВЛЕНИЕ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИХ И ГЕМОДИНАМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ С ФУНКЦИОНАЛЬНЫМ СОСТОЯНИЕМ ЩИТОВИДНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. 2022. № 2. ;URL: https://science-education.ru/ru/article/view?id=31517 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31517



