Первичная медиастинальная В-крупноклеточная лимфома (ПМВКЛ), не так давно выделенная в самостоятельную нозологию, является подтипом диффузной В-крупноклеточной лимфомы, возникающей из небольшой популяции В-клеток в тимусе [1]. Клинически характеризуется образованием конгломерата лимфоузлов в средостении с распространением на близлежащие ткани и органы. ПМВКЛ наблюдается преимущественно у молодых пациентов, а лечение агрессивными режимами химиотерапии в сочетании с ритуксимабом и лучевой терапией или без нее, по-видимому, дает лучшие результаты, чем при других ДВКЛ, отчасти в результате более молодого возраста пациентов, а 5-летняя выживаемость в недавних исследованиях составляет более чем 90% [2–5]. При прогнозировании риска раннего рецидива принято использовать Международный прогностический индекс, а также индекс, скорректированный по возрасту. Несмотря на агрессивность лечения, остается высокой частота рецидивов ПМВКЛ, а также первично-рефрактерных форм заболевания.
Согласно клиническим рекомендациям, оценку эффективности лечения проводят спустя 2–3 курса ХТ, а также после завершения иммунохимиотерапии. Наиболее информативным методом диагностики в таком случае является позитронно-эмиссионная томография (ПЭТ-КТ), чему посвящены многочисленные современные исследования [6–8]. ПЭТ-КТ – неинвазивный количественный метод визуализации биохимических, физиологических и биологических процессов in vivo. На сегодняшний день это наиболее специфичный и чувствительный метод визуализации. Опухоли имеют ускоренный гликолиз, при этом радиофармпрепарат (РФП) задерживается в тканях с повышенной метаболической активностью по сравнению с нормальными тканями [9].
Цель исследования: проанализировать результаты ПЭТ-контроля у пациентов после проведенного лечения, а также оценить общую и бессобытийную 5-летнюю выживаемость пациентов в зависимости от ПЭТ-ответа.
Материалы и методы исследования. В исследование были включены данные о 32 пациентах с установленным диагнозом первичной медиастинальной В-крупноклеточной лимфомы различных стадий, получающих лечение на базе онкогематологического отделения ФГБУ «НМИЦ онкологии» МЗ РФ в период с 2016 по 2021 гг. Пациенты разделены на группы в зависимости от ПЭТ-ответа, а также от полученной терапии. Статистическая обработка данных осуществлялась с использованием пакета STATISTICA13, метода Каплана–Мейера и логрангового критерия.
Результаты исследования и их обсуждение. ПЭТ-КТ для оценки эффективности иммунохимиотерапии применялась в качестве оценки динамики у всех 32 пациентов. Терапией первой линии во всех случаях стали стандартные CHOP-подобные режимы (R-CHOP, DAR-EPOCH) в сочетании с ритуксимабом (R).
ПЭТ-позитивный результат (4–5 баллов по шкале Deauville) после проведенной терапии 1-й линии наблюдался у 14 человек (43,75%). Среди этих пациентов преобладали больные с IV стадией процесса (85,7%), в основном за счет вовлечения легочной ткани и сосудов. «В-симптомы» наблюдались у 78,5% пациентов. ПЭТ-негативный результат (1–2 балла по шкале Deauville) наблюдался у 12 пациентов (37,5%), всем пациентам была назначена консолидирующая дистанционная лучевая терапия (ДЛТ). У 6 больных (18,75%) ответ расценен как неоднозначный результат (Deauville 3).
Средняя продолжительность жизни больных в группе с высокой метаболической активностью составила 30,8±9,0 месяца, тогда как у пациентов с низкой активностью – 34,5±4,2 месяца (р=0,0003). В группе пациентов, имеющих ПЭТ-позитивный ответ (4–5 баллов по шкале Deauville), 5-летняя общая выживаемость составила 32,1±14,6% (±SE), в то время как 5-летняя общая выживаемость в группе пациентов с низкой метаболической активностью составила 93,9±4,2% (±SE) (р=0,0003) (рис. 1).
В группе больных, имеющих ПЭТ-негативный результат, бессобытийная 50-месячная выживаемость составила 87,7±5,8% (±SE) (рис. 2). Средняя продолжительность бессобытийного периода жизни в группе пациентов, имеющих ПЭТ-позитивный ответ, составила 10,9±3,6 месяца, в группе пациентов с низкой метаболической активностью – 33,3±4,4 месяца (р=0,0000).
В нашем исследовании также обнаружена связь между наличием массивного конгломерата в средостении (bulky disease) и течением заболевания. В среднем объем конгломерата в средостении среди пациентов составил 109,73±60,55 мм (151; 222). В исследовании «bulky disease» обнаружен у 31 пациента (96,8%). ПЭТ-позитивный результат (4–5 баллов по шкале Deauville) в данной группе пациентов наблюдался у 12 больных (38,7%).
Средняя продолжительность жизни больных из группы пациентов, имеющих «bulky disease», составляет 28,5±4,3 месяца; в группе пациентов без «bulky disease» – 42,8±7,7 месяца. (±SE) (р=0,0111). Следует отметить, что 5-летняя общая выживаемость у пациентов без «bulky disease» составила 100% (рис. 3), в то время как у пациентов, имеющих «bulky disease», она составила 60,0±10,6% (±SE) (рис. 4). Медиана бессобытийной выживаемости достигнута только в одной группе пациентов с «bulky disease» и составляет 23,5 месяца. Средняя продолжительность бессобытийного периода жизни в группе без «bulky disease» – 35,8±7,0 месяца (±SE), а в группе c «bulky disease» – 21,8±3,8 месяца. Пятилетняя бессобытийная выживаемость без «bulky disease» – 87,5±8,3% (р=0,0086) (рис. 4), в то время как c «bulky disease» – 40,1±12,0% (±SE).
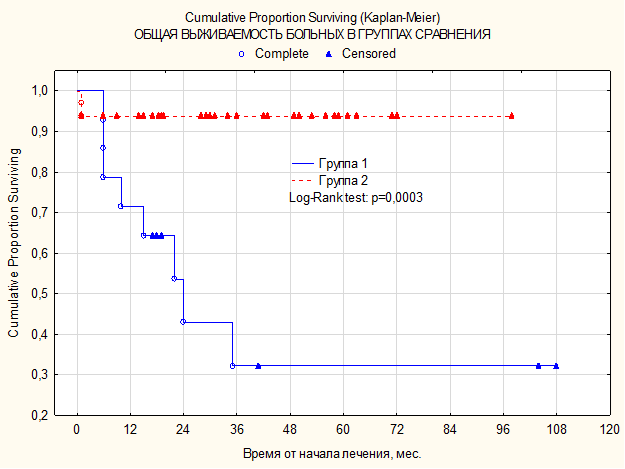
Рис. 1. Кривая общей 5-летней выживаемости по Каплану–Майеру в зависимости от наличия высокой метаболической активности по ПЭТ-КТ (4–5 баллов)
Группа 1 – пациенты, имеющие ПЭТ-позитивный ответ (4–5 баллов по шкале Deauville), обозначены синей линией.
Группа 2 – пациенты, имеющие ПЭТ-негативный ответ (1–3 балла по шкале Deauville), обозначены красной линией.
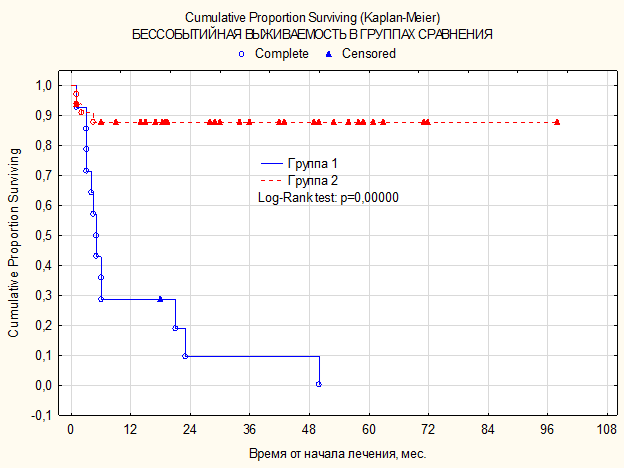
Рис. 2. Кривая бессобытийной выживаемости по Каплану–Майеру в зависимости от наличия высокой метаболической активности по ПЭТ-КТ (4–5 баллов)
Группа 1 – пациенты, имеющие ПЭТ-позитивный ответ (4–5 баллов по шкале Deauville), обозначены синей линией.
Группа 2 – пациенты, имеющие ПЭТ-негативный ответ (1–3 балла по шкале Deauville), обозначены красной линией.
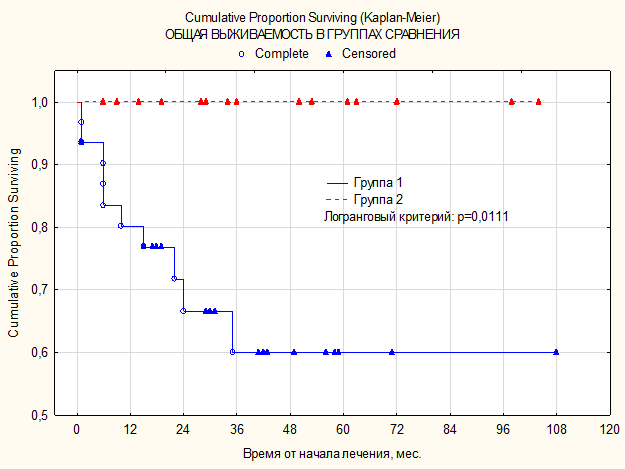
Рис. 3. Кривая общей 5-летней выживаемости по Каплану–Майеру в зависимости от наличия «bulky disease»
Группа 1 – пациенты, имеющие «bulky disease», обозначены синей линией.
Группа 2 – пациенты без «bulky disease», обозначены красной линией.
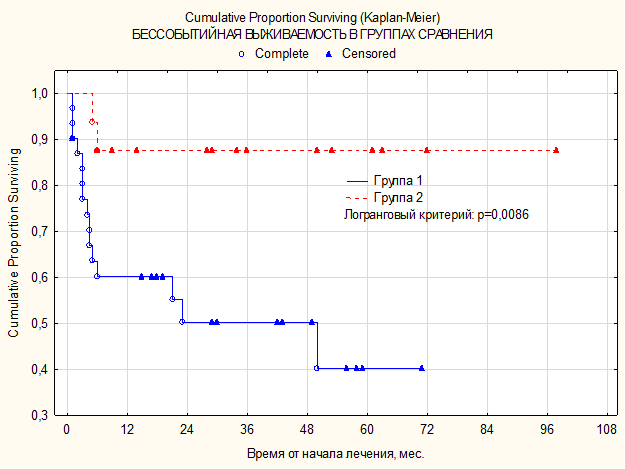
Рис. 4. Кривая бессобытийной выживаемости по Каплану–Майеру в зависимости от наличия «bulky disease»
Группа 1 – пациенты, имеющие «bulky disease», обозначены синей линией.
Группа 2 – пациенты без «bulky disease», обозначены красной линией.
По данным разных авторов, роль ПЭТ-КТ в диагностике неходжкинских лимфом (НХЛ) разной степени злокачественности противоречива [9, 10]. Имеются исследования о возможности дифференциальной диагностики ПМВКЛ и лимфомы Ходжкина (ЛХ) на основе некоторых лабораторных показателей и данных ПЭТ-КТ [11]. Также отмечается связь между накоплением Ki-67, накоплением РФП и прогнозом [12, 13]. ПЭТ-КТ может использоваться на различных этапах диагностики и лечения пациентов: как на этапе стадирования, так и для оценки проводимого лечения и определения тактики ведения больного. Все пациенты в нашем исследовании проходили контрольное исследование (ПЭТ-КТ) после завершения лечения и получали дальнейшую терапию в зависимости от результата.
Согласно литературным данным (L. Ceriani, L. Milan, PWM Johnson, 2019), сохранение ПЭТ-позитивности остаточного конгломерата может наблюдаться по нескольким причинам, одной из которых является накопление ФДГ остаточной тканью тимуса. В группе пациентов с неоднозначным ответом ориентировались на уровень накопления фармпрепарата в печени, что считается более информативным и прогностически значимым [14].
В статье (Pinnix CC, Ng AK,2018) ПЭТ-КТ применяется с целью возможности последующей интенсификации терапии при ПЭТ-позитивном результате [15]. Пациенты с ответом Deauville 4 и 5 после терапии по схеме DA-R-EPOCH нуждаются в обсуждении в каждом конкретном случае. В исследовании [16] 25 из 65 (38%) пациентов имели Deauville 4–5 после терапии DA-R-EPOCH, 12 из них в последующем перенесли рецидив. 2-летняя выживаемость без прогрессии составила 51%; при этом данный показатель был еще ниже для пациентов с Deauville 5 (22%).В этом исследовании ни у одного пациента с Deauville от 1 до 3 после DA-R-EPOCH не было зарегистрировано рецидива, что позволяет предположить, что оценка при помощи ПЭТ-КТ после DA-R-EPOCH может являться достоверной для таких пациентов.Это подтверждается и результатами недавнего исследования, в котором описаны данные о 156 взрослых пациентах с ПМВКЛ, получавших терапию DA-R-EPOCH, в котором 3-летняя безрецидивная выживаемость составила 95% для пациентов с Deauville 1–3 после терапии против 55% для пациентов с Deauville 4–5 [17]. В исследовании [18] не получено доказательств необходимости интенсификации лечения и перехода к терапии ко 2-й линии после CHOP-подобного режима c консолидацией ДЛТ и сохранении Deauville <5.
Стоит отметить отсутствие литературных данных относительно выживаемости пациентов с наличием «bulky disease» при ПМВКЛ. Согласно результатам исследования (H. Takasaki, W. Yamamoto, 2015), наличие «bulky disease» у пациентов с диффузной В-крупноклеточной лимфомой не коррелировало с ухудшением общей и бессобытийной выживаемости таких пациентов. В этом же исследовании оценивался ПЭТ-ответ в зависимости от наличия массивного конгломерата в средостении и без него. Общая выживаемость у пациентов с ПЭТ-позитивным результатом составила 34% против 75% у пациентов с ПЭТ-негативным ответом, бессобытийная выживаемость пациентов с ПЭТ-позитивным результатом и «bulky disease» составила 83% против 36% у пациентов с ПЭТ-негативным результатом (у=95%). Однако в данном исследовании при инвазии окружающих структур считалось, что у пациента – ПМВКЛ, что являлось критерием исключения [19].
Также существуют данные о возможных ложноположительных результатах вследствие остаточной ткани тимуса и применения моноклональных антител (МКА) и гранулоцитарных колониестимулирующих факторов (ГКСФ) в терапии 1-й линии [13]. Поскольку фтордезоксиглюкоза (ФДГ) поглощается инфильтрирующими опухоль лейкоцитами и ГКСФ, он стимулирует продукцию лейкоцитов и изменяет распределение ФДГ.
Выводы. Таким образом, ПЭТ-ответ может считаться фактором, влияющим на выживаемость пациентов с ПМВКЛ. Планирование дальнейшей терапии у пациентов с ПМВКЛ в зависимости от результатов ПЭТ-КТ является в настоящий момент критерием выбора для оценки динамики процесса и успешности проводимого лечения. В нашем исследовании ПЭТ-позитивный ответ (4–5 баллов) после проведенной ХТ 1-й линии коррелировал с более низкой общей и бессобытийной выживаемостью пациентов с ПМВКЛ. Особого внимания заслуживает распространенность ПЭТ-позитивных результатов у пациентов с наличием массивного конгломерата в средостении «bulky disease» (38,7%), так как наличие данного симптома может также служить причиной более низкой выживаемости больных с ПМВКЛ. При ПЭТ-негативном ответе пациентам в нашем исследовании проводилась ДЛТ, которая также улучшила общую выживаемость пациентов с ПМВКЛ [20]. Тактика ведения пациентов с неоднозначным ответом при ПЭТ-контроле требует дальнейшего изучения и обсуждения в каждом конкретном случае.
Ограничения исследования. Настоящее исследование имеет ряд ограничений, которые необходимо учитывать. Работа представляет собой одноцентровое ретроспективное исследование с небольшой выборкой пациентов, что могло повлиять на интерпретацию результатов.
Библиографическая ссылка
Камаева И.А., Лысенко И.Б., Николаева Н.В., Гайсултанова Я.С., Саманева Н.Ю. ПЭТ-ОТВЕТ КАК ПРЕДИКТОР ВЫЖИВАЕМОСТИ У ПАЦИЕНТОВ С ПЕРВИЧНОЙ МЕДИАСТИНАЛЬНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМОЙ // Современные проблемы науки и образования. 2022. № 1. ;URL: https://science-education.ru/ru/article/view?id=31462 (дата обращения: 21.02.2026).
DOI: https://doi.org/10.17513/spno.31462



