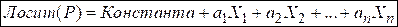Одним из актуальных направлений современного здравоохранения является развитие персонифицированной медицины. Основным подходом в случае изучения мультифакторных патологий служит предсказание на основе геномных данных вероятности возникновения того или иного заболевания и его диагностики с учетом индивидуальных показателей пациента, в том числе биомаркеров различной молекулярной природы. Среди таких заболеваний в области ревматологии лидирующее место занимает ревматоидный артрит (РА) – это хроническое воспалительное заболевание соединительной ткани, характеризующееся прогрессирующим поражением суставов и специфическими системными нарушениями. На сегодняшний день число пациентов с аутоиммунным артритом составляет почти 1% населения мира, что создает актуальную проблему для систем здравоохранения. Очевидной особенностью РА является клинический полиморфизм, представленный широким разнообразием симптомов, клинических форм и темпов прогрессирования. РА считается многофакторным заболеванием с доказанной генетической предрасположенностью и вовлечением факторов окружающей среды [1].
Данные genome-wide association studie (GWAS) свидетельствуют, что основные гены предрасположенности к РА принадлежат локусу главного комплекса гистосовместимости (MHC). Этот локус, охватывающий 4 Мbp, находится в области 6p21.3 и содержит около 250 генов, кодирующих антигенные белки для распознавания Т-клетками. Считается, что до 60% возможных полиморфизмов (генетических вариантов), ответственных за восприимчивость к RA, происходят из локуса MHC [2]. Исторически первыми кандидатами были гены и аллели локуса HLA DRB1, позже, с развитием методов молекулярной биологии, были выявлены маркерные аллели в локусах DQA1, DQB1. Анализ литературных данных показывает, что в различных популяциях мира установлены предрасполагающие аллели, кодирующие позиции ассоциированных с RA аминокислот, которые расположены в середине эпитоп-связывающих карманов молекул HLA. Таким образом, замены могут напрямую влиять на антигенную специфичность и приводить к связыванию белка с остатками цитруллина как основного патогенетического фактора развития аутоиммунитета. Так, в наших работах определены ассоциативные (HLA DRB1*01, *03, *04) и протективные гены (DRB1*11, *13) в русской популяции Челябинской области. Другая группа геномных маркеров предрасположенности к РА – это гены цитокинов и их рецепторов как ключевых компонентов сигнальных путей и ко-стимулирующих факторов. Возможные механизмы, которые реализуются через различные SNP генов цитокинов, согласно литературным данным, – это влияние на воспалительные реакции и дифференцировку клеток [3, 4]. У больных ревматоидным артритом русской популяции Челябинской области нами установлено, что генотип Т/С –1031 TNFα – маркер предрасположенности к ревматоидному артриту у женщин, наличие системных проявлений ассоциировано с гетерозиготным генотипом G/A – 308 TNFα [5]. Поскольку гены HLA I, II и III класса локализуются на одной и той же хромосоме, вероятнее всего полиморфизмы TNFА находятся в неравновесных сцеплениях с локусами –A, –B, –B1, –DQA1, –DQB1 системы HLA и формируют определенные сочетания – гаплотипы. В группе больных РА русской популяции определен ряд гаплотипов TNFA-HLA DRB1, TNFA-HLA DQA1, TNFA-HLA DQB1 [6], частоты которых были повышены, и по критерию отношения шансов они могут рассматриваться как потенциальные биомаркеры предрасположенности к РА. В продолжение исследования новой задачей является поиск комплекса связанных факторов, ассоциированных с развитием ревматоидного артрита, из уже установленных для данной популяции частот гаплотипов с использованием метода логистической регрессии. Цель: построение модели логистической регрессии на основе гаплотипов TNFA-HLA DRB1, TNFA-HLA DQA1, TNFA-HLA DQB1, позволяющей выявить наличие/отсутствие ассоциации с предрасположенностью к ревматоидному артриту у русских Челябинской области.
Материалы и методы исследования. Контингент обследуемых лиц. В исследование включены больные с верифицированным диагнозом «ревматоидный артрит» (98 человек, из них: женщин – 81, мужчин – 17, средний возраст – 51,7±1,3 года). Группа сравнения (132 человека: мужчин – 73, женщин – 59, средний возраст – 34,6±0,75 года) составлялась на основе популяционной выборки, сформированной случайным образом на основе ДНК-банка потенциальных доноров костного мозга ГБУЗ «Челябинская областная станция переливания крови», проживающих в г. Челябинске и Челябинской области. Популяционная принадлежность определялась по данным генеалогического анамнеза до третьего поколения (согласно рекомендациям 8-го Международного Симпозиума в 1980 г., Лос-Анджелес, США) [5].
Молекулярно-генетические методы определения генетического полиморфизма промоторной области TNFA HLA II класса подробно представлены в нашей статье [6].
В исследовании использовались следующие методы и подходы, принятые для анализа частотных данных. Оценка неравновесного сцепления (D’, частоты гаплотипов, достоверность сцепления) проводилась при помощи EM-алгоритма в программе Arlequin ver 5. [7]
При анализе достоверности различий между группами больных РА и условно здоровых лиц использовались стандартные для иммуногенетики критерий χ2, критерий Фишера для одной степени свободы, критерий отношения шансов с расчетом 95%-ного доверительного интервала. Различия считались достоверными при р≤0,05.
Для построения прогностической модели исхода применялся метод логистической регрессии, выполненный с помощью программного обеспечения MedCalc Version 20 [8]. В анализ были включены гаплотипы, частоты которых были достоверно повышены в группе больных, по критерию отношения шансов их носительство повышает вероятность развития РА.
Для оценки качества исследуемой модели использовали такие параметры, как: диагностическая эффективность, чувствительность и специфичность. Модель логистической регрессии имеет вид:
|
|
|
где P – вероятность отнесения пациента к группе заболевания, 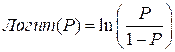 ;
;
ai – коэффициенты регрессии (равны ln ОШ (отношения шансов) для каждой из независимых переменных);
Xi – значения вошедших в модель показателей.
Зная коэффициенты регрессии, можно рассчитать Логит(Р) и далее – само значение Р:
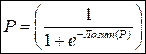
Если р<0,5, обследуемого следует причислить к группе 0 (отсутствие риска), если p>0,5 – к группе 1 (наличие риска).
Для определения конкретного значения показателя, который вносит больший вклад в значимость модели, использовали ROC-анализ и рассчитывали площадь под ROC-кривой. Для количественной оценки ROC-анализа применяли показатель AUC (area under curve, численное значение клинической значимости диагностического теста). Показатель площади под ROC-кривой выше 0,7 свидетельствует о высоком качестве диагностического теста [9].
Результаты исследования и их обсуждение. Первый этап исследования заключался в оценке достоверных изменений в частотах встречаемости гаплотипов TNFA-HLADRB1, TNFA-HLADQA1, TNFA-HLADQB1 в группах больных ревматоидным артритом и сравнения. Показано наличие неравновесного сцепления и между однонуклеотидными полиморфизмами в точках -1031 T/C, -863 C/A, 308G/A, -238 G/A и генными семействами в локусах HLADRB1, DQA1, DQB1. При сравнении двух групп (больных и условно здоровых лиц) установлены гаплотипы, частоты которых повышены в группе больных, по критерию OR их носительство повышает вероятность развития РА. Таких гаплотипов получилось 11, для последующего включения в модель все они закодированы с использованием букв английского алфавита (табл. 1).
Таблица 1
Названия гаплотипов, включенных в модель
|
гаплотип |
OR, 95% CI |
Обозначение для модели |
|
TNF -1031*c-DQA1*05:01 |
11,7 3,4–40,6 |
a |
|
TNF -1031*t-DQB1*03:02 |
7,038 3,32–14,92 |
b |
|
TNF -1031*с-DQB1*02:01 |
6,18 1,74– 21,99 |
c |
|
TNF -1031*c-HLADRB1*03 |
5,39 1,76–16,49 |
d |
|
TNF -1031*t-HLADRB1*04 |
7,0 3,9–12,6
|
e |
|
TNF-238*g - HLADRB1*04 |
6,69 3,7–12,01 |
f |
|
TNF -308*g-DQA1*03:01 |
4,38 2,68–7,15 |
g |
|
TNF -308*g-DQB1*03:02 |
3,2 1,79 – 5,74
|
h |
|
TNF -308*g-DRB1*04 |
7,32 4,05–13,25 |
i |
|
TNF -863*a DRB1*03 |
17,2 2,2–133,1 |
j |
|
TNF -863*а-DQA1*05:01 |
28,23 3,75–212,80 |
k |
На втором этапе на основе всех значимых гаплотипов построена модель с высокой статистической значимостью (χ2 ml=131,97, df=12, р<0,0001), относительно высокой диагностической эффективностью – 82,33%, чувствительностью 72,53% и специфичностью 89,52%, что позволяет определить высокий риск формирования РА. Получившаяся модель логистической регрессии развития РА в зависимости от носительства двухлокусных гаплотипов TNFA- HLA II класса и пола больных имеет вид:
logit(p)= –2,88 – 39,68*a + 23,49*b – 1,2*c + 40,0*d + 2,38*e – 21,11*f +1,98*g – 23,39*h + 20,04*I – 40,71*j + 63,05*k + 2,16*l. Характеристики модели представлены в таблице 2.
Таблица 2
Параметры и характеристика модели логистической регрессии развития РА в зависимости от носительства гаплотипов и пола
|
Показатели |
Коэффициент регрессии |
Стандартная ошибка |
P |
OR |
95% CI |
|
TNFA -1031*c – HLA DQA1*05:01 |
–39,67952 |
29481,55 |
0,99 |
5,8533E-18 |
|
|
TNFA -1031*t – HLA DQB1*03:02 |
23,49184 |
13001,68 |
0,99 |
15,9E+009 |
|
|
TNFA -1031*с – HLA DQB1*02:01 |
–1,20699 |
2,31 |
0,60 |
0,29 |
0,003 – 27,48 |
|
TNFA -1031*c – HLA DRB1*03 |
40,00378 |
29481,55 |
0,99 |
236E+015 |
|
|
TNFA -1031*t-HLA DRB1*04 |
2,37912 |
0,98 |
0,016 |
10,79 |
1,57 – 74,23 |
|
TNFA -238*g –HLA DRB1*04 |
–21,11167 |
20130,99 |
0,99 |
6,7814E-10 |
|
|
TNFA -308*g – HLA DQA1*03:01 |
1,97768 |
1,08 |
0,067 |
7,23 |
0,87 - 59,84 |
|
TNFA -308*g – HLA DQB1_03_02 |
–23,39209 |
13001,68 |
0,99 |
6,9334E-11 |
|
|
TNFA -308*g – HLA DRB1*04 |
20,03676 |
20130,99 |
0,99 |
503E+006 |
|
|
TNFA -863*a- HLA DRB1*03 |
–40,71439 |
30914,18 |
0,99 |
2,0795E-18 |
|
|
TNFA -863*а- HLA DQA1*05:01 |
63,05149 |
32847,32 |
0,99 |
2,415E+27 |
|
|
Пол |
2,16433 |
0,49 |
<0,0001 |
8,71 |
3,27 - 23,19 |
|
Константа |
–2,88 |
||||
|
Чувствительность |
Модель полностью: χ2 ml=131,97, df=12, р<0,0001 Чувствительность – 72,53%, специфичность – 89,52% Диагностическая эффективность – 82,33% Площадь под ROC-кривой – 0,893±0,022 (95% CI: 0,84–0,93) |
||||
Модель была проверена на 16 людях, отобранных случайным образом из исследуемых групп (8 больных РА, 8 условно здоровых лиц). Проверка показала, что только 62,5% больных РА совпали с данной моделью, что оказалось ниже полученной чувствительности модели. Однако процент правильно диагностированных случаев среди условно здоровых лиц составил 87,5%, что соответствует заявленной в модели специфичности. Несмотря на полученные результаты и высокую значимость, применение полной модели в клинической практике пока затруднительно, вероятно, требуются дальнейшие исследования с увеличением исследуемых групп. Однако было установлено, что наибольшей статистической значимостью обладали три показателя: пол и два гаплотипа: TNFA -1031*t- HLA DRB1*04 и TNFA -308*g – HLA DQA1*03:01. Интересно, что разные аллельные варианты TNFA включают в себя HLA DRB1*04 и DQA1*03:01, для которых показана предрасполагающая роль в развитии РА в составе самостоятельного устойчивого гаплотипического сочетания HLA DRB1*04-DQA1*03:01.
Кроме гаплотипов, значимым фактором, формирующим предрасположенность к РА, оказался пол больных (р<0,0001). Полученные нами результаты о значимости пола при формировании модели предрасположенности к ревматоидному артриту подтверждают литературные данные о повышенной частоте встречаемости ревматоидного артрита у женщин, среди заболевших РА соотношение женщины : мужчины составляет от 3:1 до 4:1 [2, 3].
Нами также проведен ROC-анализ для каждого из трех статистически значимых показателей модели. Установлено, что гаплотип TNFA -1031*t- HLA DRB1*04 с чувствительностью 79,7% и специфичностью 74,0% (площадь под ROC-кривой 0,731 (95% CI: 0,67–0,79)) позволяет выявить предрасположенность к ревматоидному артриту. Полученная логит-модель свидетельствует о том, что значимое влияние на формирование предрасположенности к ревматоидному артриту у русских Челябинской области оказывает двухлокусный гаплотип TNFA -1031*t- HLA DRB1*04, содержащий функционально значимый аллельный вариант TNFA -1031*t и генную специфичность HLA DRB1*04, являющуюся главным фактором восприимчивости к РА. Модель показала, что в развитие данной аутоиммунной патологии вносит вклад комплекс генетических факторов, не ограничивающихся локусами HLA, и позволила выявить межгенные связи. Использование в практике различных вариантов анализа данных, в частности построение модели логистической регрессии, позволяет находить новые зависимости, интересные взаимосвязи и направить ход исследования в перспективное русло. Комплексное выявление максимально возможных предикторов даст возможность клиницисту использовать эти данные для прогноза развития и течения РА.
Заключение. Таким образом, нами протестирован один из вариантов построения логистической регрессионной модели риска развития ревматоидного артрита, на основании которой идентифицированы главные генетические факторы и их комбинации в локусах генов TNFA и HLA II класса. Полученные результаты могут служитьпредпосылкой для оценки риска развития ревматоидного артрита и включены в разработку комплекса профилактических мероприятий, что и является одним из подходов персонифицированной медицины. Одним из сложным моментов разработки таких моделей служит то, что развитие данного заболевания является результатом комплексного воздействия факторов и наличие генетической предрасположенности не является однозначным предиктором. Прогнозирование на основе модели логистической регрессии позволяет провести анализ всех доступных для анализа факторов и более точно осуществить ранний этап первичной профилактики для данной патологии.
Исследование выполнено при финансовой поддержке РФФИ и Челябинской области в рамках научного проекта № 20-415-740013.
Библиографическая ссылка
Сташкевич Д.С., Хромова Е.Б., Девальд И.В., Ходус Е.А., Филиппова Ю.Ю., Бурмистрова А.Л. ГАПЛОТИПЫ TNFA-HLA II КЛАССА КАК ПРОГНОСТИЧЕСКИЕ МАРКЕРЫ РЕВМАТОИДНОГО АРТРИТА // Современные проблемы науки и образования. 2022. № 1. ;URL: https://science-education.ru/ru/article/view?id=31426 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/spno.31426