Клеточная мембрана во многом определяет барьерно-рецепторную функцию, пролиферацию, рост, наличие ферментов и антигенов клетки. В основном биомембрана состоит из белков и липидов, углеводы являются частью гликопротеинов и гликолипидов. Белки бывают интегральные, погруженные в мембрану, и периферические, диссоциирующие от мембраны. Липиды представлены четырьмя группами: фосфолипидами, гликолипидами, сфинголипидами и стероидами. Благодаря взаимодействию полярных «головок» и гидрофобных жирных цепей создаваемые бислойные структуры стабильны в водном окружении, в то же время жирнокислотные компоненты липидов сильно подвержены сезонной и патологической изменчивости. Организация сфинголипидов и холестерола способствует формированию жидкостного упорядоченного состояния, которое отделяет их от фосфолипидов в клеточной мембране. Сфингомиелин является основным сфинголипидом клеток животных, присутствующим во внешнем листке плазматической мембраны. Путем гидролиза сфингомиелина сфингомиелиназой (SMase), а также синтеза de novo в эндоплазматическом ретикулуме, который инициируется с помощью серин-пальмитоилтрансферазы (СПТ) и рециркулизации сфингозина через церамидсинтазу (ЦС) образуются церамиды. Церамид – это представитель сфинголипидов, состоящий из сфингозинового остова (N-ацилированное производное спирта сфингозина), связанного амидной связью с цепью жирных кислот различной длины (С14–С36), например, церамид С16:0 имеет в своей структуре пальмитиновую кислоту. Существует 6 изоформ церамидсинтазы, каждая из которых проявляет субстратную специфичность к жирным кислотам с разной длиной ацильной цепи. После связывания с потенцирующим лигандом сфингомиелиназа увеличивает долю церамидов, изменяя физические свойства органеллы. Церамиды увеличивают количество ацильных цепей в липидных бислоях – возрастает вязкость мембраны. Молекулы церамидов очень гидрофобны, притяжение, вызванное силами Ван-дер-Ваальса и дополненное выталкивающей силой воды, инициирует спонтанное связывание друг с другом, что приводит к плотной упаковке и процессу самоагрегации, объединению пучков рецепторов и образованию обогащенных церамидами рафтов, участвующих в передаче сигнала регуляции (рис. 1) [1].
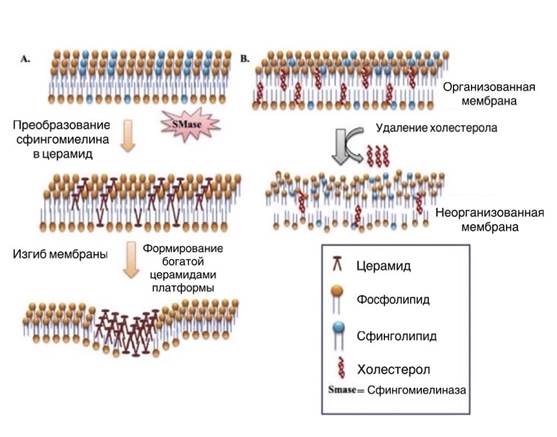
Рис. 1. Организация билипидного слоя
Пути образования церамидов
Церамид может синтезироваться тремя различными путями. Первый путь – это синтез путемde novoв эндоплазматическом ретикулуме, второй - гидролиз сфингомиелина под действием фермента сфингомиелиназы, что приводит к образованию фосфохолина и церамида. Третьий путь - рециркуляция сфингозина, данный вариант синтеза называется путем «спасения» (рис. 2) [2].
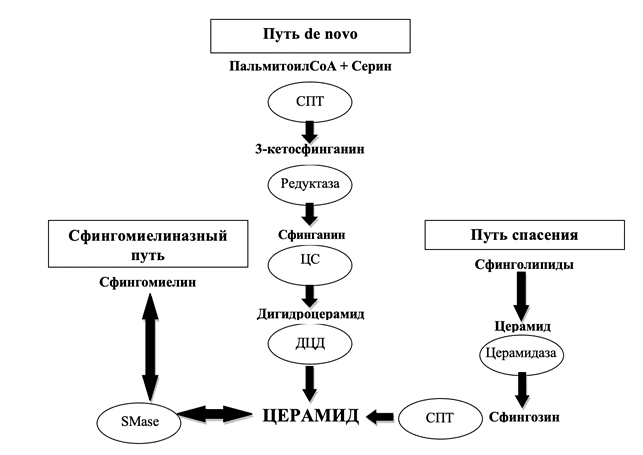
Рис. 2. Три пути образования церамидов
1. Синтез de novo происходит в эндоплазматическом ретикулуме (ЭР). Данный процесс начинается с конденсации серина и пальмитоил-КоА с образованием 3-кетосфингазина под действием фермента серинпальмитоилтрансферазы (СПТ). Продуктом СПТ является 3-кето-дигидросфингозин, который восстанавливается 3-кетосфинганинредуктазой с образованием сфинганина (дигидросфингозина), а он в свою очередь N-ацилируется церамидсинтазой (CerS) с образованием дигидроцерамида (DhCer). CerS – это один из ферментов в пути de novo. Представлен шестью различными изоформами. Каждая изоформа обладает субстратной специфичностью относительно длины присоединяемых ацилов-КоА. Затем фермент дигидроцерамид-десатуразы (DEGS1) катализирует реакцию, вводя двойную связь в положение C4-5 в основной цепи сфингоидного основания DhCer, как следствие, образуется церамид. Имеются данные, что у больных сахарным диабетом 2 типа (СД2), имеющих инсулинорезистентность, увеличивается концентрация церамида C16:0, который играет патогенную роль в формировании инсулинорезистентности. Синтез церамида C16:0 катализирует изофермент CerS-6 [2, 3].
2. Сфингомиелиназный путь – это гидролиз сфингомиелина (СМ) кислой сфингомиелиназой (SMase) в плазматической мембране, лизосомах, комплексе Гольджи, митохондриях. Существует несколько типов сфингомиелиназ: магнийзависимая кислая сфингомиелиназа, магнийзависимая нейтральная сфингомиелиназа, щелочная сфингомиелиназа и митохондриальная сфингомиелиназа. Они отличаются оптимальным значением рН, молекулярной массой и зависимостью от двухвалентных ионов.
3. Путь «спасения» мало изучен, он протекает в лизосомах и эндосомах. Под действием кислой SMase и кислой β-глюкозидазы сфингомиелин и гликосфинголипиды подвергаются ферментативному расщеплению до церамида. Превращение церамида в сфингозин происходит через кислую церамидазу (АЦ). Сфингозин может повторно поступать в цитозоль и использоваться для ресинтеза церамида с помощью CerS (рис. 3) [2, 3].
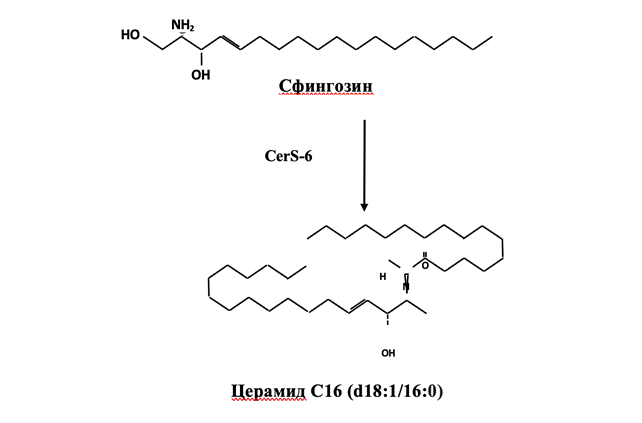
Рис. 3. Синтез церамида из сфингозина, катализируемый церамидсинтазой
Церамид как сигнальная молекула
Помимо обеспечения структурной целостности мембран, церамиды также действуют как вторичные посредники в процессах передачи сигналов в клетке, модулируя апоптоз, подавляя клеточный цикл и дифференцировку. В недавних публикациях сообщалось об изменении экспрессии церамидов при патологических состояниях, таких как рак, сахарный диабет, болезнь Альцгеймера, ишемическая болезнь сердца, рассеянный склероз. Церамиды или комбинации панелей были предложены в качестве биомаркеров специфических заболеваний, которые могут быть обнаружены в пораженной ткани, синовиальной жидкости, спинномозговой жидкости и крови.
Церамиды способны индуцировать кластеризацию, агрегацию и реорганизацию рецепторных молекул, таких как CD95, CD40, DR5 и β1-интегрин [4–6]. Концентрация церамидов с различной длиной ацильной цепи в клетке увеличивается в ответ на стрессовые факторы: радиацию, УФ излучение [7, 8], химиотерапию [9, 10], на воздействие табачного дыма и других канцерогенов. Церамиды регулируют передачу сигнала на онкогенные рецепторы [11–13], модулируют пути регуляции опухолевого роста [14–16]. Важно отметить антагонистические функции CerS1 и CerS 6 [17]. Повышение концентраций CerS6/C16:0 способствует пролиферации раковых клеток. В свою очередь, уровни CerS1/C18:0 увеличиваются после обработки химиотерапевтическими ЛС. C18:0 церамид индуцирует аутофагию, апоптоз опухолевой клетки [18, 19]. Изменение внутриклеточного гомеостаза ведет к изменению сигнальной среды и выбору пути образования сфинголипидов, потенцируя активацию кислой и нейтральной сфингомиелиназ и накопление церамидов [20].
Шесть известных церамидсинтаз (CerS1-6) образуют церамиды с различной длиной ацильной цепи. Производные распределяются в тканях, изменяя метаболизм при различных заболеваниях, данные представлены в таблице на основе обобщенного материала статьи [21].
Церамидсинтазы и экспрессия их церамидов
|
Наименование церамидсинтазы |
Церамиды |
Наибольшая концентрация в тканях |
|
CerS1 |
C18:0 |
Мозг, гонады, скелетная мускулатура |
|
CerS2 |
C22:0-C24:0 |
Печень и почки |
|
CerS3 |
C26:0-C36:0 |
Кожа и гонады |
|
CerS4 |
С18:0-С22:0 |
Кожа, печень и сердце |
|
CerS5 |
С16:0 |
Легкие |
|
CerS6 |
С14:0-С16:0 |
Кишечник, селезенка, лимфатические узлы и тимус |
Участие церамидов в развитии инсулинорезистентности
Одним из факторов развития инсулинорезистентности является повышенный синтез церамидов с длинной ацильной цепью. Длинноцепочечные насыщенные неэтерифицированные жирные кислоты (НЭЖК) являются главным источником синтеза церамидов (пальмитиновая участвует в синтезе церамида С16:0, стеариновая – Cer-С18:0, арахидоновая – Cer-С20:0 и линоцериновая – Cer-С24:0). Повышенное содержание субстрата (НЭЖК) способствует их большему образованию и накоплению церамидов в клетке. Как известно, наиболее патогенным потенциалом обладает С16:0-церамид, синтез которого катализирует изофермент церамидсинтаза-6. С16:0-церамид можно рассматривать не только в качестве маркёра ожирения, но и как интермедиат, опосредующий взаимосвязь между ожирением, жировой инфильтрацией печени и системной резистентностью к инсулину. Исследования связывают развитие инсулинорезистентности с фактором некроза опухоли альфа (TNF-α). При ожирении его экспрессия повышается в жировой ткани, и он способен индуцировать резистентность к инсулину. На клеточном уровне TNF-альфа является мощным ингибитором стимулированного инсулином фосфорилирования тирозина на бета-цепи рецептора инсулина и субстрата-1 рецептора инсулина, что свидетельствует о дефекте тирозинкиназной активности рецептора инсулина. Нейтрализация TNF-альфа в одной из этих моделей улучшает чувствительность к инсулину за счет увеличения активности тирозинкиназы рецептора инсулина, особенно в мышечной и жировой тканях.
Молекулярным механизмом развития инсулинорезистентности является нарушение функции двух белков. Это субстрат рецептора инсулина-1 (IRS-1) и протеинкиназы B (ПКВ). Церамид ингибирует стимулируемое инсулином фосфорилирование IRS-1 по остаткам тирозина (Tyr) и одновременно повышает фосфорилирование остатков серина (Ser), что подавляет функции IRS-1. Повышение фосфорилирования Ser / Thr IRS-1 препятствует их взаимодействию с околостебельной областью рецептора инсулина, превращая их в более бедные рецепторные субстраты, которые не могут подвергнуться соответствующему фосфорилированию Tyr. Нарушение фосфорилирования Tyr устраняет способность IRS-1 привлекать нижестоящие эффекторные молекулы, такие как фосфатидилинозитол-3-киназа и приводит к серьезным нарушениям передачи инсулинового сигнала. [22, 23]. Церамиды способны ингибировать активность протеинкиназы B и подавлять поглощение глюкозы мышцами и жировой тканью, что свидетельствует об обратной корреляции между внутриклеточным содержанием церамида и активностью ПКВ. При введении животным с ожирением ингибиторов синтеза церамидов, мириоцина и циклосерина (ингибиторы СПТ), это приводит к восстановлению активности ПКБ.
Механизм инактивации ПКВ церамидом, возможен двумя путями.
Первый путь: Церамид является прямым активатором протеинфосфатазы 2А (РР2А) [24, 25] под действием которой в молекуле ПКВ происходит дефосфорилирование остатков серина-473 (Ser473) и треонина-308 (Thr-308) [26, 27], они в свою очередь необходимы для стабилизации активной конформации киназы [28, 29]. Окадаиновая кислота – ингибитор РР2А – отменяет действие церамида на ПКВ.
Второй путь: Церамид способен препятствовать связыванию ПКВ с мембранным комплексом, в состав которого входят фосфатидилинозитол-3,4,5-трисфосфат (PtdIns(3,4,5) P3) и 3-фосфоинозитидзависимая протеинкиназа-1 (PDK1) [30, 31]. При этом церамид действует опосредованно, активируя поликетидсинтазу (ПКС) в результате взаимодействия с её доменом, богатым цистеином [32–34]. ПКС фосфорилирует остатки Ser и Thr [35] в составе РН-домена ПКВ, что лишает её способности связываться с комплексом фосфатидилинозитолом (PtdIns) P3 – PDK1. В эксперименте показано, что ингибиторы ПКСz могут улучшать чувствительность к инсулину и отменять обусловленное церамидом ингибирование ПКВ в тканях животных [36].
Преобладающий механизм индуцированного церамидами ингибирования передачи сигналов ПКВ и инсулина зависит от типа клеток. В адипоцитах (культура 3L3-L1) действуют оба механизма инактивации ПКВ церамидом (РР2А- и ПКС-опосредуемый механизмы) [37].
Сахарный диабет 2 типа
В патогенезе ожирения существенную роль играют превалирование поступления энергии над ее расходом, инсулинорезистентность, эндокринная патология. Патологическое накопление не только подкожной, но и висцеральной жировой ткани потенцирует развитие системной инсулинорезистентности. Аккумулирование церамидов повышается ввиду дисфункции адипоцитов, ассоциированной их гипертрофией, депонированием триацилглицеролов (ТАГ), окислительным стрессом, воспалительными цитокинами. Активация липолиза приводит к развитию гиперлипидемии и, как следствие, повышенному поступлению субстрата для синтеза церамида de novo – НЭЖК.
Существует положительная корреляция между концентрациями церамидов с различной длиной ацильной цепи и общим церамидом при сахарном диабете 2 типа (P< 0,05). С помощью тандемной масс-спектрометрии с ионизацией электрораспылением[38] было выявлено, что подавляющая часть церамидов была представлена Cer - C24:1 и C24:0. Концентрации Cer- C18:0, C20:0, C24:1 и общего церамида были повышенные. Концентрация TNF-α увеличилась. Причиной накопления стало поступление из жировой ткани ЖК, церамидов и других сфинголипидов в кровяное русло совместно с провоспалительными цитокинами у пациентов с повышенным ИМТ [39].
Церамид-1-фосфат является прямым специфическим ингибитором активности TNF-α конвертирующий фермент (ТАСЕ), блокирующим продукцию TNF-α. В свою очередь аSMase, позволяя Cer – C18:0, C16:0 накапливаться в клетке, запускает механизм положительной обратной связи, ведущий к усиленному производству цитокинов, увеличивая концентрацию TNF-α [40,41]. Помимо этого, провоспалительный спектр цитокинов пополняют IL-1 b IL-6, которые также являются индукторами синтеза церамидов de novo [42].
Учитывая центральную роль церамидов в индукции инсулинорезистентности и воспаления, повышенные уровни церамидов в плазме могут служить прямым фактором инсулинорезистентности и липид-индуцированного воспаления.Повышенные концентрации церамидов в плазме также могут служить показателями для выявления лиц, подверженных риску развития СД 2.
В 2019 г. зарубежными коллегами было проведено исследование, целью которого стало выяснение возможности коррекции инсулинорезистентности за счет ингибирования более чем 70 % мРНК CerS6. Обработка CerS6 антисмысловыми олигонуклеотидами (ASO) избирательно снижала экспрессию фермента на ~ 90 %, преимущественно в печени, нокдаун приводил к значительному снижению Cer-C16:0 на 50 % как в печени, так и в плазме. Внутрибрюшинный тест на толерантность к введенному болюсу инсулина и пероральный тест на толерантность к глюкозе показали улучшенные результаты. Спектральный анализ массы зафиксировал снижение жировой ткани на 25 %. Доклинические фармакологические исследования показали, что ингибирование биосинтеза церамидов эффективно снижает их накопление в тканях, что улучшает течение сахарного диабета 2 типа, стеатоз печени, гипертонию [43]. Это еще раз подтверждает ключевую роль церамида C16:0, продуцируемого церамидсинтазой 6 (CerS6), в развитии инсулинорезистентности [44].Однако существуют опасения по поводу потенциальных рисков в результате глобального ингибирования биосинтеза сфинголипидов для лечения хронических заболеваний.
Продольное когортное исследование на людях (DESIR) показало, что клиническая переменная или концентрация Cer-С18:0 была значительно повышена во всех когортах и во всех измеренных временных точках с максимальным промежутком времени 9 лет до постановки диагноза СД 2. Также были повышены уровни церамидов C20:0, C22:0 и дигидроцерамида (DHC). Анализ этих сфинголипидов у более чем 250 человек из двух разных когорт показал, что концентрации дигидроцерамидов и церамидов в плазме крови непосредственно коррелируют с развитием инсулинорезистентности, и они являются потенциальными биомаркерами [45].
M. Hilvo, T. Salonurmi и др. провели популяционное исследование факторов риска, отразившее прогностическую ценность соотношений церамидов C18:0/C16:0 в плазме как главных предикторов СД2 за 10 лет до его диагностирования [46].
Жировая инфильтрация печени
Накопление липидов в печени тесно связано с развитием инсулинорезистентности, которая считается одним из наиболее значимых факторов риска неалкогольной жировой болезни печени. Вслед за нынешней эпидемией ожирения частота неалкогольной жировой болезни печени (НАЖБП) также возросла, что делает ее самой распространенной патологией печени во всем мире [47]. Термин НАЖБП применяется к разным степеням стеатоза печени – он включает изменения от простого накопления жира до стеатогепатита и фиброза. Патогенез НАЖБП еще полностью не установлен. Растущее количество доказательств предполагает «гипотезу множественных попаданий», основанную на предположении, что накопление липидов, сопровождающееся инсулинорезистентностью, увеличивает восприимчивость к повреждению печени множеством факторов, таких как липотоксичность, адипоцитокины, эндотоксин кишечного происхождения, стресс эндоплазматического ретикулума и др. [48]. Недавние обзоры литературы показывают, что среди сфинголипидов церамиды (CER) могут быть основными видами липидов, участвующих в липотоксичности во время НАЖБП. Некоторые исследования показывают, что некоторые виды церамидов могут быть более патогенными, чем другие. Предполагается, что церамиды, содержащие длинные боковые цепи, такие как пальмитиновая (CER 16: 0) и стеариновая (CER 18: 0), являются основными молекулами, участвующими в инсулинорезистентности и стеатозе печени [49].
Заключение
Для нормального функционирования клеток необходим их стабильный биохимический состав. 50 % сфингомиелина и его производных представлен во внешнем листке билипидного слоя цитоплазматической мембраны. Физиологический уровень церамидов и других сфинголипидов в мембране необходим для передачи сигнала и контроля метаболизма глюкозы. Количественный и качественный сдвиг в сторону накопления церамидов является предиктором развития инсулинорезистентности. Результаты экспериментов на животных показали позитивную корреляцию церамидов при усиленной экспрессии церамидсинтазы-6, что подтверждает их ключевую роль в патогенезе развития инсулинорезистентности. Многочисленные анализы клинических данных пациентов с алиментарным ожирением и сахарным диабетом 2 типа показали повышенные концентрации Cer- C16:0, С18:0, C20:0, С22:0, C24:1. Учитывая молекулярный механизм развития инсулинорезистентности и липид-индуцированного воспаления, церамиды или комбинации их панелей в плазме могут служить биомаркерами для выявления лиц, подверженных риску развития сахарного диабета 2 типа, и потенциальными мишенями для коррекции инсулинорезистентности и системного воспаления.
Библиографическая ссылка
Самойлова Ю.Г., Кузьменко Д.И., Олейник О.А., Баширов С.Р., Денисов Н.С., Криницкий Д.В., Баширова А.С., Фимушкина Н.Ю. ПАТОГЕНЕЗ ИНСУЛИНОРЕЗИСТЕНТНОСТИ: КЛИНИЧЕСКАЯ РОЛЬ ЦЕРАМИДОВ С РАЗЛИЧНОЙ ДЛИНОЙ АЦИЛЬНОЙ ЦЕПИ // Современные проблемы науки и образования. 2021. № 6. ;URL: https://science-education.ru/ru/article/view?id=31396 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/spno.31396



