Системные заболевания соединительной ткани объединяют группу патологий, в основе развития которых лежит иммуноопосредованный системный воспалительный процесс. Яркими по своим клиническим проявлениям представителями данной группы болезней являются системная красная волчанка (СКВ) и системная склеродермия (ССД). Оба заболевания сопровождаются полиорганностью поражений и вариабельной клинической симптоматикой. СКВ относится к аутоиммунным ревматическим заболеваниям неизвестной этиологии, характеризуется гиперпродукцией органонеспецифических аутоантител к различным компонентам клеточного ядра, развитием иммуновоспалительного повреждения тканей и внутренних органов. Для ССД характерны иммунные нарушения и вазоспастические сосудистые реакции по типу феномена Рейно, сопровождающиеся активацией фиброзообразования и избыточным отложением компонентов внеклеточного матрикса (коллагена) в тканях и органах [1].
Будучи представителями системных заболеваний соединительной ткани, СКВ и ССД имеют сходство некоторых клинических проявлений, что в ряде случаев, особенно на ранних стадиях развития патологического процесса, определяет сложности их дифференциальной диагностики. При этом оба заболевания сопровождаются глубокими иммунологическими нарушениями, имеющими наряду с общими характерные отличительные черты [2, 3]. Согласно современным представлениям, системность поражений формируется под воздействием как иммунопатологических механизмов, так и метаболических нарушений, развивающихся на клеточном и субклеточном уровнях [4, 5]. В работе представлены данные, подтверждающие роль активных форм кислорода и окислительного стресса, нарушений обмена пуриновых нуклеотидов в патогенезе СКВ и ССД [4-7].
Одним из активных участников эндогенного синтеза активных форм кислорода является ксантиноксидоредуктаза (КОР), катализирующая окислительное гидроксилирование гипоксантина в ксантин и ксантина в мочевую кислоту. Благодаря особенностям строения и возможности существования в четырех формах фермент реализует дегидрогеназную, оксидазную, НАДН-оксидазную, нитратредуктазную активность. В результате катализируемых КОР реакций, помимо активных форм кислорода, образуются оксид азота, активные формы азота, которые наряду с важным физиологическим значением обусловливают развитие многих патофизиологических реакций, в том числе воспаления, окислительного стресса. Учитывая недостаточную изученность вопроса, интерес представляет анализ изменений активности взаимопревращающихся форм КОР (ксантиноксидазы (КО; EC 1.17.3.2) и ксантиндегидрогеназы (КДГ; EC 1.17.1.4)) в плазме и форменных элементах крови больных СКВ и ССД.
Цель исследования: получение представлений об особенностях профилей активности ксантиноксидазы и ксантиндегидрогеназы крови при СКВ и ССД.
Материал и методы исследования. В исследование были включены 56 больных СКВ, 51 больной ССД и 35 практически здоровых людей, составивших контрольную группу (табл. 1).
Таблица 1
Демографическая характеристика включенных в исследование лиц
|
Показатели |
СКВ (n=56) |
ССД (n=51) |
Здоровые лица (n=35) |
|
Пол, n (%): мужской женский |
5 (8,9) 51 (91,1) |
4 (7,8) 47 (92,2) |
19 (54,3) 16 (45,7) |
|
Средний возраст (лет), Me (Q25; Q75) |
35 (31; 42) |
43 (38; 48) |
39 (34; 46) |
Диагноз СКВ верифицирован в соответствии с критериями SLICC (2012) [1]. Длительность болезни составила 8 (5; 11), активность заболевания по индексу SLEDAI-2К [1] – 9 (5;11), SLICC/ACR Damage Index [1] – 2 (1; 3). Диагноз ССД был установлен на основании критериев ACR/EULAR (2013) [1]. Продолжительность болезни составила 8 (6; 9). У 34 (66,7%) больных выявлена лимитированная форма заболевания, у 17 (33,3%) – диффузная [1]. В соответствии с отечественными клиническими рекомендациями [1] низкая активность ССД диагностирована в 14 (27,5%), умеренная активность – в 28 (54,9%), высокая – в 9 (17,6%) случаях.
Активность ксантиноксидазы и ксантиндегидрогеназы определяли в плазме крови, лизатах лимфоцитов и эритроцитов. Клетки крови выделяли по методике А. Böyum [8] в градиенте плотности 1,077–1,079 г/мл, создаваемом с помощью препарата Lymphosep (MP Biomedicals LLC). Лизаты готовились путем трехкратного замораживания-оттаивания с последующим центрифугированием. Активность ферментов определяли спектрофотометрическим методом и выражали в нмоль/мин/мл [9].
Статистическая обработка полученных данных выполнена с помощью программы STATISTICA 6. Результаты представлены в виде медианы и интерквартильного размаха (Ме (Q25; Q75)). Для оценки различий количественных данных использоваликритерий Манна–Уитни. Значимость различий подтверждалась при р<0,05.
Исследование проведено в соответствии с общепринятыми этическими принципами и нормами на базе ревматологического отделения ГУЗ «ГКБСМП № 25» г. Волгограда.
Результаты исследования и их обсуждение. Включенные в исследование показатели ферментативной активности не зависели от пола и возраста здоровых лиц. В связи с этим данные факторы не учитывались при оценке результатов в группах больных СКВ и ССД. Референтные интервалы активности КО и КДГ в плазме и форменных элементах крови представлены в таблице 2.
Таблица 2
Интервалы активности ферментов в группе здоровых лиц (95-процентильный интервал)
|
Фермент |
Плазма |
Лизаты лимфоцитов |
Лизаты эритроцитов |
|
КО |
2,29–4,31 |
14,11–31,33 |
20,62–25,46 |
|
КДГ |
4,52–5,97 |
18,62–39,65 |
41,89–55,04 |
Согласно полученным данным, во всех сравниваемых группах активность обеих форм КОР имела более высокие значения в лизатах лимфоцитов и эритроцитов (табл. 3). При этом у здоровых лиц активность дегидрогеназной формы превалировала во всех средах.
Таблица 3
Активность ферментов при системной красной волчанке и системной склеродермии
|
|
Плазма |
Лизаты лимфоцитов |
Лизаты эритроцитов |
|||
|
КО |
КДГ |
КО |
КДГ |
КО |
КДГ |
|
|
Здоровые, n=35 |
3,28 (3,05; 3,38)1,2 |
5,30 (4,83; 5,41)4,5 |
20,94 (18,68; 22,67)7,8 |
29,76 (26,56; 33,70)10,11 |
23,51 (22,35; 24,57)13,14 |
50,13 (47,52; 52,11)16,17 |
|
СКВ, n=56 |
5,35 (4,37; 5,89)1,3 |
4,51 (4,24; 5,29)4,6 |
13,29 (12,22; 15,03)7,9 |
13,81 (12,55; 19,62)10,12 |
23,85 (20,97; 26,46)13,15 |
44,54 (38,72; 50,01)16,18 |
|
ССД, n=51 |
3,85 (3,37; 4,41)2,3 |
7,03 (6,43; 7,69)5,6 |
13,52 (11,25; 15,34)8,9 |
20,65 (18,74; 24,16)11,12 |
26,59 (23,29; 31,21)14,15 |
11,07 (9,66; 14,34)17,18 |
|
|
p1<0,001 p2<0,001 p3<0,001 |
p4<0,001 p5<0,001 p6<0,001 |
p7<0,001 p8<0,001 p9=0,600 |
p10<0,001 p11<0,001 p12<0,001 |
p13=0,977 p14<0,001 p15<0,001 |
p16<0,001 p17<0,001 p18<0,001 |
Примечание: р1, р4, р7, р10, р13, р16 – уровень значимости различий между показателями больных СКВ и здоровых лиц; р2, р5, р8, р11, р14, р17 – уровень значимости различий между показателями больных ССД и здоровых лиц; р3, р6, р9, р12, р15, р18 – уровень значимости различий между показателями больных СКВ и ССД.
В группе больных СКВ, в отличие от контрольной группы, в плазме крови наблюдалась более высокая активность КО на фоне сниженной активности КДГ, в лизатах лимфоцитов была снижена активность обеих форм КОР, лизаты эритроцитов характеризовались снижением активности КДГ.
По сравнению с контролем в плазме крови при ССД отмечался рост активности КО и КДГ, в лизатах лимфоцитов – снижение активности обоих ферментов, в лизатах эритроцитов – повышение активности КО на фоне снижения активности КДГ.
Обращает внимание, что как при СКВ, так и при ССД активность КО в плазме крови была повышена, в лизатах лимфоцитов – снижена; активность КДГ – снижена в лизатах лимфоцитов и эритроцитов. В отличие от СКВ, сопровождавшейся низкими показателями активности КДГ плазмы крови, для ССД было характерно повышение активности фермента в данной среде. Также при ССД был выявлен рост активности КО в лизатах эритроцитов, в то время как при СКВ значения этого показателя не отличались от группы здоровых лиц.
Выявленные в результате нашей работы изменения активности ферментной системы КОР формируют характерные для включенных в исследование нозологий профили крови, отражающие баланс оксидазной и дегидрогеназной активностей, что может способствовать уточнению некоторых метаболических звеньев патогенеза СКВ и ССД (рисунок).
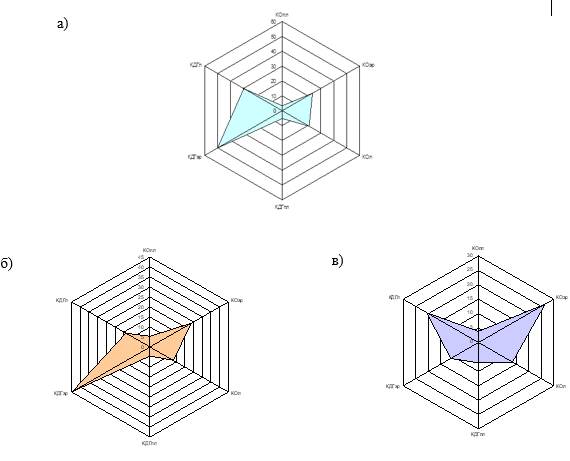
Профили активности КОР крови: а) здоровые лица; б) больные СКВ; в) больные ССД.
КОпл – активность КО в плазме крови; КОэр – активность КО в лизатах эритроцитов; КОл – активность КО в лизатах лимфоцитов; КДГпл – активность КДГ в плазме крови; КДГэр – активность КДГ в лизатах эритроцитов; КДГл – активность КДГ в лизатах лимфоцитов
Плазма крови является интегральной средой, отражающей в целом особенности происходящих в организме изменений метаболического уровня. Полученные при СКВ и ССД данные свидетельствуют о повышении активности оксидазной формы КОР, катализирующей реакции, сопровождающиеся образованием супероксидных радикалов, а также активности КДГ при ССД. Эти сдвиги могут быть обусловлены возрастанием под действием провоспалительных цитокинов экспрессии КОР и/или фосфорилированием молекулы фермента. К значительному росту активности КО на фоне снижения активности КДГ в группе больных СКВ, в том числе, может приводить трансформация дегидрогеназной формы в оксидазную, которая происходит за счет образования дисульфидных связей между остатками цистеина (Cys535 и Cys992) и/или ограниченного протеолиза между FAD и Mo-Co центрами [10].
Характерное для СКВ осаждение депозитов иммунных комплексов в стенках сосудов микроциркуляторного русла различных органов обусловливает развитие выраженного воспаления, создавая в тканях условия низкого рН, а при возникновении тромбозов – и гипоксии. Прогрессирующий генерализованный фиброз, поражение сосудов по типу облитерирующего эндартериолита, распространенный вазоспазм, тромбозы провоцируют при ССД гипоксию тканей. Известно, что в таких условиях КОР может реализовать NADH-оксидазную активность (преимущественно за счет дегидрогеназной формы), продуцируя супероксид и перекись водорода [11]. Помимо этого, в условиях гипоксии и кислотного рН уменьшается образование оксида азота под действием NO-синтазы и возрастает продукция супероксид-аниона; на фоне уменьшения сродства к ксантину увеличивается сродство КОР к нитритам и нитратам, что позволяет реализоваться нитратредуктазной активности фермента с образованием супероксида и оксида азота. При взаимодействии этих веществ генерируются активные формы азота, особенно высокореакционный пероксинитрит [11]. В то же время синтезируемый оксид азота в определенных концентрациях поддерживает адаптивный ответ, оказывая вазодилатирующее действие, ингибируя активность протеаз, участвующих в процессах апоптоза [12].
Образующиеся в результате интенсификации процессов свободно-радикального окисления активные формы кислорода и азота оказывают повреждающее действие на клеточные структуры, инициируют процессы перекисного окисления липидов, участвуют в стимуляции NF-kB, контролирующего экспрессию генов, вовлеченных в процессы клеточной пролиферации, апоптоз, аутоиммунные и воспалительные реакции, способствуют образованию внеклеточных ловушек нейтрофилов (NET-Neutrophil Extracellular Trap) [12, 13]. Процесс образования NET называется NETоз и представляет собой вид программируемой гибели нейтрофилов. Высказывается гипотеза о ключевой роли NETоза в индукции аутоиммунитета и развитии поражения органов при СКВ, представлены данные об его активации при ССД [2].
Наблюдавшиеся в лизатах лимфоцитов больных СКВ и ССД однонаправленные изменения в виде снижения активности КО и КДГ в целом имеют позитивную направленность, поскольку в их результате происходит сокращение выработки активных форм кислорода, обладающих прооксидантной и провоспалительной активностью. Однако нарушения обмена пуриновых метаболитов на предыдущих этапах способствуют изменению функциональных возможностей лимфоцитов. При этом как высокие, так и низкие концентрации аденозина и гуанозина могут вызывать замедление биосинтеза РНК, ДНК в этих форменных элементах, тормозить их созревание, пролиферацию, подавлять супрессорную функцию, оказывать цитотоксический эффект, приводя к гибели или усиленному апоптозу [5].
Анемия является одним из характерных проявлений СКВ. У пациентов с СКВ встречаются анемия хронического заболевания, железодефицитная анемия, аутоиммунная гемолитическая анемия, β-талассемия, циклофосфамид-индуцированная миелотоксичность, анемия, обусловленная хронической почечной недостаточностью, пернициозная анемия, тромботическая тромбоцитопеническая пурпура, истинная апластическая анемия, различающиеся механизмами развития и требующие дифференциальной диагностики с гематологическими заболеваниями [14]. При ССД, особенно в случае длительного течения болезни, также могут выявляться анемия хронического заболевания, гемолитическая и пернициозная анемия [1]. В настоящем исследовании не ставился целью анализ энзимных показателей в зависимости от этой категории синдромов. В то же время следует отметить, что в эритроцитах больных как при СКВ, так и при ССД активность оксидазной формы КОР превалировала. При склеродермическом процессе изменения были более выражены. Учитывая данные литературы [15], можно предположить, что при системных заболеваниях соединительной ткани КОР реализует в эритроцитах нитритредуктазную активность, образуя свободные радикалы, которые могут оказывать влияние на продолжительность жизни этих форменных элементов.
Заключение. Таким образом, при СКВ и ССД в плазме крови, лизатах лимфоцитов и эритроцитов были выявлены изменения активности оксидазной и дегидрогеназной форм КОР, определяющие особенности профилей крови. Универсальность ряда иммунных и метаболических процессов, лежащих в основе защитных реакций организма, а также патологических каскадов, определяет некоторую общность патогенетических механизмов, формирующих системность поражений при диффузных болезнях соединительной ткани. Наряду с этим изменения баланса ферментативных активностей в системе КОР могут оказывать влияние на обмен пуриновых нуклеотидов, пул активных форм кислорода и азота в тканях организма, участвуя в присущих той или иной нозологии процессах.
Библиографическая ссылка
Мозговая Е.Э., Бедина С.А., Трофименко А.С., Спицина С.С., Мамус М.А., Зборовская И.А. АКТИВНОСТЬ КСАНТИНОКСИДОРЕДУКТАЗЫ: ОСОБЕННОСТИ ПРОФИЛЯ КРОВИ ПРИ СИСТЕМНЫХ ЗАБОЛЕВАНИЯХ СОЕДИНИТЕЛЬНОЙ ТКАНИ // Современные проблемы науки и образования. 2022. № 1. ;URL: https://science-education.ru/ru/article/view?id=31351 (дата обращения: 08.02.2026).
DOI: https://doi.org/10.17513/spno.31351



