Хотя рак вульвы и считается довольно редкой опухолью, его эффективное лечение составляет проблему для онкогинекологов в связи как с пожилым возрастом многих больных, так и со слабой чувствительностью опухоли к химиолучевой терапии [1]. При рассмотрении причин развития и прогрессирования заболевания в фокусе внимания авторов обычно оказываются инфицирование ВПЧ, способствующее развитию такого предракового заболевания, как ВИН, и генетические изменения, например TP53-мутации [2, 3]. В настоящее время интенсивно исследуется роль опухолевых стволовых клеток (ОСК) в прогрессии различных опухолей, формировании их химио- и радиорезистентности. ОСК выявлены при многих злокачественных новообразованиях, включая рак яичников, колоректальный рак, рак поджелудочной железы, меланому, рак легких, рак молочной железы [4, 5].
В настоящее время существуют три основные теории биологического происхождения ОСК: 1) из стволовых клеток, приобретающих мутации, необходимые для развития злокачественного фенотипа; 2) из клеток-предшественников, обладающих частичной способностью к самообновлению с высокой вероятностью онкогенной трансформации; 3) из дифференцированных клеток путем дедифференцировки. При этом в клетках активируются сигнальные пути TGF-β, Wnt, Hedgehog (Hh), β-катенин, Notch, NFκB и STAT3 и происходит изменение их фенотипа.
Фенотипический маркер ОСК CD133 является мембраносвязанным гликопротеином и участвует в процессах дифференцировки и эпителиально-мезенхимального перехода (ЭМП), в пролиферации клеток через Wnt-сигнальный путь и связан с неблагоприятным прогнозом при КРР, глиобластоме, гепатоцеллюлярной карциноме и ряде других опухолей [4]. Еще одним маркером ОСК считается альдегиддегидрогеназа 1 (ALDH1), которая индуцирует ЭМП в опухолевых клетках, что способствует их проникновению через базальную мембрану в лимфатическую и кровеносную системы, а следовательно, метастазированию. В литературе приводятся сведения об экспрессии этого маркера, в частности при плоскоклеточных раках: орофарингеальном [6] и раке пищевода [7]. Совместное изучение экспрессии СD133 и ALDH1 проводилось при раке молочной железы [8], легкого, меланоме, колоректальном раке, раке поджелудочной железы, шейки матки, при этом отмечены их параллельные изменения в зависимости от химиорезистентности или чувствительности, инвазии, метастазирования опухоли, выживаемости больных [9, 10]. Подобные исследования при раке вульвы немногочисленны и противоречивы [6, 11].
Цель исследования: оценить экспрессию маркеров ОСК СD133 и ALDH1 при первичном раке вульвы с различными стадиями и глубиной инвазии опухоли, а также при рецидивном раке вульвы.
Материалы и методы исследования. Для исследования был взят операционный материал 56 больных раком вульвы I–II стадий и с рецидивами, находившихся на лечении в ФГБУ «Национальный медицинский исследовательский центр онкологии» МЗ РФ. Возраст больных составлял от 29 до 84 лет, в среднем 52 года. У 20 больных диагностирована I стадия заболевания, у 26 больных – II стадия, 10 имели рецидивы. Кроме того, больные были распределены по глубине инвазии опухоли: 0–4 мм – 20 больных, 4,1–8 мм – 20 больных, выше 8 мм – 16 больных. Иммуногистохимическое (ИГХ) исследование проводили на срезах с парафиновых блоков первичной опухоли, предназначенных для стандартного морфологического исследования. Для ИГХ-исследования применяли протокол, опубликованный ранее [12]. Использовали моноклональные мышиные антитела к ALDH1 (клон B-5, Santa Cruz Biotechnology) в разведении 1:1800 и поликлональные кроличьи антитела к СD133 (клон AF5120, Affinity Biosciences) в разведении 1:400. Депарафинизацию и дегидратацию парафиновых срезов выполняли по стандартной методике. «Демаскировку» антигенов проводили в PT-Link Thermo согласно протоколу; окрашивали в автоматическом режиме на иммуноавтостейнере Thermo Scientific 480S. Визуализацию иммуногистохимической реакции выполняли с использованием системы детекции UltraVision Quanto Detection System HRP (Thermo Fisher Scientific, Великобритания), срезы докрашивали гематоксилином Карацци. Оценивали процентное содержание и интенсивность окрашивания: 0, 1+ слабое, 2+ умеренное, 3+ сильное. Экспрессию белков ALDH1 и СD133 определяли как положительную, когда окрашивание было выявлено в более 10% (cut-off) опухолевых клеток с интенсивностью 2+ и 3+. Результаты иммуногистохимической реакции оценивали с применением светового микроскопа «AxioLab.A1» (Германия) при увеличении объектива х200, x400. Статистическую обработку полученных результатов проводили с использованием пакета прикладных программ Statistica 13,0 (StatSoftInc., США). Для оценки нормальности распределения использовали W-критерий Шапиро–Уилка. Сравнение групп проводили с помощью непараметрического критерия Манна–Уитни (U-критерий). Статистически значимыми считали различия при уровне статистической значимости р<0,05.
Результаты исследования и их обсуждение. Полученные результаты представлены в таблицах 1–4 и на рисунках 1, 2. В результате проведенного ИГХ-исследования первичной опухолевой ткани вульвы было выявлено, что максимальное количество клеток, окрашенных маркером ALDH1 (40%), встречалось у пациентов с II стадией заболевания, минимальное (1%) – у рецидивных больных. Примеры положительной экспрессии с разной интенсивностью окраски и ее отсутствием показаны на рисунке 1.
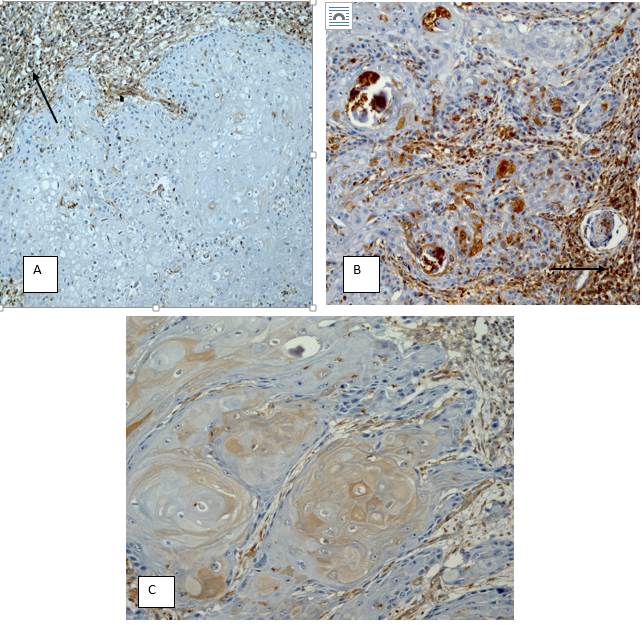
|
|
|
Рис. 1. Экспрессия ALDH1 в опухолевых клетках. А – отсутствие экспрессии в опухолевых клетках. x200. В – высокая степень интенсивности окрашивания – 3+. х200. Стрелкой отмечены клетки стромы с положительной экспрессией маркера. С – низкая степень интенсивности окрашивания – 1+. x200
Разброс количества окрашенных клеток в опухоли у больных с I стадией был незначительным (от 15% до 25%); у больных с II стадией встречались как минимальные (5%), так и максимальные (40%) значения, в большинстве случаев составляя 15–18%; у рецидивных больных также наблюдались низкие и высокие значения экспрессии ALDH1, в большинстве случаев 10–13% (табл. 1).
Таблица 1
Уровень экспрессии ALDH1 в опухолях больных с различной стадией первичных опухолей и с рецидивами
|
Уровень экспрессии % |
Группы больных |
|||||
|
I стадия (n=20) |
II стадия (n=26) |
Рецидивы (n=10) |
||||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
Me |
Q1–Q3 |
|
|
ALDH1 |
20 |
10–30 |
15 |
5–40 |
11,5 |
1–30 |
|
р |
p=0,189 |
|
||||
|
|
p=0,133 |
|||||
|
*p=0,023 |
||||||
Примечание: * – отличия показателей статистически значимы между группами больных с I стадией и с рецидивами (р<0,05).
Преобладание у больных с I стадией положительно окрашенных опухолевых клеток антителами к ALDH1 было статистически значимо выше по сравнению с рецидивными больными (в 1,7 раза; p=0,023). Между пациентками с I и II стадиями, со II стадией и рецидивами отличия оказались небольшими (в 1,3 раза) и статистически не значимыми (p>0,05).
При сопоставлении опухолей с различной глубиной инвазии преобладание в опухолях ALDH1+ клеток наблюдалось при ее минимальном значении (от 0 до 4 мм) по сравнению с более глубокой инвазией (табл. 2).
Таблица 2
Уровень экспрессии ALDH1 в опухолях больных с различной глубиной инвазии
|
Уровень экспрессии % |
Глубина инвазии |
|||||
|
0–4 мм (n=20) |
4,1–8 мм (n=20) |
>8 мм (n=16) |
||||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
Me |
Q1–Q3 |
|
|
ALDH1 |
20 |
13–30 |
10 |
1–20 |
15 |
10–40 |
|
р |
*p=0,003 |
|
||||
|
|
p=0,460 |
|||||
|
p=0,200 |
||||||
Примечание: * – отличия показателей статистически значимы между группами больных с глубиной инвазии 0–4 мм и 4,1–8 мм (р<0,05).
Так, выявлено статистически значимое превышение в 2 раза (p=0,003) содержания ALDH1+ клеток в опухолях больных с глубиной инвазии от 0 до 4 мм по сравнению с больными, имеющими глубину инвазии от 4,1 до 8 мм. При сравнении групп больных, имеющих опухоли с другими параметрами глубины инвазии, статистически значимых различий обнаружить не удалось (p>0,05). Таким образом, нами была выявлена более высокая экспрессия ALDH1 в опухолевых клетках больных с минимально выраженным процессом.
В результате проведенного ИГХ-окрашивания антителами к CD133 максимальное количество опухолевых клеток (до 80%) было отмечено в рецидивных опухолях, минимальное (25%) – в первичных опухолях II стадии. Примеры положительной экспрессии с разной интенсивностью окраски показаны на рисунке 2.
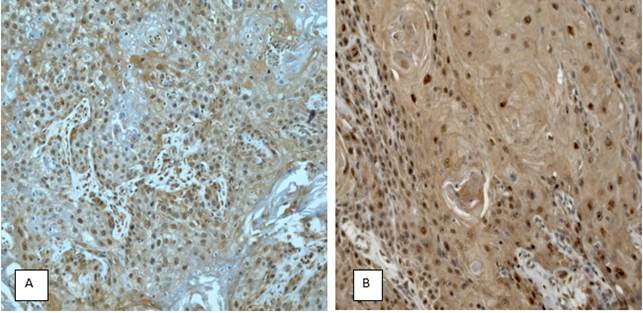
Рис. 2. Экспрессия CD 133 в опухолевых клетках. А – умеренная степень интенсивности окрашивания – 2+. х200. В –высокая степень интенсивности окрашивания – 3+. х200
Разброс количества окрашенных клеток в опухоли у больных с I стадией был небольшим (40–45%); у больных с II стадией, как и при окрашивании антителами к ALDH1, встречались как низкие (25%), так и высокие (до 75%) значения, в большинстве случаев составляя 45–60%; в рецидивных опухолях наблюдалось достаточно однородное распределение клеток, но с высокими значениями (65–80%) (табл. 3).
Таблица 3
Уровень экспрессии CD133 в опухолях больных с различной стадией первичных опухолей и с рецидивами
|
Уровень экспрессии % |
Группы больных |
|||||
|
I стадия (n=20) |
II стадия (n=26) |
Рецидивы (n=10) |
||||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
Me |
Q1–Q3 |
|
|
CD133 |
45 |
35–60 |
60 |
25–70 |
72,5 |
55–80 |
|
р |
p=0,126 |
|
||||
|
|
**p=0,042 |
|||||
|
*p=0,012 |
||||||
Примечание: * – отличия показателей статистически значимы между группами больных с I стадией и с рецидивами (р<0,05), ** – отличия показателей статистически значимы между группами больных с II стадией и с рецидивами (р<0,05) .
Выявлено статистически значимое преобладание экспрессии CD133 в опухолях у рецидивных больных: в 1,6 раза (p=0,012) по сравнению с больными, имеющими первичные опухоли I стадии, и в 1,2 раза (p=0,042) по сравнению с больными с II стадией, тогда как между опухолями пациенток с I и II стадиями различия оказались статистически не значимы (p=0,126).
При сравнении экспрессии CD133 в опухолях больных с разной глубиной инвазии отмечена тенденция к повышению количества опухолевых клеток, окрашенных антителами к CD133, по мере ее нарастания (табл. 4).
Таблица 4
Уровень экспрессии CD133 в опухолях больных с различной глубиной инвазии
|
Уровень экспрессии % |
Глубина инвазии |
|||||
|
0–4 мм (n=20) |
4,1–8 мм (n=20) |
>8 мм (n=16) |
||||
|
Me |
Q1–Q3 |
Me |
Q1–Q3 |
Me |
Q1–Q3 |
|
|
CD133 |
47,5 |
25–65 |
65 |
45–65 |
65 |
45–80 |
|
р |
*p=0,015 |
|
||||
|
|
p=1,00 |
|||||
|
**p=0,004 |
||||||
Примечание: * – отличия показателей статистически значимы между группами больных с глубиной инвазии 0–4 мм и 4,1–8 мм (р<0,05), ** – отличия показателей статистически значимы между группами больных с глубиной инвазии 0–4 мм и >8 мм (р<0,05).
Как видно из таблицы 4, выявлено статистически значимое преобладание в 1,4 раза (p=0,015) количества CD133+ клеток в опухолях больных с глубиной инвазии от 4,1 до 8 мм и в 1,4 раза (p=0,004) с глубиной инвазии более 8 мм по сравнению с больными, имеющими опухоли с минимальной инвазией (0–4 мм). Между опухолями пациенток с глубиной инвазии от 4,1 до 8 мм и более 8 мм статистически значимых различий обнаружить не удалось (p=1,00).
Таким образом, маркер CD133 проявил классические свойства маркера ОСК, тогда как значение ALDH1 в качестве такого маркера остается неопределенным. В литературе высказывается предположение о том, что разноречивость значения ALDH1 может быть связана как с особенностями самих опухолей, так и с разными методическими подходами к их исследованию [13]. В том же обзоре, опубликованном в 2020 г., где суммированы многочисленные данные о роли ALDH1 при гинекологических раках, сообщается о единственном исследовании по изучению роли ALDH1 при раке вульвы. Эта работа опубликована в 2014 г. и характеризует ALDH1 как фактор положительного прогноза рака вульвы; по данным авторов, полученных на 154 больных, его экспрессия ассоциируется с более высокой выживаемостью [14], в отличие от ряда других раков, при которых этот маркер описывается как прогностически негативный. При этом, в отличие от полученных нами данных, авторами не было установлено статистически значимых различий между экспрессией ALDH1 и стадией, глубиной инвазии, степенью дифференцировки опухоли, ее инвазией в сосуды и другими клинико-патологическими характеристиками больных, кроме выживаемости больных, которая была выше при исходно высокой экспрессии ALDH1. Разноречивые данные о прогностической значимости ALDH1 в качестве маркера ОСК, а также то, что его экспрессия связана и с другими клетками (стромальными, неопухолевыми стволовыми и др.), требует дальнейших исследований и дифференцированного подхода к оценке его значимости при различных опухолях. В частности, при раке вульвы его экспрессия играет скорее позитивную прогностическую роль, в отличие от негативной роли СD133, как описанной в литературе, так и полученной нами. В работе Ch. Napoletano и соавт. отмечена корреляция экспрессии маркера CD133 с молодым возрастом больных раком вульвы на момент постановки диагноза, с метастазированием опухоли в лимфатические узлы, с большим размером опухоли, а также с высокой инфильтрацией FOXP3+ T-клетками (Т-regs); при этом не установлено взаимосвязи уровня CD133+ клеток с общей и бессобытийной выживаемостью больных, тогда как нами выявлено нарастание экспрессии CD133 при рецидивных опухолях и опухолях с глубокой инвазией, что может служить прогностическим фактором [11].
Заключение. На материале опухолей больных первичным с различной стадией и глубиной инвазии, а также рецидивным раком вульвы показан ряд различий экспрессии ALDH1 и СD133. Эти различия носили разнонаправленный характер: если ALDH1 был лучше экспрессирован при более низкой инвазии и опухолях I стадии по сравнению с рецидивными, то экспрессия СD133 была выше при более распространенных и агрессивных опухолях, т.е. первичных с более глубокой инвазией, а также при рецидивных. Оба исследованных маркера, по-видимому, могут служить факторами прогноза: СD133 – негативного, ALDH1 – положительного, однако принадлежность последнего к ОСК при раке вульвы остается под вопросом.
Библиографическая ссылка
Вереникина Е.В., Абдулаева Н.М., Златник Е.Ю., Ульянова Е.П., Быкадорова О.В., Лысенко И.Б., Максимова Н.А. ЭКСПРЕССИЯ МАРКЕРОВ ОПУХОЛЕВЫХ СТВОЛОВЫХ КЛЕТОК ПРИ ПЕРВИЧНОМ С РАЗЛИЧНОЙ СТАДИЕЙ И ГЛУБИНОЙ ИНВАЗИИ И РЕЦИДИВНОМ РАКЕ ВУЛЬВЫ // Современные проблемы науки и образования. 2021. № 6. ;URL: https://science-education.ru/ru/article/view?id=31279 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/spno.31279



