Ишемический инсульт является второй неинфекционной патологией с высокой степенью летальности и риском первичной инвалидизации трудоспособного населения. На сегодняшний день в острой фазе инсульта погибают около 6 млн человек и по разным подсчетам около 60 млн человек приобретают инвалидность с социальной и трудовой дезадаптацией. Около 80% инсультов носят ишемический характер и возникают вследствие окклюзии мозговых артерий тромбом/эмболом с развитием каскада патогенетических событий, приводящих к формированию некротического очага ‑ зоны «ишемической тени» [1]. Известны две основные стратегии лечения инсульта: тромболитическая терапия и нейропротекция. Причем, несмотря на то, что общепризнанным методом с высокой степенью доказанности является внутривенный тромболизис, нейропротективная терапия вызывает все больший как научный, так и практический интерес [2]. В связи с этим возникает вопрос выбора релевантной экспериментальной модели ишемического инсульта. За последние четыре десятилетия было разработано множество моделей инсульта, главными целями создания которых являлись выявление механизмов, лежащих в основе церебральной ишемии, и разработка новых лекарственных средств для лечения инсульта [3]. Экспериментальные модели ишемии мозга, где используются лабораторные животные, являются незаменимым исследовательским инструментом по нескольким причинам: ишемический инсульт у человека чрезвычайно разнообразен по своим проявлениям, причинам и анатомической локализации, тогда как экспериментальный ишемический инсульт хорошо воспроизводится, хорошо контролируется и стандартизирован, что позволяет проводить более точный анализ патофизиологических особенностей заболевания и эффективности применения тестируемых веществ; молекулярные, генетические, биохимические и физиологические исследования часто требуют инвазивного прямого доступа к ткани мозга; патофизиологические события, происходящие в течение первой минуты ишемического инсульта, чаще всего не могут быть обнаружены методами визуализации (КТ, МРТ), используемыми в клинической практике; перфузия и сосудистая сеть (например, коллатерали) не могут быть смоделированы в моделях in vitro [4]. Трансляционный успех доклинических исследований, направленных на разработку новых терапевтических средств, особенно нейропротекторного действия, может зависеть, по крайней мере, частично от выбора подходящей экспериментальной модели ишемического инсульта [5].
Цель исследования: провести сравнительную оценку экспериментальных моделей перманентной фокальной ишемии головного мозга.
Материалы и методы исследования. Работа выполнена на 40 половозрелых крысах-самцах линии Wistar с массой тела 210±10 г, полученных из лаборатории живых систем Пятигорского медико-фармацевтического института. Во время исследования крысы содержались в контролируемых условиях при соблюдении следующего режима: температура окружающего воздуха 18‑22°С, относительная влажность воздуха 55‑65%, суточный цикл ‑ 12 ч день/12 ч ночь. Манипуляции и содержание животных соответствовали международным этическим нормам работы с лабораторными животными [6]. Перманентную фокальную ишемию мозга воспроизводили прекращением тока крови в бассейне средней мозговой артерии, используя три методологических подхода: окклюзию раствором тромбина, перевязку средней мозговой артерии и коагуляцию средней мозговой артерии. Операционные процедуры выполнены под хлоралгидратной анестезией (хлоралгидрат (Panreac), 350 мг/кг, внутрибрюшинно): участок ниже и правее глаза депилировали, делали надрез, отпрепарировали мягкие ткани, обнажая отросток скуловой кости. Далее проделывали трепанационное отверстие над местом пересечения средней мозговой артерии и обонятельного тракта. Затем на артерию (ниже места пересечения с обонятельным трактом) накладывали ватный тампон с 1%-ным раствором тромбина, либо под артерию подводили шелковую нить и перевязывали, либо артерию коагулировали электрокоагулятором [7]. Количество животных в каждой экспериментальной группе равнялось 10 особям. Сравнение анализируемых показателей осуществляли с группой ложнооперированных (ЛО) животных (n=10). Спустя 3 дня ишемического периода производили регистрацию следующих параметров: изменение неврологического дефицита по шкале McGraw (табл. 1) [8], изменение сенсомоторного дефицита, уровня мозгового кровотока и зоны некроза мозга.
Таблица 1
Неврологическая шкала McGraw
|
Параметр |
Балл |
|
Адинамия |
0,5 |
|
Тремор |
1 |
|
Полуптоз |
1 |
|
Полуптоз (двусторонний) |
1,5 |
|
Отсутствие рефлекса Пинны |
|
|
Птоз |
|
|
Птоз (двусторонний) |
|
|
Вялые движения |
2,0 |
|
Парез конечностей |
2‑5 |
|
Паралич конечностей |
3‑6 |
|
Кома |
7,0 |
|
Летальный исход |
10,0 |
Оценку сенсомоторного дефицита проводили с помощью теста «Beam Walking» (НПК «Открытая наука», Россия) [9].
Сенсомоторный дефицит рассчитывали по следующей формуле:
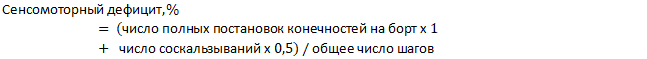
Изменение скорости мозгового кровотока (см/с) проводили в теменной области в бассейне средней мозговой артерии допплерографическим методом. В работе использованы ультразвуковой допплерограф УЗОП-010-01 с датчиком 25МГц и программный пакет ММ-Д-К-Minimax Doppler v.2.1 («Минимакс Допплер» (Санкт-Петербург, Россия)). Зону некроза мозга определяли трифенилтетразолиевым методом, для чего извлекали головной мозг, отделяли мозжечок и разделяли полушария, которые раздельно взвешивали. Полушария гомогенизировали и добавляли 1%-ный раствор трифенилтетразолия хлорида в объеме 10 мл. Пробы термостатировали 20 мин при температуре 37°С, после чего центрифугировали при 1500 g в течение 10 мин. Осадок ресуспендировали в смеси фосфатный буфер: хлороформ (1:1) и термостатировали в течение 15 мин при 4°С. Пробы центрифугировали в вышеуказанном режиме и измеряли оптическую плотность супернатанта против чистого хлороформа при λ=492 нм.
Статистическую обработку данных осуществляли с применением программного комплекса STATISTICA 6.0. Данные выражали в виде M±SEM (среднее ± стандартная ошибка среднего). Нормальность распределения данных проверяли с помощью критерия Шапиро‑Уилка, однородность дисперсий ‑ критерием Левена. Статистическую значимость различий оценивали методом однофакторного дисперсионного анализа с пост-тестом Ньюмена‑Кейлса. Статистически значимыми считали изменения при уровне вероятности p<0,05.
Результаты исследования и обсуждение. В ходе исследования было установлено, что неврологический дефицит у крыс спустя 72 ч ишемического периода при воспроизведении методологически различных вариантов ишемии изменялся неоднозначно. Так, при моделировании церебральной ишемии путем окклюзии средней мозговой артерии тромбином степень неврологического дефицита увеличилась в 4,8 раза (p<0,05) относительно ЛО крыс, в то время как на фоне воспроизведения ишемии мозга перевязкой и коагуляцией средней мозговой артерии данный показатель повысился в 3,1 раза (p<0,05) и 8,2 раза (p<0,05) соответственно (рис. 1). При этом коагуляция артерии вызвала более выраженные неврологические изменения, чем перевязка артерии и окклюзия тромбином, что выражалось в повышении степени неврологического дефицита у крыс, которым моделировали ишемию путем коагуляции артерии, по отношению к животным с тромбиноокклюзионной ишемией, в 1,7 раза (p<0,05) и ишемией мозга, вызванной перевязкой средней мозговой артерии, ‑ в 2,6 раза (p<0,05).
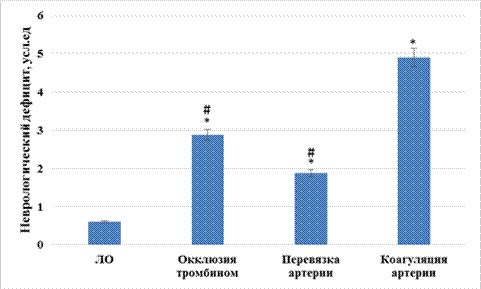

Рис. 1. Изменение неврологического дефицита при моделировании различных вариантов перманентной фокальной ишемии мозга
Примечание: * ‑ статистически значимо относительно ЛО крыс (p<0,05, критерий Ньюмена‑Кейлса); # ‑ статистически значимо относительно животных, которым ишемию мозга моделировали путем коагуляции средней мозговой артерии (p<0,05, критерий Ньюмена‑Кейлса).
При анализе изменения сенсомоторного дефицита было установлено, что у крыс, которым воспроизводили ишемию мозга окклюзией тромбином, данный показатель был выше аналогичного у ЛО крыс в 3,5 раза (p<0,05), а при моделировании ишемии путем коагуляции и перевязки средней мозговой артерии ‑ в 4,5 (p<0,05) и 3,3 раза (p<0,05) соответственно (рис. 2).
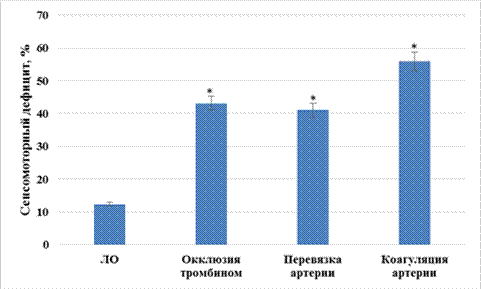

Рис. 2. Изменение сенсомоторного дефицита при моделировании различных вариантов перманентной фокальной ишемии мозга
Примечание: * ‑ статистически значимо относительно ЛО крыс (p<0,05, критерий Ньюмена‑Кейлса).
Скорость мозгового кровотока у ишемизированных крыс, которым моделировали церебральную ишемию путем окклюзии тромбином, перевязкой и коагуляцией средней мозговой артерии, была ниже таковой у ЛО крыс на 42,1% (p<0,05); 51,9% (p<0,05) и 63,3% (p<0,05) соответственно (рис. 3); при этом статистически значимых отличий между группами ишемизированных животных установлено не было.
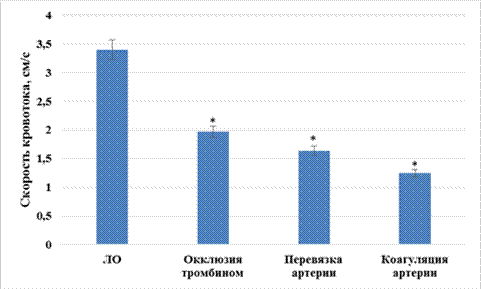

Рис. 3. Изменение скорости мозгового кровотока при моделировании различных вариантов перманентной фокальной ишемии мозга
Примечание: * ‑ статистически значимо относительно ЛО крыс (p<0,05, критерий Ньюмена‑Кейлса).
Анализ изменения зоны некротического очага головного мозга позволил установить, что при моделировании церебральной ишемии путем коагуляции средней мозговой артерии развивается обширная зона инфаркта, составляющая 33,4±2,9%, что на 55,1% (p<0,05) и 30,0% (p<0,05) было выше аналогичного показателя групп животных, которым ишемию мозга моделировали путем окклюзии тромбином и перевязкой артерии, соответственно (рис. 4).
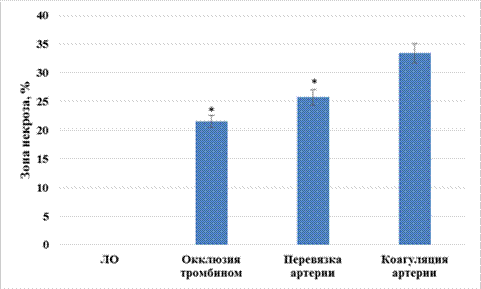

Рис. 4. Изменение зоны церебрального некроза при моделировании различных вариантов перманентной фокальной ишемии мозга
Примечание: * ‑ статистически значимо относительно животных, которым ишемию мозга моделировали путем коагуляции средней мозговой артерии (p<0,05, критерий Ньюмена‑Кейлса).
В последние десятилетия in vivo модели фокальной церебральной ишемии позволили установить особенности патогенеза мозгового инсульта, начиная от пороговых изменений уровня мозгового кровотока до особенностей формирования ишемической пенумбры. Кроме того, экспериментальные исследования ишемии мозга на лабораторных животных дали возможность понять сложные биохимические и молекулярные механизмы «ишемического каскада», которые запускают гибель клеток в первые минуты, часы и дни после инсульта. Были разработаны модели постоянной преходящей окклюзии средней мозговой артерии и эмболического инсульта, каждая из которых имеет свои преимущества и ограничения при попытке моделирования сложной гетерогенной природы инсульта у людей [10]. Благодаря обширному количеству исследований постоянно совершенствуются имеющиеся методы лечения инсульта и разрабатываются новые терапевтические стратегии, например нейропротекция. В настоящее время изучаются сотни потенциально эффективных нейропротекторов, имеющих, однако, низкий трансляционный успех. Не в последнюю очередь это может быть связано с выбором адекватной экспериментальной модели для доклинического изучения нейропротекторных средств. Согласно рекомендациям STAIR, первоначально данные вещества необходимо тестировать на моделях перманентной ишемии мозга, что делает актуальным их сравнительное изучение [11] и что послужило целью данной работы. Проведенное исследование показало, что окклюзия тромбином, перевязка и коагуляция средней мозговой артерии у крыс вызывают сопоставимые изменения сенсомоторного дефицита и скорости мозгового кровотока, в то время как величина некротического очага и изменение неврологического дефицита были более значимы при моделировании ишемии путем коагуляции артерии.
Заключение. На основании полученных результатов можно констатировать, что модель фокальной ишемии головного мозга, в основе которой лежит коагуляция средней мозговой артерии, по сравнению с тромбиноокклюзионной и моделью с лигированием артерии обеспечивает формирование более обширной зоны инфаркта мозга и развитие выраженных неврологических изменений при сопоставимых показателях сенсомоторного дефицита и скорости мозгового кровотока. В связи с этим можно считать, что модель фокальной ишемии головного мозга, реализуемая путем коагуляции средней мозговой артерии, наиболее полно подходит для тестирования фармакологически активных веществ, действие которых направлено на сохранение активности клеток ишемической полутени.
Библиографическая ссылка
Саркисян К.Х., Поздняков Д.И. СРАВНИТЕЛЬНОЕ ИЗУЧЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ МОДЕЛЕЙ ФОКАЛЬНОЙ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ // Современные проблемы науки и образования. 2021. № 5. ;URL: https://science-education.ru/ru/article/view?id=31124 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31124



