Рак легкого в Российской Федерации занимает третье место в общей структуре заболеваемости злокачественными новообразованиями (9,4%) и первое место в структуре заболеваемости злокачественными новообразованиями мужского населения (16,3%) [1].
У пациентов с распространенным немелкоклеточным раком легкого (НМРЛ) в 30-64% случаев развиваются метастазы в головной мозг, что сопровождается плохим прогнозом [2]. В то время как выживаемость людей с общим метастатическим НМРЛ составляет примерно 12 месяцев, выживаемость пациентов с метастазами в мозг, даже при условии проведения паллиативной терапии, колеблется от 2,4 до 4,8 месяца [3].
Лучевая терапия является, наряду с хирургическим лечением, основным методом лечения пациентов с метастатическим поражением головного мозга (МПГМ) [4]. Стереотаксическая радиохирургия (SRS) – эффективный метод лечения пациентов с метастатическим поражением головного мозга. Три десятилетия все более объемных научных исследований показали, что SRS улучшает результаты лечения и обладает меньшей токсичностью по сравнению с облучением всего головного мозга [5].
Традиционная цитотоксическая химиотерапия имеет ограниченную роль в лечении метастазов в головной мозг из-за присутствия гематоэнцефалического барьера и связана с низкими показателями ответа [6]. С появлением таргетной терапии и иммунотерапии роль медикаментозной терапии возрождается. Таргетные методы лечения в основном оценивались у подгрупп пациентов с раком легких, раком груди и меланомой. Использование ингибиторов тирозинкиназы (TKI) первого поколения, которые действуют на метастазы EGFR-мутантного NSCLC в головной мозг, таких как эрлотиниб и гефитиниб, связано с частотой ответа 50–80% и общей выживаемостью 12–24 месяцев [7].
Отек мозга является характерным признаком метастатических опухолей головного мозга и часто способствует неврологической дисфункции и ухудшению качества жизни. Отек мозга при метастазах в головной мозг является результатом утечки плазмы в паренхиму через дисфункциональные церебральные капилляры и может быть вызван многими факторами, включая секрецию факторов роста эндотелия (VEGF), воспалительные цитокины, разрушение части гематоэнцефалического барьера или даже секреторные подтипы определенных опухолей [8; 9].
Бевацизумаб - гуманизированное моноклональное антитело против фактора роста эндотелия сосудов (VEGF). На сегодня в мире препарат одобрен в качестве терапии первой линии для лечения метастатического неплоскоклеточного НМРЛ в ряде стран [10]. Клинические испытания бевацизумаба у пациентов с рецидивирующей мультиформной глиобластомой показали высокую частоту ответа на терапию [11]. В исследованиях BRAIN и EOLE, в которых изучалось применение бевацизумаба у пациентов с неплоскоклеточным НМРЛ, продемонстрирована обнадеживающая эффективность и приемлемый профиль безопасности для противоопухолевой лекарственной терапии, которая включала бевацизумаб в качестве первой линии терапии при бессимптомных и нелеченых метастазах в мозг [12; 13]. Эти результаты свидетельствуют о том, что бевацизумаб может быть полезен пациентам с НМРЛ с метастазами в головной мозг.
Исследование Xiangying M. было направлено на исследование терапевтических и побочных эффектах бевацизумаба у пациентов с тяжелым отеком мозга в большой популяции, по результатам которого было установлено, что бевацизумаб является эффективным средством лечения отека мозга, которое относительно безопасно у пациентов с опухолью головного мозга. Ответ при лечении пациентов с рефрактерным перитуморальным отеком бевацизумабом составил 84,74% [14].
Цель исследования: оценить непосредственные эффекты комбинированного применения бевацизумаба и стереотаксической радиохирургии в терапии метастатического поражения головного мозга немелкоклеточным раком легкого.
Материалы и методы исследования
В исследование включено 30 пациентов с метастатическим поражением головного мозга немелкоклеточным раком легкого, которым была проведена лучевая терапия в отделении радиотерапии ФГБУ «НМИЦ онкологии» МЗ РФ в 2019-2020 гг. Пациенты были разделены на 3 группы по методике проводимой терапии: 1-я группа – облучение всего головного мозга (ОВГМ); 2-я группа – стереотаксическая радиохирургия; 3-я группа – стереотаксическая радиохирургия с предварительным введением бевацизумаба. В таблице 1 обобщены клинические характеристики непосредственно перед началом лечения для трех исследуемых групп.
Таблица 1
Клиническая характеристика пациентов
|
|
1-я группа (ОВГМ) |
2-я группа (SRS) |
3-я группа (SRS + бевацизумаб) |
|
|
Количество пациентов |
10 |
10 |
10 |
|
|
Кумулятивный объем образований, см3 |
Среднее |
6,025 |
3,217 |
1,225 |
|
Диапазон |
1,6-17,5 |
1-5,7 |
0,275-1,655 |
|
|
Возраст пациентов |
Среднее |
62,5 |
64,1 |
58,1 |
|
Диапазон |
54-73 |
38-78 |
44-38 |
|
|
Старше 65 лет |
3 |
5 |
2 |
|
|
Пол |
Мужчины |
3 |
9 |
5 |
|
Женщины |
7 |
1 |
5 |
|
|
Шкала Карновского |
≥80 баллов |
2 |
8 |
9 |
|
≤70 баллов |
8 |
2 |
1 |
|
|
Неврологическая симптоматика |
Да |
9 |
2 |
1 |
|
Нет |
1 |
8 |
9 |
|
Топометрическая подготовка пациентов выполнялась на компьютерном томографе Siemens Somatom Definition AS (Германия). У пациентов 1-й группы фиксация пациента осуществлялась с помощью изготовления индивидуальной термопластической маски для головы. Совмещение томотерических изображений (шаг сканирования 1 мм) и наборов диагностических изображений различных модальностей (Т1 3D Bravo/FSPG с контрастным усилением, аксиальный шаг - 1 мм, Т1 3D Bravo/FSPG нативные, аксиальный шаг - 1 мм, T2 FLAIR, аксиальный шаг – 2-3 мм) производилось в модуле Image Registration системы ARIA (Varian). В модуле Eclipse Contouring с помощью специализированных инструментов (Segmentation Wizard, Brush, Draw Planar Contour и т.д.) выполнялось оконтуривание критических структур и мишени для облучения (головной мозг). Дозиметрическое планирование, включая расчеты верификационных планов, выполнялось в системе ARIA Eclipse External Beam Plannig. Доставка дозы выполнялась с помощью конформных статических полей, применяемый алгоритм расчета - ААА_13.6.23. Верификация выполнялась на цилиндрической матрице детекторов SunNuclear ArcCheck с использованием специализированного программного обеспечения для анализа дозного распределения SunNuclear SNC Patient. Критерии γ-индекса 3%/3 мм; Threshold 10%; порог прохождения 97%. Реализация плана лечения происходила на медицинском линейном ускорителе электронов Varian NovalisTx (США), энергия 6MV, режим SRS, оснащенном многолепестковым коллиматором высокого разрешения и системой позиционирования и контроля положения пациента Excatrac (BrainLab).
Для пациентов 2-й и 3-й групп фиксация производилась индивидуальной трехслойной термопластической маской для стереотаксической лучевой терапии. Совмещение топометрической компьютерной томограммы (шаг сканирования 1 мм) и наборов диагностических изображений различных модальностей (Т1 3D Bravo/FSPG с контрастным усилением, аксиальный шаг - 1 мм, Т1 3D Bravo/FSPG нативные, аксиальный шаг - 1 мм, T2 FLAIR, аксиальный шаг – 2-3 мм) выполнялось в модуле Image Fusion системы Elements (BrainLab, Германия). Корректировка дисторсий МРТ-изображений реализовывалась на основе топометрической компьютерной томограммы в модуле Distortion Correction системы Elements (Германия). В подпрограмме Anatomical Mapping по данным МРТ-изображений выполнялась автоматическая сегментация и, при необходимости, ручная правка критических органов и структур. С помощью инструментов Smart Brush / 2D Brush / 3D Brush вручную по данным диагностических изображений производилось оконтуривание мишеней для облучения. Дозиметрическое планирование, включая расчеты верификационных планов, выполнялось в системе Elements (BrainLab, Германия). Используемый алгоритм расчета - BrainLAB.XVMC.X, методики доставки дозы: конформные динамические ротации и ротации с модуляцией интенсивности (VMAT). Верификация выполнялась на матрице детекторов SunNuclear SRS Mapcheck (США) с использованием специализированного программного обеспечения для анализа дозного распределения SunNuclear SNC Patient. Критерии γ-индекса 3%/1 мм; Threshold 10%; порог прохождения 95%. Реализация плана лечения происходила на медицинском линейном ускорителе электронов Varian NovalisTx (США), энергия 6MV, режим SRS, оснащенном многолепестковым коллиматором высокого разрешения и системой позиционирования и контроля положения пациента Excatrac (BrainLab).
Пациентам из 3-й группы проводилась однократная внутривенная инфузия бевацизумаба в дозе 5 мг/м2 за сутки до проведения сеанса стереотаксической лучевой терапии.
В таблице 2 обобщены характеристики проводимой лучевой терапии для трех исследуемых групп.
Таблица 2
Характеристики проведенного лечения
|
|
1-я группа (ОВГМ) |
2-я группа (SRS) |
3-я группа (SRS + бевацизумаб) |
|
|
Количество полей |
Среднее |
2 |
3 |
4 |
|
Диапазон |
2 |
1-7 |
2-8 |
|
|
Разовая очаговая доза (Гр) |
Среднее |
3 |
21,7 |
24 |
|
Диапазон |
3 |
20-24 |
- |
|
|
Суммарная очаговая доза (Гр) |
Диапазон |
30 |
20-24 |
24 |
Оценка эффективности лечения оценивалась по критериям RANO BM (Response Assessment in Neuro-Oncology Brain Metastases) [15] на основании контрольной магнитно-резонансной томографии (МРТ) головного мозга в трехмерных режимах через 1 месяц после проведенного лечения. Оценка изменения функционального состояния пациентов оценивалась по шкале Карновского. Оценка развития токсических реакций проводилась по критериям CTCAE v5.0 (Common Terminology Criteria for Adverse Events).
Результаты исследования и их обсуждение
В 1-й группе с тотальным облучением головного мозга частичный ответ наблюдался у 3 пациентов (30%), стабилизация отмечена в 7 случаях (70%). Случаев прогрессирования в 1-й группе не отмечалось. Во 2-й группе пациентов с проведенной стереотаксической лучевой терапией положительный эффект в виде частичного ответа и стабилизации наблюдался у 7 пациентов (70%). В 3 случаях (30%) отмечалось прогрессирование метастатического поражения головного мозга в виде появления новых очагов. В 3-й группе положительный эффект достигнут в 90% случаев, однако имелся 1 случай (10%) прогрессирования в виде появления новых метастатических очагов в головном мозге. В таблице 3 обобщены результаты оценки эффекта лечения в целом и для трех исследуемых групп в частности.
Таблица 3
Оценка результатов лечения
|
|
1-я группа (ОВГМ) |
2-я группа (SRS) |
3-я группа (SRS + бевацизумаб) |
|
|
Эффект по критериям RANO BM |
Полный ответ |
0 |
0 |
0 |
|
Частичный ответ |
3 (30%) |
1 (10%) |
1 (10%) |
|
|
Стабилизация |
7 (70%) |
6 (60%) |
8 (80%) |
|
|
Прогрессирование |
0 |
3 (30%) |
1 (10%) |
|
|
Шкала Карновского после терапии |
≥80 баллов |
4 |
7 |
9 |
|
≤70 баллов |
6 |
3 |
1 |
|
У пациентов в 3-й группе через 1 месяц после проведенного лечения наблюдалось значительное уменьшение перифокального отека, что приводило к значительно более быстрому купированию очаговой неврологической симптоматики и снижению потребности в противоотечной терапии глюкокортикостероидами. На рисунке представлен пример изменения перифокального отека после проведенной терапии.
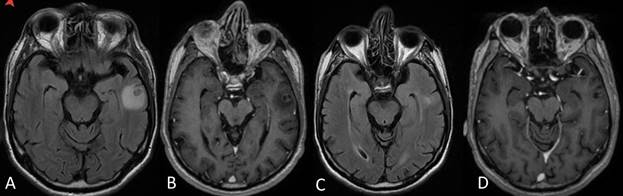
Изменения перифокального отека по данным МРТ: T2 FLAIR до лечения (А), T1 BRAVO до лечения (В), МРТ T2 FLAIR через 1 месяц после лечения (С), T1 BRAVO через 1 месяц после лечения (D)
Токсические реакции носили ограниченный характер и после проведенного лечения наблюдались у 30% пациентов. Так, головная боль 1-2-й степени по критериям CTCAE наблюдалась у 10 больных, в основном у пациентов 1-й группы, после проведенного облучения всего головного мозга (90%). Также у 3 пациентов 1-й группы наблюдалось развитие отека головного мозга 3-й степени по критериям CTCAE, которое потребовало усиления противоотечной терапии. Токсические реакции на введение бевацизумаба в 3-й группе отсутствовали.
Полученные результаты свидетельствуют о перспективности добавления бевацизумаба в комплекс с радиохирургическим лечением для пациентов с метастатическим поражением головного мозга немелкоклеточным раком легкого, что позволило добиться снижения риска прогрессирования в виде появления новых метастатических образований в головном мозге. Благоприятный профиль переносимости препарата и сопутствующий противоотечный эффект свидетельствуют о необходимости дальнейшего исследования комплексного применения препарата бевацизумаб на большей выборке пациентов.
Заключение
Комплексное применение антиангиогенных препаратов с лучевыми методами лечения метастатического поражения головного мозга немелкоклеточным раком легкого продемонстрировало их высокую эффективность, в первую очередь, за счет снижения вероятности появления новых метастатических очагов по сравнению со стереотаксической лучевой терапией в самостоятельном варианте, а также меньшего развития токсических реакций по сравнению с облучением всего головного мозга.
Библиографическая ссылка
Вошедский В.И., Дженкова Е.А., Сакун П.Г., Гусарева М.А., Енгибарян М.А., Зброилова Е.С., Власов С.Г., Командиров М.А., Култышева Ю.А. ОПЫТ ПРИМЕНЕНИЯ АНТИАНГИОГЕННЫХ ПРЕПАРАТОВ В КОМПЛЕКСЕ СО СТЕРЕОТАКСИЧЕСКОЙ РАДИОХИРУРГИЕЙ ПРИ ЛЕЧЕНИИ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОРАЖЕНИЕМ ГОЛОВНОГО МОЗГА НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО // Современные проблемы науки и образования. 2021. № 5. ;URL: https://science-education.ru/ru/article/view?id=31078 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31078



