Современная регенеративная медицина широко использует клеточные технологии для активации процесса регенерации [1-3]. Однако одним из основных препятствий внедрения их в практику являются потенциальные риски, связанные с возможным нарушением пролиферации, дифференцировки и миграции этих клеток. Избежать таких осложнений представляется возможным в случае использования биодеградирующих скаффолдов. Особенно привлекательными представляются биополимеры, обладающие естественной биодеградацией [4-8]. Среди них наиболее перспективные филлеры, содержащие в своем составе кристаллы гидроксиапатита: «Радиесс» (Германия) и «Люминера» (Израиль). Эти биодеградируемые филлеры применяются в челюстно-лицевой хирургии, травматологии, фармакологии и косметологии. В последнем случае эти вещества обуславливают стимуляцию возрастных фибробластов [9], а также восстановление поврежденных участков кожи в процессе синтеза ее внеклеточного матрикса [10; 11]. К филлерам подобного типа можно отнести и препарат Facetem, представленный концерном Daewoong Group, разработанный на основе кристаллов гидроксиапатита кальция по новой технологии Lattice-pore, используемой для формирования микросфер.
Цель исследования: настоящее исследование посвящено изучению морфологических преобразований дермы, происходящих в зоне имплантации скаффолда из Facetem.
Материалы и методы исследования
Эксперимент проведен на 30 беспородных крысах-самцах массой 200-250 г (ПЛЖ «Рапполово» Ленинградской области). Животным вводили препарат Facetem, изготовленный на основе гидроксиапатита кальция. Он относится к имплантам нового поколения за счет использования микросфер, изготовленных по технологии Lattice-pore (производитель Южная Корея). При проведении эксперимента соблюдались этические нормы и рекомендации по гуманному отношению к лабораторным животным. Содержание и дизайн исследований согласованы с Независимым этическим комитетом ФГБОУ ВО «КубГМУ» Минздрава России (протокол № 54 от 11.10.2017 г.). Введение филлера проводилось после выстригания волосяного покрова субдермально в объеме 0,05 мл в заднюю часть шеи (площадь 3x3 см). Объектом морфологического и гистохимического изучения стали фрагменты кожных покровов в области введения препарата. Забор материала производили спустя одну и две недели, 1, 2, 3, 5 месяцев после инъекции. Проводку и заливку материала выполняли в процессорах фирмы Tissue-Tek VIP5Jr., (Япония). Из парафиновых блоков изготавливали срезы толщиной 5-6 микрон с использованием ротационного микротома HM 340 E (MICROM Laborgerate GmbH, Германия). Срезы окрашивали гематоксилином и эозином, по методу Ван Гизона, по Маллори и Массону [11] в автоматическом мультистейнере Tissue-Tek Prisma (Япония).
Статистический анализ результатов исследования выполнен с применением компьютерной программы Statistica 13 Trial.
Результаты исследования и их обсуждение
Визуализация препаратов дермы после окраски гематоксилином и эозином, а также при реакциях Маллори, Массона и Ван Гизона показали, что спустя одну неделю после введения импланта зона локализации его типировалась по наличию микросфер. Последние имели вид цист, окруженных одним слоем плоских клеток с гиперхромными ядрами. Между микросферами располагались фрагменты коллагеновых волокон темно-синего цвета в окраске по Маллори (рис. 1). В зоне экстрацеллюлярного матрикса типировался клеточный инфильтрат, большинство ядер этих клеток находились в стадии активации, о чем свидетельствовал их дисперсный хроматин и наличие в них 1-2 ядрышек (рис. 2). В зоне импланта выявлялись клетки с пенистым и вакуолизированным содержимым (рис. 2).
|
Окраска по Маллори. Об. 40х; Ок. 10х |
Рис. 2. Участок дермы через 1 неделю после введения филлера. Окраска по Маллори. Об. 100х; Ок. 10х
|
В дерме над и под имплантом дифференцировались три типа клеток: молодые фибробласты с базофильной цитоплазмой, макрофаги с пенистой цитоплазмой и структурированными ядрами и, наконец, плазматические клетки с эксцентрически расположенным ядром. Количественное соотношение этих типов клеток на различных участках дермы варьировало.
Процесс неоколлагеногенеза к этому сроку наблюдения мог быть установлен при использовании окраски по Маллори, где на отдельных участках зоны импланта выявлялись широкие, но короткие фибриллярные ленты темно-синего цвета (рис. 2).
К двум неделям наблюдения в зоне импланта типировалось большее число коллагеновых волокон, при этом они не только окружали имплант, но и врастали внутрь, разделяя его на фрагменты (рис. 3). Микросферы в этих условиях сохраняли один клеточный слой или тонкую фибриллярную оболочку. Между микросферами много ядер, принадлежащих вакуолизированным клеткам (рис. 3). Статус ядер варьирует от гиперхромных к структурированным.
Спустя 1 месяц изменения, наблюдаемые в зоне локализации Facetem, могли быть определены как активация процесса неоколлагеногенеза, ибо на всем участке импланта появлялись короткие пучки волокон, расположенные между фибробластами и мононуклеарами (рис. 4).
|
Рис. 3. Участок дермы через 2 недели после введения филлера. Окраска по Маллори. Об. 40х; Ок. 10х |
Рис. 4. Участок дермы через 1 месяц после введения филлера. Окраска по Маллори. Об. 40х; Ок. 10х
|
Микросферы к этому сроку окружены фибриллами или уплощенным клеточным монослоем, вокруг микросфер типировалась гомогенезированная вакуолизированная масса с большим числом гиперхромных ядер. Местами вокруг микросфер можно увидеть широкие, короткие коллагеновые волокна.
К концу 2-го месяца зона импланта окружена уже плотной волокнистой соединительной тканью с большим количеством коллагеновых волокон. Часть этих волокон от капсулы вдавалась вглубь импланта и делила его на отдельные фрагменты, где располагались микросферы с уплощенным слоем базофильно окрашенных клеток, между которыми видны тонкие коллагеновые фибриллы (рис. 5). В зоне матрикса выявлялось большое число фибробластов, находящихся на различной стадии созревания, здесь достаточно много и мононуклеаров. Местами типировались участки матрикса, имеющие пенистый вид. Не исключено, что это собранные в виде групп макрофаги, трансформированные в эпителиоидные клетки. Полинуклеары, встречающиеся здесь, характеризовались слиянием большого числа клеток и содержали от 15 до 20 ядер (рис. 6).
|
Рис. 5. Участок дермы через 2 месяца после введения филлера. Окраска по Маллори. Об. 40х; Ок. 10х |
|
Эффект коллагеногенеза вокруг импланта связан с формированием хорошо выраженной капсулы, окружающей имплант. Вместе с тем число микросфер в зоне импланта по сравнению с 1-м месяцем снижалось почти в 2 раза, а число клеток в составе инфильтрата между волокнами коллагена, заполняющими зону импланта, увеличивалось. Здесь можно увидеть также базофильно окрашенные клетки – «кляксы» округлой формы – вероятно, это лаброциты. Клетки вытянутой веретеновидной формы, вероятно, являлись фибробластами.
После 3 месяцев пребывания импланта в дерме он может быть типирован по двум структурам. Первая – округлые, вакуолизированные клетки со значительным числом ядер, то есть многоядерные клетки инородного тела. С другой стороны – многочисленные отростчатые клетки с базофильно и диффузно окрашенной цитоплазмой – это фибробласты. Повсюду видны прослойки широких коллагеновых волокон, в зоне импланта волокна тонкие и не формируют пучки. Имплант сохраняет островки из микросфер, окруженных большим числом коллагеновых волокон, сформированных в виде пучков. В составе этих островков микросфер мало. Здесь встречались многоядерные клетки, а также вакуолизированные клетки, или же клетки, заполненные большим числом интенсивно окрашенных гранул. В прослойках соединительной ткани много клеток, напоминающих тучные, некоторые из этих клеток находились в стадии дегрануляции. После пяти месяцев пребывания импланта в дерме ни в одном из фрагментов полученного материала он не сохранился. Весь участок дермы представлен достаточно плотной соединительной тканью. И сосочковый слой здесь нивелируется. Структура дермы в остальном не нарушена, и картина хронического воспаления и клеточные инфильтраты отсутствуют.
Итак, морфологические преобразования дермы, происходящие под влиянием импланта из Facetem, могут быть представлены в виде схемы (рис. 7) которая отражает динамику процессов, укладывающихся в четыре следующие фазы. Первая – это альтерация с явлением коагуляции и гемостаза. Вторая – это развитие воспалительной реакции, третья – пролиферативная фаза, и четвертая – фаза ремоделирования. Каждая из упомянутых фаз меняет, прежде всего, структурную организацию экстрацеллюлярного матрикса дермы, являющегося метаболически активным и постоянно реконструируемым ее компонентом.
Первым ответом на альтерацию, то есть в первую неделю наблюдения после введения импланта, происходил выход из циркулирующей крови массы моноцитов, затем к ним присоединялись клетки, образующиеся в результате последующего митоза (клетка делится один раз). Вся эта клеточная масса подвергалась дифференцировке, заканчивающейся образованием макрофагов. Формирующийся инфильтрат содержал мало нейтрофилов, много лимфоцитов, моноцитов и малодифференцированных клеток. Описанные изменения позволяют охарактеризовать их как стадию реактивного воспаления, где в роли главного координирующего фактора выступают макрофаги, секретирующие биологически активные вещества, обладающие токсичностью по отношению к дерме. Подтверждением факта развития пролиферативного воспаления выступали появляющиеся к началу 2-й недели и типируемые в последующие сроки наблюдения вакуолизированные или эпителиоидные клетки, являющиеся результатом трансформации макрофагов. Эти клетки снижали фагоцитарную активность, но запускали процесс синтеза провоспалительных медиаторов, которые и вызывали клеточный ответ.
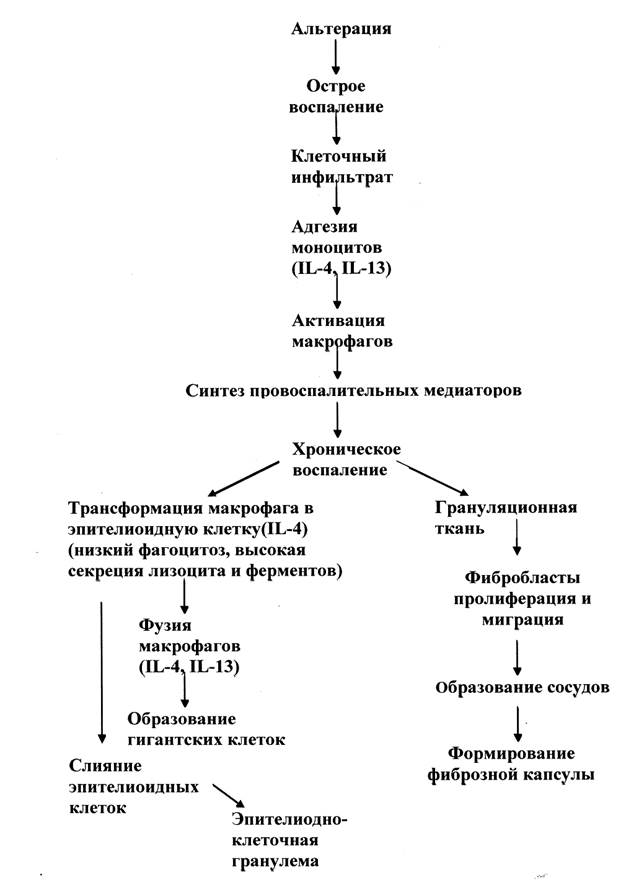
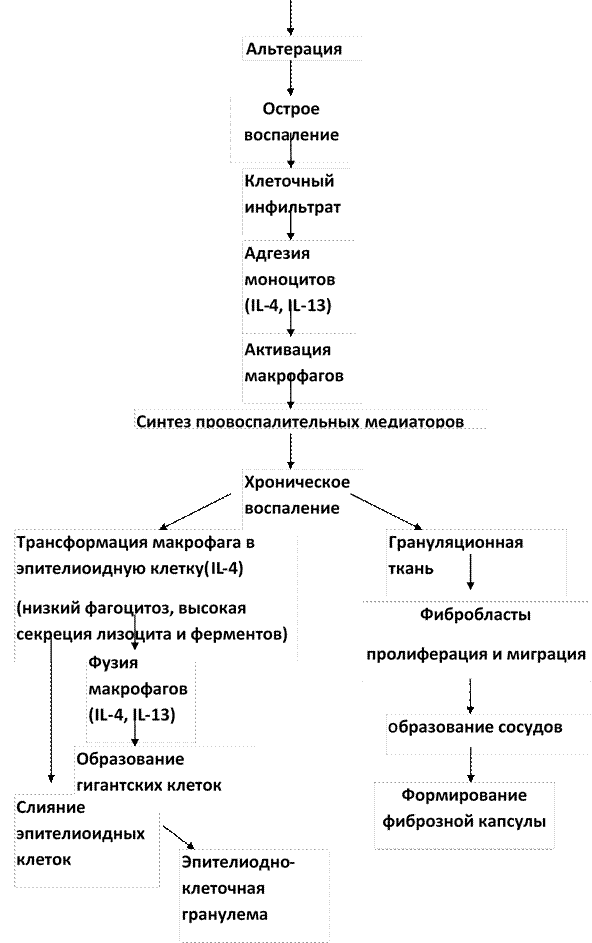
Рис. 7. Стадии реакции дермы на Facetem
Участие макрофагов в этом процессе не ограничивается эффектом трансформации, они индуцировали пролиферацию фибробластов с последующим коллагеногенезом, при этом формирующиеся клеточные кооперации меняли компоненты экстрацеллюлярного матрикса за счет усиления метаболизма фибробластов с последующим синтезом ими коллагена. Во всяком случае, эти биомаркеры могут быть использованы для мониторинга статуса экстрацеллюлярного матрикса.
К концу первого месяца наблюдения в зоне импланта появлялись гигантские клетки инородных тел. Единичные клетки этого типа можно выявить и в срок, соответствующий двум неделям, но это, скорее всего, многоядерные клетки типа Пирогова-Лангханса.
Исходом морфологической трансформации макрофагов может быть эпителиоидная гранулема. В данном случае она могла бы стать клиническим ответом на плохо фагоцитируемый материал импланта. Однако в сроки, соответствующие трем и пяти месяцам, происходила утилизация материала Facetem со снижением числа микросфер в зоне импланта. Поскольку эффект активации макрофагов сопровождался пролиферацией фибробластов с присущим для этих клеток коллагеногенезом, то можно считать, что в условиях использования препарата Facetem эффект лифтингового филлера может быть реализован.
По данным литературы (Stein et al. 2015) и собственных исследований (Могильная, Фомичева, 2018), характер разыгрывающейся ответной реакции на имплант Facetem сопоставим с механизмом ответной реакции дермы на введение полимолочной кислоты. Во всяком случае, речь также идет о процессе развития воспалительной реакции на инородное тело. Различия между сравниваемыми имплантами существует, но они могут быть расшифрованы с привлечением исследования клеток дермы на молекулярном уровне с использованием методов иммуногистохимии.
Заключение
Таким образом, проведенное исследование показало, что филлер Facetem относится к биодеградируемым и в условиях его пролонгированного пребывания в дерме обеспечивает увеличение объема экстрацеллюлярного матрикса дермы этими клетками за счет синтеза коллагена фибробластами. Механизм ответной реакции дермы разыгрывается по типу воспалительной реакции. Выявленная фазность – это реакция на инородное тело с оседанием белков плазмы на поверхности импланта (провизорный матрикс), вызванная модулированием активности макрофагов с последующей их пролиферацией и активацией фибробластов с переходом острого воспаления в хроническое с последующим эффектом ремоделирования экстрацеллюлярного матрикса.
Библиографическая ссылка
Могильная Г.М., Ковальчук Ю.В., Фомичева Е.В., Пейливаньян Э.Г., Евглевский А.А. ИНЪЕКЦИОННЫЙ ИМПЛАНТ FACETEM И РЕАКЦИЯ ДЕРМЫ НА ЕГО ВВЕДЕНИЕ // Современные проблемы науки и образования. 2021. № 5. ;URL: https://science-education.ru/ru/article/view?id=31070 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31070




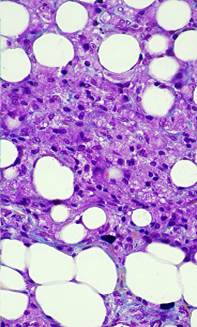 Рис. 1. Участок дермы через 1 неделю после введения филлера.
Рис. 1. Участок дермы через 1 неделю после введения филлера.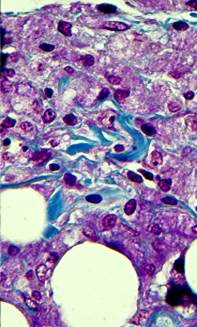
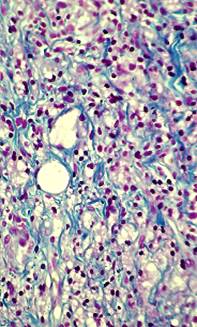
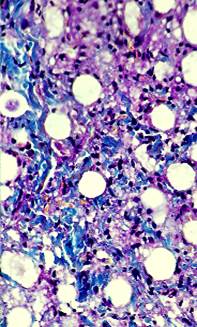
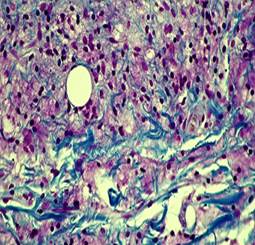
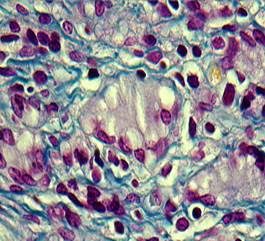 Рис. 6. Участок дермы через 2 месяца после введения филлера. Окраска по Маллори. Об. 100х; Ок. 10х
Рис. 6. Участок дермы через 2 месяца после введения филлера. Окраска по Маллори. Об. 100х; Ок. 10х