Менингиомы представляют собой важнейшую фундаментально-научную и клинико-практическую проблему. С точки зрения патогенетических процессов, происхождение и, как следствие, дальнейшее развитие менингиом является крайне многовекторным процессом, в рамках которого ведущую роль берут на себя попеременно несколько молекулярных драйверных факторов [1]. В то же время классические гистологические диагностические критерии имеют лишь ограниченную применимость, позволяющую дифференцировать менингиомы, согласно классификации ВОЗ опухолей центральной нервной системы, на менингиомы Grade I, менингиомы Grade II и менингиомы Grade III [2]. Предсказательная ценность подобного подхода требует дальнейшего совершенствования, поскольку около 20% менингиом Grade I, выявленных по критериям ВОЗ, в дальнейшем рецидивируют и могут подвергаться малигнизации [3; 4].
Для решения данной проблемы используется ряд самых современных подходов, берущих за основу в первую очередь выявление характера и степени активности драйверных молекулярных факторов в менингиомах. При этом наиболее важную роль в поддержании активности патогенетического процесса на разных его этапах играют такие ключевые протоонкогены и антионкогены, как SMO, Akt1, PDGFR, EGFR и CDKN2A. Данные гены и модификация их экспрессии приводят к повышению пролиферативной активности опухолевых клеток, способствуют лучшей выживаемости и стимулируют интенсивный рост опухоли, неблагоприятно влияя на прогноз [5-8].
В рамках наших предшествующих исследований мы обратили свое внимание на наименее изученную область из вышеперечисленных направлений, на протеомный уровень. На основе оценки метаболической, пролиферативной, апоптотической и антигипоксической активности с использованием маркеров Ki-67, каспазы 9 (Cas9), каспазы 3 (Cas3), сукцинил-КоА-синтетазы (СКоАС) и HIF-1α мы провели кластерный анализ опухолевых клеток в менинготелиоматозных, переходных, фибробластических, псаммоматозных, атипических и анапластических менингиомах с последующим кластерированием и группированием кластеров в типы кластеров (ТК), сходные по функциональным и молекулярным свойствам. В целом мы выделили 8 ТК, в рамках которых 1 ТК характеризуется наиболее низкими показателями индекса мечения Ki-67 (ИМ Ki-67), активности экспрессии СКоАС, HIF-1α, а также наиболее высокими показателями активности экспрессии Cas9 и Cas3. В то же время параметры ИМ Ki-67 активности экспрессии СКоАС, HIF-1α постепенно повышаются к 8 ТК, параметры же активности экспрессии Cas9 и Cas3, наоборот, снижаются. В то же время разные патогистологические виды менингиом отличались характерными комбинациями ТК, наиболее часто встречаемых именно при данной разновидности [9].
Цель исследования
В рамках настоящего исследования мы решили охарактеризовать активность экспрессии генов SMO, Akt1, PDGFR, EGFR и CDKN2A в выявленных ранее ТК и рассмотреть их влияние на общую выживаемость (ОВ) и безрецидивную выживаемость (БРВ) пациентов в рамках модели с выделением ТК с менингиомами различных Grade по классификации ВОЗ.
Материалы и методы исследования
Группа исследования
В рамках настоящего исследования были изучены 48 менингиом Grade I, 38 менингиом Grade II и 36 менингиом Grade III. Все пациенты проходили хирургическое лечение в ФГАУ «НМИЦ нейрохирургии имени акад. Н.Н. Бурденко» в 2012–2015 годах. Критериями включения стали первичное вмешательство по поводу данного новообразования, отсутствие других онкологических заболеваний, наличие достаточного качества материала новообразования.
Выделение различных ТК в менингиомах
Подробно процесс выделения различных ТК в менингиомах был описан в предыдущей работе [9]. Вначале производились срезы менингиом толщиной 3 микрометра и проводилась иммуногистохимия с моноклональными антителами против человеческого антигена Ki-67 (CONFIRM anti-Ki67, Roche-Ventana, США), моноклональными антителами против человеческого антигена Cas9 (SAB3500405, Sigma-Aldrich, США), моноклональными антителами против человеческого антигена Cas3 (C7729, Sigma-Aldrich, США), моноклональными антителами против человеческого антигена сукцинил-КоА-синтетазы (SAB2700343, Sigma-Aldrich, США), моноклональными антителами против человеческого антигена HIF-1α (H6536, Sigma-Aldrich USA). Далее проводился первичный анализ изображений с использованием сканера Aperio 3T (Leica Biosystems, GmbH), в рамках которого полученные изображения для всех маркеров сопоставлялись между собой с максимальной точностью по координатным данным для получения сложных «многослойных» изображений с помощью программного обеспечения Aperio ImageScope (Leica Biosystems, GmbH), ImageJ (Национальный институт здравоохранения, США) и QuPath (Университет Эдинбурга, Великобритания). Далее с помощью технологий машинного обучения, нейросетевого анализа и технологий больших данных выделялись клетки и ядра клеток вместе с положительными метками для всех пяти исследованных маркеров, что служило основой для проведения кластерного анализа с применением технологий больших данных и программного обеспечения Matlab (The MathWorks, США) и SPSS Statistics 23 (IBM, США). Сначала на базе данных клеток выделялись группы клеток в виде клеточных кластеров. После этого производился вторичный анализ изображений с применением полуавтоматических программных алгоритмов. На основе данных вторичного анализа изображений был проведен вторичный кластерный анализ, в результате которого выделенные клеточные кластеры различных пациентов были классифицированы в более крупные категории в виде ТК. Все взятые в исследование менингиомы были картированы по данным ТК с использованием подходов к кластерированию, применявшихся в рамках предшествующей работы.
Молекулярное исследование и сопоставление образцов
Далее серийные срезы опухолей, подвергшихся процессу кластеризации, были взяты в качестве материала для проведения мультимерной флуоресцентной in situ гибридизации. Подготовленные срезы опухоли, помещенные на предметные стекла и замороженные при –80°C, быстро переносили в предварительно охлажденный 4%-ный раствор парафармальдегида (Sigma-Aldrich, США). Далее все образцы инкубировали в течение 15 минут при 4°C. После этого предметные стекла промывали раствором 1xPBS при комнатной температуре пять раз по 2 мин. Затем стекла обезвоживали в 50%-ном этаноле в течение 5 минут, в 70%-ном этаноле в течение 5 минут и дважды в свежем 100%-ном этаноле при комнатной температуре. После удаления избытка жидкости предметные стекла сушили на воздухе на плоской поверхности в течение 5 минут при комнатной температуре. Затем предметные стекла полностью погружали в раствор для предварительной обработки протеазой IV (Advanced Cell Diagnostics, Bio-Techne, США) и инкубировали в течение 30 минут при комнатной температуре. Для выделения основных популяций клеток использовали РНК-зонды, комплементарные мРНК генов SMO, Akt1, PDGFR, EGFR и гена CDKN2A. SMO был отмечен синим, Akt1 – зеленым, EGFR – желтым, PDGFR – оранжевым, CDKN2A – красным цветом. Для приготовления зондов их предварительно нагревали в течение 10 минут при 40°C на водяной бане. Смесь зондов РНК готовили в пробирках без содержания РНКазы. Концентрация каждого зонда в растворе составляла 1:50. Затем предметные стекла переносили из раствора для предварительной обработки в раствор 1xPBS при комнатной температуре, промывали их и инкубировали дважды в течение 2 минут. После этого все стекла были перенесены на горизонтальную стойку для стекол в предварительно нагретой увлажняющей камере, и 50 мкл смеси зондов было нанесено пипеткой на каждое стекло. Далее проводили гибридизацию зондов в течение 2 часов при 40°C в герметичной увлажненной камере. После этого избыток гибридизационного раствора удаляли с каждого предметного стекла и дважды обрабатывали 1х промывочным буфером при комнатной температуре в течение 2 минут. Затем с каждого предметного стекла удаляли избыток 1х промывочного буфера и предметные стекла переносили в увлажненную камеру. Все стекла покрывали раствором для амплификации AMP1 (Advanced Cell Diagnostics, Bio-Techne, USA) и инкубировали в увлажненной камере в течение 30 минут при 40°C. После этого все стекла дважды промывали 1x промывочным буфером при комнатной температуре. Также затем добавляли раствор для амплификации AMP2 (Advanced Cell Diagnostics, Bio-Techne, США) и инкубировали в течение 15 минут при 40°C с последующей промывкой всех стекол дважды в промывочном буфере 1x при комнатной температуре. На следующем этапе добавляли раствор для амплификации AMP3 (Advanced Cell Diagnostics, Bio-Techne, США) и инкубировали в течение 30 минут при 40°C с последующей промывкой стекол дважды в промывочном буфере 1x при комнатной температуре. Наконец, добавляли раствор для амплификации AMP4 (Advanced Cell Diagnostics, Bio-Techne, США) и инкубировали в течение 15 минут при 40°C. Затем предметные стекла дважды промывали 1x промывочным буфером при комнатной температуре. Затем проводили окрашивание ядер клеток добавлением 2 капель DAPI (Thermo Fisher Scientific, США) и инкубацию в течение 30 секунд при комнатной температуре. На следующем этапе к каждому предметному стеклу добавляли 10 мкл водной монтажной среды Mowiol DABCO (Thermo Fisher Scientific, США) и на каждое предметное стекло помещали покровное стекло. Затем стекла помещали в темную комнату на 12 часов при 4°C для полного высыхания. Далее все образцы оцифровывались и максимально точно сопоставлялись с образцами, подвергшимися иммуногистохимическому исследованию, после чего с помощью программных алгоритмов и нейросетевого анализа проводилось выделение ТК и подсчет активности экспрессии указанных РНК в каждом ТК в процентах по ранее описанной методике, причем с учетом антионкогенной активности гена CDKN2A для него рассчитывалось снижение активности экспрессии по сравнению с референсом [10].
Статистический анализ
Для проведения статистического анализа применялось программное обеспечение Matlab и SPSS Statistics 23.0. Кластерный анализ проводился по методу k-средних. Межгрупповые сравнения выполнялись с использованием U-критерия Манна - Уитни в случае ненормального распределения признака, t-критерия Стьюдента в случае нормального распределения признака. Характер распределения признаков определяли с помощью критерия Шапиро - Уилка. Влияние исследуемых факторов на выживаемость пациентов определяли с помощью модели пропорциональных рисков Кокса. Различия считали достоверными при p<0.05.
Результаты исследования и их обсуждение
Данные когорты
Средний возраст пациентов в исследуемой когорте составил 62.48±2.84 года. Соотношение мужчин и женщин составило 40.98%:59.02%.
В менингиомах различные ТК различаются по своим молекулярным свойствам
При сопоставлении данных молекулярных методов исследования с данными о ТК, выделенных по функциональному принципу, было выявлено много характерных особенностей, типичных для каждого ТК. Было выявлено, что для 1ТК в значимом количестве характерна лишь высокая активность экспрессии гена SMO, составившая 42.48±4.28% в клетках менингиомы. Активность экспрессии других генов в данном ТК была достаточно низкой. Также для 2ТК была характерна высокая активность экспрессии гена SMO, равнявшаяся 64.42±4.36% в клетках менингиомы, и высокая активность экспрессии гена Akt1, составившая 28.38±4.46% в клетках менингиомы, что статистически значимо отличается от 1ТК (p<0.001). Кроме того, для 3ТК было показано, что наибольшая активность экспрессии выявляется в случае гена SMO и равняется 62.42±4.44%, а также генов Akt1, где она составляет 46.48±2.38% и PDGFR со значением 26.44±4.46% в клетках менингиомы, при этом различия с 2ТК носят статистически значимый характер (p<0.001). Также для 4ТК было показано, что наиболее активно в нем экспрессируется ген PDGFR с активностью экспрессии 48.42±2.36% в клетках менингиомы, помимо того, наблюдается высокая экспрессия гена Akt1, равняющаяся 46.38±2.48% в клетках менингиомы, что статистически значимо различается с 3ТК (p<0.001) (рис. 1).
Более того, было выявлено, что в 5ТК активность экспрессии гена PDGFR также преобладает, составляя 68.42±4.82% в клетках менингиомы, но, кроме того, выявлялась высокая активность экспрессии гена Akt1, равнявшаяся 44.56±4.84% в клетках менингиомы, что значимо различается с 4ТК (p=0.004). Также было показано, что в 6ТК наиболее высокая активность экспрессии выявляется в гене PDGFR, составляя 48.58±4.62% в клетках менингиомы, в то же время выявлялась значительная экспрессия гена EGFR, равнявшаяся 28.84±2.38% в клетках менингиомы, различия с 5ТК были значимыми (p<0.001). В то же время в рамках 7ТК наиболее активно экспрессирующимся геном был ген EGFR, его активность экспрессии составила 48.54±4.82% в клетках менингиомы, в то же время выявлялось существенное снижение активности экспрессии гена CDKN2A, равнявшееся 28.42% в клетках менингиомы с наличием статистически значимых различий с 6ТК (p<0.001). Более того, при рассмотрении свойств 8ТК мы выявили, что наиболее выраженным стало снижение активности экспрессии гена CDKN2A, составившее 44.48±4.38% в клетках менингиомы с наличием статистически значимых различий с ТК7 (p<0.001). Данные результаты по различным ТК в менингиомах представлены наиболее полно на графике (рис. 1).
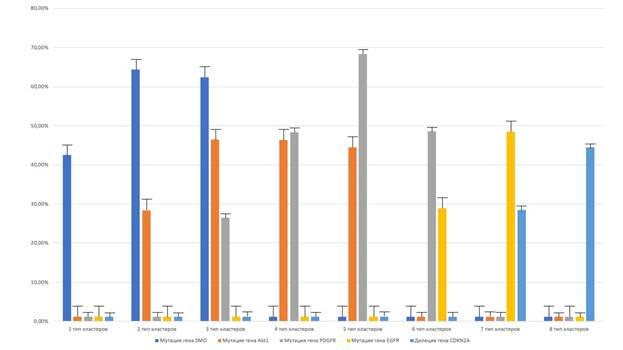
Рис. 1. Молекулярная характеристика различных типов кластеров. В данном случае приведена активность экспрессии генов SMO, Akt1, PDGFR, EGFR и CDKN2A в каждом типе клеточных кластеров менингиом в процентах
Влияние различных ТК в менингиомах на прогноз пациентов
Далее мы решили оценить влияние различных ТК на ОВ и БРВ пациентов с менингиомами. Для решения данной задачи мы провели регрессионный анализ с оценкой потенциальных корреляций между параметрами выживаемости и процентом клеток в ткани опухоли, принадлежащих тому или иному ТК в структуре менингиомы. Было выявлено, что значимое влияние на прогноз БРВ оказывают 3ТК (p=0.008), 4ТК (p=0.006), 5ТК (p<0.001), 6 ТК (p<0.001), 7ТК (p<0.001) и 8ТК (p<0.001). В рамках мультипараметрического регрессионного анализа было выявлено, что наибольшей предсказательной ценностью выделяется модель с комбинацией процентного содержания в ткани менингиомы 4ТК, 5ТК, 6 ТК, 7ТК и 8ТК (p<0.001). В то же время на прогноз ОВ значимое влияние оказывали 4ТК (p=0.008), 5ТК (p<0.001), 6ТК (p<0.001), 7ТК (p<0.001) и 8ТК (p<0.001). При этом комбинация 6 ТК, 7ТК и 8ТК демонстрировала наиболее высокую предсказательную ценность (p<0.001).
Влияние молекулярных свойств ТК на прогноз
С точки зрения влияния молекулярных свойств различных ТК было показано, что наиболее значимое влияние на БРВ оказывает активность экспрессии гена PDGFR в 4ТК (p<0.001), активность экспрессии гена EGFR в 6 ТК (p<0.001), а также уровень снижения активности экспрессии гена CDKN2A в 8ТК (p<0.001). В то же время при рассмотрении влияния на ОВ наиболее выраженным воздействием на данный параметр отличалась активность экспрессии гена PDGFR в 6ТК (p<0.001), гена EGFR в 7ТК (p<0.001) и снижение активности экспрессии CDKN2A в 8ТК (p<0.001). При проведении мультипараметрического регрессионного анализа было выявлено, что комбинация ИМ Ki-67 в 4ТК, активность экспрессии гена PDGFR в 6 ТК, а также снижение активности экспрессии гена CDKN2A в 8ТК служит наиболее точной предсказательной моделью для определения БРВ пациентов с менингиомами (p<0.001). Тем не менее для проведения предикторной оценки ОВ наибольшей точностью выделяется комбинация ИМ Ki-67 в 5ТК, активность экспрессии гена PDGFR в 6ТК, активность экспрессии гена EGFR в 7ТК и снижение активности экспрессии гена CDKN2A в 8ТК (p<0.001). Результаты можно в полной мере рассмотреть на представленном ниже графике (рис. 2).
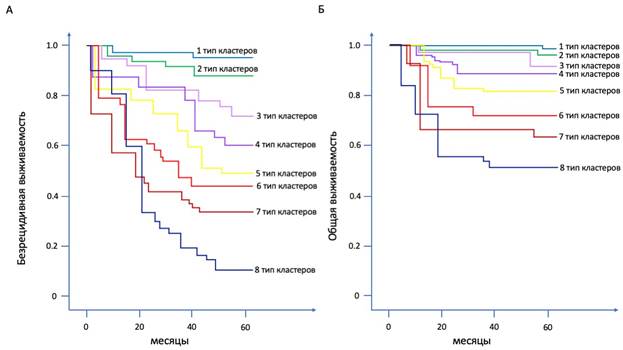
Рис. 2. Показатели общей и безрецидивной выживаемости у пациентов с преобладанием различных типов клеточных кластеров в структуре менингиомы. Преобладающие типы кластеров выделены разными цветами и подписаны на графике. На рисунке А представлены показатели безрецидивной выживаемости, на рисунке Б показатели общей выживаемости пациентов
В рамках настоящей научной работы мы получили крайне любопытные данные, касающиеся внутренней гетерогенности менингиом. Выяснилось, что выявленные ранее ТК демонстрируют молекулярные свойства, различающиеся у каждого ТК. При этом различия в активности экспрессии ключевых протоонкогенов и антионкогенов с точки зрения опухолевого патогенеза демонстрируют принципиальную значимость выделенных ранее клеточных популяций для развития менингиом различной степени злокачественности. Биологическое поведение новообразования во многом опирается на механизмы, тесно связанные как с активностью отдельно взятых ТК, так и с взаимодействием между различными ТК.
Полученные нами данные демонстрируют картину внутренних свойств ТК, а также закономерностей их взаимодействия в первом приближении. Но даже в таком варианте уже выявляется ряд важнейших подробностей, значимых не только для фундаментальных проблем канцерогенеза менингиом, но также для практических вопросов. В фундаментальном смысле наблюдается очевидное преобладание наиболее пролиферативно активных ТК в когорте опухолей с высокой степенью биологической агрессивности. При этом важнейшим драйверным молекулярным событием выступают в первую очередь активация гена EGFR и изменение активности гена CDKN2A. Данные гены, по-видимому, играют ключевую роль в обеспечении роста и развития наиболее злокачественных разновидностей менингиом. В то же время любопытно заметить, что активность гена PDGFR выступает в качестве своеобразного промежуточного фактора, который может встречаться как в доброкачественных, так и в злокачественных менингиомах, причем в зависимости от его активности в ту или иную сторону может колебаться также биологическая агрессивность соответствующего новообразования. Данные наблюдения подтверждаются также тем, что наибольшая степень активности данного гена наблюдается именно в переходных ТК, присущих разным по степени злокачественности менингиомам. Ключевая роль PDGFR подчеркивается также высокой его прогностической ценностью, что было доказано клиническими данными и включенностью данного параметра во все наиболее точные прогностические модели.
В целом необходимо заметить, что многие вопросы внутриопухолевой гетерогенности менингиом пока не раскрыты. Наша работа дает лишь первое важное представление по данной проблеме, при этом ряд принципиальных направлений для исследования требует дальнейшего пристального изучения и предметного разбора. В частности, крайне любопытно соотношение ТК в менингиомах различной локализации, поскольку было показано, что первичное место возникновения менингиомы непосредственно влияет на прогноз пациентов [11]. Кроме того, любопытным представляется вопрос соотношения развития и функционирования ТК в связи с опухолевыми стволовыми клетками в менингиомах [12], также занимающими заметное место в патогенезе.
Заключение
В данной работе выявлены наиболее принципиальные закономерности распределения ТК в менингиомах различной степени злокачественности. Данные свойства представляют собой важнейшее отражение внутренних механизмов развития новообразования. Формируясь в различных патологических реалиях и находясь под влиянием ключевых драйверных генов, клетки менингиомы функционально дифференцируются с появлением различных видов клеточных популяций. Данный процесс рождает сложную картину внутриопухолевой функциональной гетерогенности менингиом. Свойства не только самих клеточных популяций, но также взаимодействий между ними создают уникальный функциональный ландшафт опухоли, непосредственно детерминирующий биологическое поведение менингиомы.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 19-29-01214 мк.
Библиографическая ссылка
Никитин П.В., Мусина Г.Р., Галстян С.А., Зубова И.В., Хохлова Е.А. МОЛЕКУЛЯРНЫЕ СВОЙСТВА РАЗЛИЧНЫХ ТИПОВ КЛЕТОЧНЫХ КЛАСТЕРОВ В МЕНИНГИОМАХ И ИХ ВЛИЯНИЕ НА ПРОГНОЗ ПАЦИЕНТОВ // Современные проблемы науки и образования. 2021. № 5. ;URL: https://science-education.ru/ru/article/view?id=31068 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.31068



