Получение новых эффективных и безопасных лекарственных препаратов является одним из важнейших направлений медицинской химии и фармацевтической науки. Первым этапом разработки оригинального лекарственного препарата всегда служат молекулярное конструирование новой химической структуры биологически активного соединений (БАС) или же поиск БАС среди множества природных веществ. Часто в качестве модифицированной структуры используется молекула с уже хорошо изученными фармакологическими свойствами, что позволяет на основе «фармакофорных» элементов химической структуры моделировать новое БАС. Для молекулярного конструирования БАС активно используются современные методы медицинской химии посредством компьютерных программ различной направленности. Таким образом, логико-структурный подход позволяет сгенерировать ряд новых БАС с заданными биологическими активностями, с помощью компьютерных технологий отбираются наиболее перспективные из них для последующего синтеза.
Создание БАС на основе эндогенных соединений позволяет понизить вероятные нежелательные побочные действия целенаправленно синтезированных структур. Одними из таких соединений являются производные пиримидинона, имеющие близкое строение с эндогенными азотистыми основаниями.
В настоящее время установлено, что в первую очередь N-замещенные оксопиримидина обладают полезными для фармацевтической науки свойствами в сочетании с низкой токсичностью. Некоторые из них проявляют психотропную активность, стимулируют регенерацию тканей, обладают противовоспалительными свойствами и влияют на иммунные процессы, а также показали свою высокую эффективность в качестве противовирусных и противоопухолевых средств [1].
Воспалительный процесс является универсальным ответом организма на деструктивное воздействие факторов различной этиологии, которые проявляются главным образом в виде гиперемии, отека, повышения температуры, боли и нарушений функций организма. Исходя из этого разработка новых высокоэффективных и безопасных активных фармацевтических субстанций с противовоспалительной активностью представляется актуальным направлением развития фармацевтики [2].
Оксопиримидины обладают сродством с эндогенными пиримидиновыми основаниями, и, как следствие, их противовоспалительное действие во многом основано на стимуляции механизмов образования белков и нуклеиновых кислот, усилении продуцирования гормонов коры надпочечников, а также активации процессов, связанных с пролиферацией клеток [3, 4].
Синтезированы ряды производные конденсированных производных пиридо[2,3-d]пиримидин-4-она, проявляющие анальгетическую и противовоспалительную активность. Среди препаратов, обладающих выраженным противовоспалительным действием и содержащих ядро пиримидина, выделяется 1-(4-метокси-6-метил-3-пиримидинил)-3-метил-5-метоксипиразол (меброн), используемый для лечения острых воспалительных состояний [5].
Во множестве научных работах описаны конденсированные производные 4-оксипиримидина, содержащие во 2-м положении гетероциклического ядра алифатические или ароматические заместители, в частности производные хиназолинона-4 [6, 7].
В более ранних работах сообщались результаты целенаправленного синтеза 2-й и 6-й алифатических производных пиримидин-4(1H)-он, обладающих антиэкссудативной активностью [8–10].
Целями данной работы являются целенаправленный синтез 2 винилензамещенных 4-(2,6-диалкил-4-оксопиримидин-1-ил)-бензсульфамида, оказывающих противовоспалительное действие, и подтверждение посредством первичного фармакологического скрининга целесообразности поиска новых НПВС среди 2-винилензамещенных пиримидин-4(1Н)-она.
Материал и методы исследования. Прохождение реакции, а также чистоту полученных веществ определяли посредством тонкослойной хроматографии (ТСХ) на пластинках Sorbfil. Для этой цели использовали подвижную фазу этанол и БУВ 4:1:2 (бутанол – уксусная кислота – вода). Детектирование результатов ТСХ осуществляли в УФ-свете при 256 и 354 нм и с использованием йодной камеры. Температуру плавления определяли на приборе ПТП(М) ТУ 92-891. Строение синтезированных соединений подтверждали ИК-спектрами, измеренными на приборе ИК-Фурье спектрометре ФСМ 1201, и спектрами 1H ЯМР, полученными на приборе «Bruker» в DMSO-d6 с использованием растворителя в качестве внутреннего стандарта.
Методика получения 2-винилензамещенных 4-(2,6-диалкил-4-оксопиримидин-1-ил)-бензсульфамида.
Исходный 4-(2,6-диметил-4-оксо-5-фенил-4H-пиримидин-1-ил)бензсульфамид в количестве 0,01 моль растворяют при нагревании в 4–7 мл диметилформамида. Далее прибавляют эквимолярное количество соответствующего альдегида в 3 мл этанола. Реакционную смесь кипятят 2–3 ч. После окончания процесса продукт выделяют из реакционной среды водой. Выделившийся при охлаждении реакционной среды осадок отфильтровывают и промывают водой. Полученный целевой продукт очищают перекристаллизацией из смеси этанола и ДМСО.
Синтезированы следующие вещества.
4-{2-[2-(4-Метоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (III). Данное вещество является пластинчатыми кристаллами со слабым характерным запахом. Выход продукта реакции 55%. Т. пл. 312–314°С (этанол). Растворимо в этиловом спирте, ДМФА, ДМСО. ИК спектр, ν, см-1: 1624 (C=O), 1607 (C=N), 1582 (C=C). Спектр 1H ЯМР (300 МГц), δ, м.д. в DMSO-d6: 1,70 (c, 3H, CH3); 3,75 (c, 3H, CH3); 5,983–6,033 (д, 1H, CH; J=15); 6,90–6,93 (д, 2H, ArH); 7,28–7,35 (м, 5Н, ArH); 7,39–7,60 (м, 2H, ArH); 7,60 (с, 2H, NH2); 7,80–7,86 (м, 3H, ArH, CH); 8,05–8,08 (д, 2Н, ArH).
4-{2-[2-(4-Этоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (IV). Полученный продукт представляет собой желтоватый порошок без запаха. Выход целевого продукта 58%. Т. пл. 253–255°С (этанол). Растворим в этиловом спирте, ДМФА, ДМСО. ИК спектр, ν, см-1: 1626 (C=O), 1609 (C=N), 1583 (C=C). Спектр 1H ЯМР (300 МГц), δ, м.д. в DMSO-d6: 1,42–1,46 (т, 3H, CH3); 2,12 (c, 3H, CH3); 4,31–4,38 (к. 2Н, СН2); 6,331–6,383 (д, 1H, CH; J=15,6); 6,99–7,03 (д, 2Н, ArH); 7,19–7,41 (к, 4H, ArH); 7,42-7,56 (м, 5H, ArH); 7,73–7,76 (д, 2H, ArH); 8,160-8,212 (д, 1H, CH; J=15,6); 8,48 (с, 2Н, NH2).
4-{2-[2-(4-Диметиламинофенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (V). Соединение представляет собой желтый кристаллический порошок или желтые кристаллы без запаха. Выход 66%. Т. пл. 306–308°С (этанол). Продукт растворим в этиловом спирте, ДМФА, ДМСО. ИК спектр, ν, см-1: 1622 (C=O), 1607 (C=N), 1597 (C=C). Спектр 1H ЯМР (300 МГц), δ, м.д. в DMSO-d6: 2,18 (c, 3H, CH3); 2,83 (д, 6H, CH3); 6,223–6,274 (д, 1H, CH; J=15); 6,47-6,60 (к, 4Н, Ar); 6,971–7,022 (д, 1H, CH; J=15,3); 7,18–7,23 (т, 2H, Ar); 7,41–7,57 (м, 5H, Ar); 7,73–7,76 (д, 2H, Ar); 8,63 (с, 2Н, NH2).
4-{2-[2-(4-Гидрокси-3-метоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (VI). Продукт является желтым мелкокристаллическим порошком. Выход целевого продукта 68%. Т. пл. 198–200°С (этанол). Мало растворим в этиловом спирте, хорошо – в ДМФА и диметилсульфоксиде. ИК спектр, ν, см-1: 1632 (C=O), 1609 (C=N), 1581 (C=C). Спектр 1H ЯМР (300 МГц), δ, м.д. в DMSO-d6: 1,72 (c, 3H, CH3); 3,68 (c, 3H, O-CH3); 5,871–5,922 (д, 1H, CH; J=15,3); 6,72–6,89 (м, 3H, ArH); 7,28–7,43 (м, 6Н, ArH); 7,61 (с, 2H, NH2); 7,75–7,86 (м, 3H, ArH, CH); 8,05–8,08 (д, 2Н, ArH); 9,62 (с, 1H, OH).
4-{2-[2-(3,5-Дибром-2-гидрокси-фенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (VII). Подученное соединение представляет собой желтый кристаллический порошок. Выход продукта реакции 94%. Т. пл. 220–222°С (этанол). Продукт растворим в этиловом спирте, ДМФА и ДМСО. ИК спектр, ν, см-1: 1631 (C=O), 1604 (C=N), 1581 (C=C). Спектр 1H ЯМР (300 МГц), δ, м.д. в DMSO-d6: 1,69 (с, 3Н, СН3); 6,339–6,390 (д, 1H, CH; J=15,3); 7,29–7,42 (м, 6Н, ArH); 7,61 (с, 2Н, NH2); 7,72–8,07 (м, 6Н, ArH, CH); 10,18 (с, уш., 1Н, ОН).
4-{2-[2-(2-Фторфенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (VIII). Подученное соединение представляет собой белый с желтоватым оттенком кристаллический порошок. Выход продукта реакции 62%. Т. пл. 311–312°С (этанол). Продукт растворим в этиловом спирте, ацетоне, ДМФА и ДМСО. ИК спектр, ν, см-1: 1633 (C=O), 1608 (C=N), 1589 (C=C). 1H ЯМР (300 МГц), δ, м.д. в DMSO-d6: 1,72 (c, 3H, CH3); 6,325–6,377 (д, 1H, CH; J=15,6); 7,20–7,22 (м, 2Н, ArH); 7,29–7,45 (м, 7H, ArH); 7,60 (с, 2H, NH2); 7,86–7,91 (м, 3H, ArH, CH); 8,05–8,08 (д, 2H, ArH).
4-[6-Метил-4-оксо-5-фенил-2-(2-тиофен-2-ил-винил)-4H-пиримидин-1-ил]-бензсульфамид (IX). Подученное соединение представляет собой желтый кристаллический порошок. Выход продукта реакции 86%. Т. пл. 205–206°С (этанол). Продукт растворим в этиловом спирте, ДМФА и ДМСО. ИК спектр, ν, см-1: 1669 (C=O), 1601 (C=N), 1580 (C=C). Спектр 1H ЯМР (300 МГц), δ, м.д. в DMSO-d6: 1,71 (с, 3Н, СН3); 5,826–5,877 (д, 1Н, СН; J=15,3); 7,09 (т, 1Н, ArH); 7,28–7,41 (м, 6Н, ArH); 7,59–7,61 (д, 3Н, NH2, ArH); 7,84–7,86 (д, 2Н, ArH); 8,007–8,057 (д, 1Н, СН; J=15); 8,09 (д, 2Н, ArH).
Исследование противовоспалительной активности проводилось на модели острого экссудативного воспаления. Первичный фармакологический скрининг осуществлялся в соответствии с методическими указаниями по выявлению противовоспалительной активности новых биологически активных соединений [11]. Оценка влияния веществ на острое экссудативное воспаление проведена на модели формалинового отека. Исследуемые вещества вводили перорально в дозе 50 мг/кг в виде водной суспензии за 1 ч до инъекции раствора формальдегида. Выбор дозы 50 мг/кг основан на ранее полученных данных, исходя из которых близкородственные соединения проявляли различные виды фармакологической активности при данной дозе. Для оценки выраженности воспалительной реакции рассчитывали прирост массы правой лапки через 3 ч после введения флогогена в процентах к массе левой лапки. Животные предварительно умерщвлялись путем дислокации шейных позвонков. В качестве контроля достоверности результатов биологического эксперимента использовали группу животных, которым вводили воду очищенную. Количество животных в группе – по 6 особей.
Для исследования использовали мышей-самцов линии Balb/C весом 22,0–24,0 г (на момент начала эксперимента). Разброс массы лабораторных животных не превышал 10%. Все животные содержались в стандартных условиях вивария при естественном освещении и были получены из питомника ФГУП «ПЛЖ “Рапполово”».
Животные содержались при температуре окружающего воздуха 22±2˚С и относительной влажности 65±5%. В исследовании для лабораторных животных использовался стандартный пищевой рацион с доступом к корму (Полнорационный комбикорм рецепт ПК-120 для содержания лабораторных животных, ГОСТ Р 50258-92, производитель ООО «Лабораторкорм»). Маркировка групп подопытных животных выполнялась путем проставления цветных меток.
Полученные результаты опытов подвергались анализу методом вариационной статистики. Проверка данных эксперимента на нормальность распределения осуществлялась с помощью критерия Колмогорова–Смирнова. Статистическую обработку результатов всех групп животных проводили путем вычисления среднего значения (М) и стандартной ошибки среднего значения (m) посредством пакета программ «StatPlus 2009». В зависимости от типа распределения результатов эксперимента в отношении к межгрупповым различиям они анализировались параметрическими или непараметрическими методами. Для нормального распределения данных в качестве параметрического критерия использовали критерий Стьюдента. Анализ для ненормального распределения значений осуществлялся с использованием в качестве непараметрического критерия U-критерия Манна–Уитни.
Результаты исследования и их обсуждение. В качестве исходного вещества для синтеза 2-винилензамещенных пиримидин-4(1H)-она использован 4-(2,6-диметил-4-оксо-5-фенил-4H-пиримидин-1-ил)-бензсульфамид (I), который, взаимодействуя с соответствующими альдегидами (II) в среде этанола и диметилформамида, образует целевые продукты (III-IХ) (рис. 1).
В предыдущих работах, посвященных реакции формирования стирильного фрагмента, был предложен метод синтеза 2-винилензамещенных в смеси этанола и диметилсульфоксида [12]. Диметилсульфоксид усиливает СН-кислотность метильной группы, тем самым активирует прохождение реакции. Исходный 4-(2,6-диметил-4-оксо-5-фенил-4H-пиримидин-1-ил)бензсульфамид (I) является труднорастворимым веществом, поэтому для проведения реакции в условиях гомогенного катализа потребовалось увеличение его количества по отношению к этанолу. Синтез протекает при достаточно длительном кипячении (3–4 ч), а ДМСО в этих условиях может частично разлагаться, что приводит к параллельному прохождению окислительно-восстановительных реакций. Исходя из этого для синтеза этой группы биологически активных соединений следовало заменить диметилсульфоксид на более устойчивый к нагреванию диметилформамид.
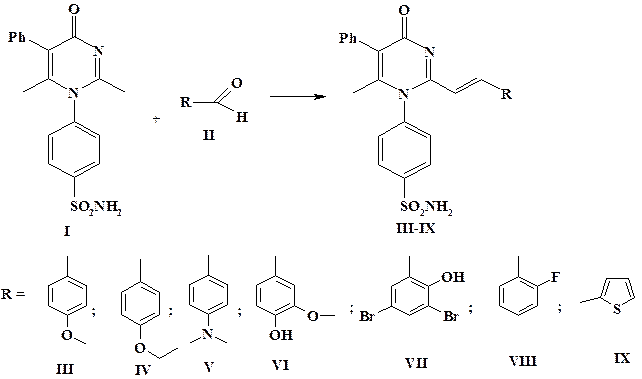
Рис. 1. Получение целевых 2-винилензамещенных 4-(2,6-диметил-4-оксо-5-фенил-4H-пиримидин-1-ил)-бензсульфамида
В ИК-спектрах полученных 2-виниленпроизводных наблюдаются соответствующие колебаниям гетероциклической карбонильной группы в области 1656–1620 см-1 и виниленовой связи в области 980–960 см-1, что косвенно характеризует трансоидную конфигурацию виниленовой группы. В спектрах 1Н ЯМР сигналы протонов виниленовой группы во 2-м положении 4-оксопиримидинового цикла проявляются в виде дублетов с константами спин-спинового взаимодействия более 14 Гц у всего ряда полученных соединений. Эти спектральные характеристики свидетельствуют о том, что двойная связь виниленового фрагмента имеет трансоидную конфигурацию и относятся Е-π диастеромерам.
Скрининговые фармакологические исследования противовоспалительной активности исследуемых соединений показали, что введение практически всех веществ сопровождалось достоверным снижением по отношению к контрольным значениям выраженности воспалительной реакции. В случае использования соединений с шифром VI и VII (табл. 1) наблюдается максимальный антиэкссудативный эффект, что позволяет предположить их выраженную противовоспалительную активность.
Таблица 1
Влияние исследуемых соединений на экссудативную фазу острого воспаления в дозе 50 мг/кг
|
Группы животных, № исследуемых веществ |
Прирост массы лапы, % |
|
Контрольная группа |
63,7±5,92 |
|
III |
41,3±6,95 P≥0,05 |
|
IV |
44,6±5,5 P≥0,051 |
|
V |
57,9±7,51 P≥0,05 |
|
VI |
35,1±3,46 P≤0,05 |
|
VII |
36,9±5,63 P≤0,05 |
|
VIII |
45,6±1,08 P≥0,05 |
|
IХ |
53,5±1,83 P≥0,05 |
|
Примечания: n = 6 – количество животных в группе, P – уровень достоверности по отношению к контрольной группе. |
|
Заключение. Осуществлен целенаправленный синтез семи 2-винилензамещенных производных 4-(2,6-диалкил-4-оксопиримидин-1-ил)-бензсульфамида. При использовании модели «формалинового отека» определена противоотечная активность полученных веществ. Максимальной противовоспалительной активностью обладают соединения-лидеры VI и VII. Введение виниленовых заместителей в положение 2-го ядра гетероцикла, содержащих гидроксифенильный фрагмент, приводит к достоверному снижению процента прироста массы лапки. Полученные результаты первичного фармакологического скрининга позволяют судить о перспективности целенаправленного синтеза новых НПВС в ряду 2-винилензамещенных пиримидин-4(1Н)-она.
Библиографическая ссылка
Кодониди И.П., Сочнев В.С., Терехов А.Ю., Сергеева Е.О., Рябухин И.Ю. СИНТЕЗ И ИЗУЧЕНИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТИ 2-ВИНИЛЕНПРОИЗВОДНЫХ 4-(2,6-ДИМЕТИЛ-4-ОКСО-5-ФЕНИЛ-4H-ПИРИМИДИН-1-ИЛ)-БЕНЗСУЛЬФАМИДА // Современные проблемы науки и образования. 2021. № 4. ;URL: https://science-education.ru/ru/article/view?id=31053 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.31053



