Дефекты гиалинового слоя крупных суставов обладают ограниченной способностью к регенерации [1]. В настоящее время современным хирургам доступен большой спектр различных методов, позволяющих приостановить дегенеративные процессы, однако в полном объёме данная проблема до сих пор не решена [2-4]. Перспективным направлением является использование клеточно-инженерных конструкций (КИК), представляющих собой биодеградируемый полимер (скаффолд), покрытый модифицированной культурой клеток [5]. Модификацию клеток проводят с целью придания им дополнительных свойств. К примеру, увеличенный синтеза белков внеклеточного матрикса или изменение экспрессии ключевых генов хондрогенеза способствует более эффективной и специфической пролиферации культуры и формированию устойчивого к нагрузкам гиалиноподобного регенерата.
Наряду с трансдукцией и белковой стимуляцией одним из часто используемых методов модификации клеточной культуры является липофекция [1; 6; 7]. Липофекция - это невирусный метод внесения генетической информации с помощью рекомбинантной плазмиды и липосомных частиц. Этот известный с середины 60-х годов ХХ века метод получил широкую популярность в наше время благодаря простоте использования и относительной эффективности. Его применение не вносит изменения в геном клеточной культуры, не требует при проведении экспериментальных работ использования особых мер предосторожности и в случае положительного результата не накладывает ограничений на использование модифицированной культуры в клинической практике. Для маркирования клеточной культуры обычно используется встроенный в плазмиду ген флюоресцентного зеленого белка (GFP), который позволяет отследить эффективность проведённой модификации. В качестве клеточной культуры для тканевой инженерии гиалинового хряща применяют стволовые клетки мезенхимного происхождения по причине их повышенного пролиферативного потенциала, способности дифференцироваться в зрелые (терминально дифференцированные) клеточные элементы гиалиновой ткани – хондроциты [1; 8; 9]. Таким образом, липофекция клеточной культуры мезенхимальных стволовых клеток в первом приближении является логичным выбором метода модификации в клеточной инженерии гиалинового хряща.
Целью данного исследования была оценка эффективности трансфецирования первичной культуры мезенхимальных мультипотентных стромальных клеток (ММСК) с помощью созданной плазмиды pEGFP-N3-tgfβ3 и возможности дальнейшего использования модифицированной культуры клеток в составе клеточно-инженерной конструкции для замещения дефекта гиалинового хряща.
Материалы и методы исследования
Культивирование клеточной культуры
В качестве клеток использовалась первичная культура мезенхимальных мультипотентных стромальных клеток, выделенная из костного мозга бедренной кости половозрелой крысы. Клеточную суспензию забирали в стерильных условиях и культивировали до 3-го пассажа с использованием адгезионного пластика TPP (Швейцария). Принадлежность к данной популяции определяли с помощью методики проточной цитометрии (Cytoflex. Beckman coulte).
Создание экспрессионной плазмиды
Экспрессионную плазмиду получили на основе вектора pEGFP-N3. Целевой участок гена tgfβ3 был амплифицирован с плазмиды pLVE-hTGFB3-IRES-Red (Addgene) с использованием точной полимеразы Deep Vent (NEB,USA). Встраивание гена tgfβ3 производили по сайтам BamHI и HindIII. Лигирование производили с помощью Т4 лигазы (NEB, USA). Наличие целевой вставки в плазмиде подтверждали с помощью секвенирования и гельэлектрофореза в 1,2%-ном агарозном геле.
Трансфецирование клеточной культуры
Трансфецирование клеточной культуры ММСК производили методом липофекции с помощью набора Lipofectamin 3000 (Thermofisher, USA) согласно протоколу производителя на 3, 5 и 7 пассажах. Подготовку клеточной культуры также проводили согласно этому протоколу. В качестве вектора использовали созданную экспрессионную плазмиду, содержащую ген tgfβ3. Эффективность трансфецирования клеток оценивали методом проточной цитометрии на 3-и и 7-е сутки после липофекции. В качестве контроля для исследования жизнеспособности и эффективности трансфекции использовали аналогичную культуру клеток без процедуры модификации, так как необходимо было учесть собственную флюоресценцию немодифицированных клеток. Критерием отнесения к трансфецированной субкультуре являлось превышение уровня сигнала флюоресценции на порядок и выше от значения флюоресценции пика нетрансфецированной культуры. Дополнительным контролем эффективности являлась оценка флуоресценции на микроскопе EVOS FL. Выживаемость клеток оценивали с помощью проточной цитометрии с дополнительным использованием бромида этидия, который проникает в клетки с повреждённой мембраной и не проникает в живые клетки. После получения данных по эффективности трансфекции и выживаемости клеток высчитывали средние результаты получившихся экспериментов по трём повторностям.
Результаты исследования и их обсуждение
В результате выделения клеток из костного мозга половозрелой крысы и их последующего культивирования до третьего пассажа была получена культура мезенхимальных мультипотентных стромальных клеток костного мозга (ММСК), которые, по данным проточной цитометрии, стабильно экспрессировали поверхностные маркеры CD90 и одновременно не экспрессировали маркеры CD45.
С помощью гельэлектрофореграммы была установлена правильность лигирования вставки внутрь вектора и получения искомой рекомбинантной плазмиды. Последовательность полученной рекомбинантной плазмиды pEGFP-N3-tgfβ3 на заключительном этапе была подтверждена с помощью секвенирования.
Липофекция культуры ММСК
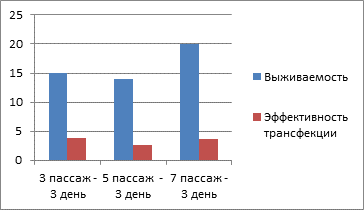
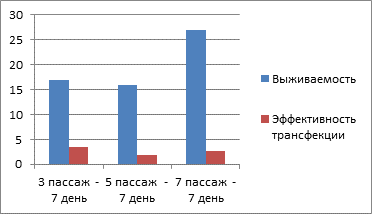
По результатам проведённых исследований установлено, что трансфецирование снижало долю жизнеспособных клеток в культуре в сравнении с контролем до 14–27% в зависимости от срока наблюдения и пассажа (рис. 1). При этом среди выживших клеток доля трансфецированных клеток составляла 10–25%.
|
|
|
A |
|
|
|
Б |
Рис. 1. Средняя доля жизнеспособных и модифицированных клеток в культуре в зависимости от пассажа (3, 5 и 7-й пассажи) на 3-й день наблюдения (A) и средняя доля жизнеспособных и модифицированных клеток в культуре в зависимости от пассажа (3, 5 и 7-й пассажи) на 7-й день наблюдения (Б)
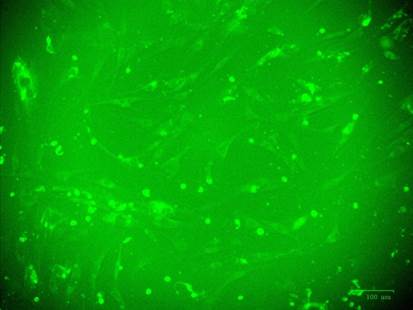
Несмотря на очень низкую долю модифицированных жизнеспособных клеток, к 7-му дню культивирования (0,27% к контролю), по данным флюоресцентной микроскопии, определялось интенсивное свечение, что, по-видимому, необходимо оценивать как «ложноположительный результат» оценки эффективности трансфекции (рис. 2).
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
Б |
|
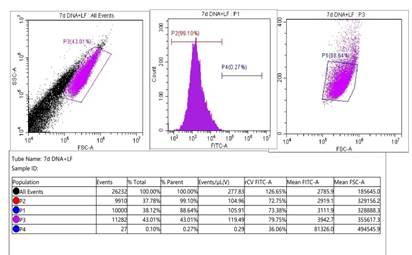
Рис. 2. А – микрофотография клеточной культуры после трансфекции на 7-е сутки наблюдения, полученная при флюоресцентной микроскопии. Контрольный штрих указан на рисунке. Б – результаты цитофлюорометрического анализа культуры клеток после трансфекции на 7-е сутки наблюдения. P3 – анализируемые события. P1 - анализируемые клеточные элементы. P2 – нетрансфецированные клетки. P4 – трансфецированные клетки
Необходимо отметить, что по результатам проведённых исследований было установлено, что на всех пассажах наблюдения на 7-е сутки доля трансфецированных клеток уменьшалась, по сравнению с 3-ми сутками наблюдения (рис. 1).
Проведенное исследование показало, что трансфекция методом липофекции является цитотоксичной процедурой, что согласуется с результатами Li-Ming Li и соавт., которые также подтвердили гибель до половины клеток в течение первых 24 часов [10] при использовании липофектамина. В наших экспериментах средняя выживаемость трансфецированных клеток находилась в пределах от 12 до 26% от количества клеток в контроле в зависимости от времени наблюдения и пассажа, причем количество жизнеспособных клеток уже через сутки после трансфекции уменьшилось в среднем в 4 раза. В экспериментах McMillan A. и соавт. [11] были представлены данные с трансфекцией ММСК, однако анализ её эффективности проводился по флюоресценции клеточного супернатанта, причем также отмечалась цитотоксичность трансфецирования. Более того, с помощью метода проточной цитометрии в наших исследованиях было зафиксировано, что часть клеток, которые при проведении флюоресцентной микроскопии были отнесены к живым клеткам, находились в предапоптотическом состоянии и в дальнейшем, возможно, погибли.
По данным проточной цитометрии, доля модифицированных клеток среди выживших составила 10-25% (рис. 1). Применяемый нами набор для липофекции (Lipofectamin 3000) широко используется исследователями для аналогичных экспериментов по трансфецированию ММСК. При этом Fernanda Borges Duarte с соавт. [12] в своей работе применяли аналогичный реагент для трансфекции, но проточную цитометрию использовали только для анализа изменения медианы флюоресцентной светимости опытной группы в сравнении с контролем и не оценивали долю живых трансфецированных клеток. В ряде исследований авторы указывают сходные результаты по эффективности трансфекции, однако Zhonghua Yi Xue Za Zhi в своей работе вообще не пользовался проточной цитометрией [13]. S. Kim и соавт. для анализа эффективности трансфекции применяли Western Blot анализ и не оценивали выживаемость клеток и эффективность трансфецирования с помощью проточной цитометрии [14]. Manish Kumar и соавт. вообще не оценивали жизнеспособность клеток, а эффективность трансфекции измеряли только с помощью флюоресцентного микроскопа, что, на наш взгляд, может давать ложноположительные результаты [15]. В работе Xia Cao и соавт. проводили анализ эффективности трансфекции косвенным методом по увеличению синтезированного рекомбинантного белка, кодируемого геном в плазмиде, что, на наш взгляд, является неверным подходом при анализе и интерпретации промежуточных этапов, так как при этом не анализировались многие промежуточные результаты, связанные с количеством жизнеспособных клеток, количеством трансфецированных клеток и т.д. [16]. В целом анализ научных публикаций свидетельствует о низкой эффективности метода трансфецирования. К примеру, P. Díaz и соавт. [17] показали эффективность трансфекции на уровне 15%. Кроме того, Melissa Hoare и соавт. показали, что эффективность трансфекции первичной культуры ММСК зависит от видовой принадлежности [18]. В исследовании данных авторов трансфекция клеток кроликов происходила с более низкой эффективностью, чем ММСК крысы и человека.
В нашем исследовании во всех исследуемых пассажах (3, 5 и 7-й) доля трансфецированных клеток в динамике с 3-х по 7-е сутки снижалась. Вероятно, это обусловлено принципиальной транзиентностью генетической модификации клеточной культуры методом трансфецирования и нестабильностью плазмиды в первичной культуре клеток млекопитающих. На наш взгляд, с дальнейшим увеличением срока наблюдения доля трансфецированных клеток будет уменьшаться. Учитывая то, что для последующих экспериментов мы планируем использовать только живые трансфецированные клетки, расчетная доля пригодных клеточных элементов составляет не более 2-4% от общего количество ММСК в культуре. Это подтверждается целым рядом публикаций [8; 10; 17], в которых авторы отмечали столь же низкий процент получаемых живых трансфецированных клеток от начального количества клеточных элементов.
Проведенное исследование показало, что контроль эффективности трансфекции с помощью флюоресцентного микроскопа дает ложноположительные результаты. На 7-е сутки после трансфекции регистрировали флюоресцентное свечение, однако, по данным проточной цитометрии, доля жизнеспособных трансфецированных клеток не превышала 0,27% от контрольной культуры (рис. 2). По нашему мнению, контроль эффективности трансфекции и выживаемости клеток необходимо проводить с использованием методики проточной цитометрии, так как она является более точным и объективным методом исследования и позволяет получить количественный результат.
В целом следует признать, что по результатам проведённых исследований добиться эффективной длительной трансфекции клеток с приемлемой выживаемостью нам не удалось. Вероятно, оптимизировав условия и приложив значительные усилия, возможно несколько увеличить эффективность модификации и снизить цитотоксичность процедуры, однако лишь в незначительных пределах, что и было показано в работе [8], однако наш выбор целевого гена tgfβ3 для модификации клеточной культуры был обусловлен тем, что именно этот ключевой цитокин отвечает за хондрогенную пролиферацию ММСК [19]. Для использования внутри скаффолда трансфецированной клеточной культуры, на наш взгляд, она должна характеризоваться стойкой жизнеспособностью, так как апоптоз клеток внутри трёхмерного полимерного объекта (в условиях ограниченной диффузии) значительно ухудшит результаты применения такой клеточно-инженерной конструкции.
Заключение
Таким образом, трансфецирование с помощью липофекции не может рассматриваться как эффективный метод внесения изменений в первичную клеточную культуру для дальнейшего применения в области тканевой инженерии в составе биодеградируемого полимера. При этом для контроля жизнеспособности трансфецированных клеток необходимо применять объективные методы анализа, к примеру проточную цитометрию.
Список сокращений
КИК – клеточно-инженерная конструкция
ММСК - мезенхимальные мультипотентные стромальные клетки
ПЦР – полимеразная цепная реакция
GFP – зеленый флюоресцентный белок
Работа выполнена при поддержке грантов СПбГУ ID: 73023349 и ID: 73024371. Работа была выполнена в «НМИЦ ТО им Р.Р. Вредена», Институте цитологии РАН и в лаборатории амилоидов СПбГУ.
Библиографическая ссылка
Божокин М.С., Божкова С.А., Нащекина Ю.А., Сопова Ю.В., Рубель А.А., Хотин М.Г. ИСПОЛЬЗОВАНИЕ ТРАНСФЕКЦИИ МЕЗЕНХИМНЫХ МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК (ММСК) В КАЧЕСТВЕ СИСТЕМЫ МОДИФИКАЦИИ КУЛЬТУРЫ КЛЕТОК ДЛЯ ДАЛЬНЕЙШЕГО ИСПОЛЬЗОВАНИЯ ПРИ ЗАМЕЩЕНИИ ДЕФЕКТОВ ГИАЛИНОВОГО ХРЯЩА // Современные проблемы науки и образования. 2021. № 4. ;URL: https://science-education.ru/ru/article/view?id=31052 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.31052