В мире ежегодно выявляют более 500 тыс. новых случаев рака шейки матки (РШМ) и более 260 тыс. летальных исходов при этой патологии, что превышает показатели при любых других гинекологических злокачественных опухолях. При выявлении РШМ на ранних стадиях общая выживаемость пациенток, как правило, достаточно высока, но при наличии метастазов в лимфатических узлах выживаемость снижается в 4 раза [1]. По существующим в настоящее время стандартам лечение ранних стадий опухолей шейки матки включает радикальную гистерэктомию в сочетании с лимфаденэктомией или химиолучевой терапией, при которых показатели выживаемости сходны. Химио- и лучевая терапия применяется для пациентов с метастазами в лимфатических узлах, при этом начальное хирургическое вмешательство не нужно. Однако, поскольку пока невозможно с высокой точностью и эффективностью определить наличие метастазов в тазовых и парааортальных лимфатических узлах, врачи-онкологи не могут определять стратегию лечения и избегать травмирующих операций [2]. Молекулярно-генетические маркеры как средство выявления метастазов в лимфатических узлах могут иметь важное терапевтическое значение. В качестве подобного маркера может выступать показатель копийности генетических локусов (CNV). CNV является критическим генетическим событием, способствующим формированию и прогрессированию (метастазированию) злокачественных новообразований [3, 4].
Амплификация генов или их фрагментов является распространенным механизмом активации онкогенов. При злокачественных опухолях шейки матки также часто наблюдается увеличение количества копий участков хромосом 1q, 3q и 5p [5]. Так, например, в исследовании D. Wangsa и соавторов [1] обнаружена амплификация ряда генов, расположенных в области 3q. Увеличение копийности участка 3q, по данным исследования с использованием сравнительной геномной гибридизации, было ассоциировано с метастатическим поражением лимфатических узлов. В этой работе также было установлено, что показатель копийности генов LAMP3, PROX1 и PRKAA1 позволяет статистически значимо прогнозировать метастазы в лимфатические узлы при РШМ [1].
Анализ базы данных TCGA (The Cancer Genome Atlas) и литературных источников [1, 2] позволил выделить ряд генов-кандидатов: LAMP3, PRKAA1, TORC2, FOXO3, HDAC5, MEF2C, MLXIPL, EP300, HNF4A, TP53, SREBF1, SREBF2, PPARGC1A и CCND1.
Целью исследования стал анализ показателей копийности генетических локусов PRKAA1, LAMP3, SREBF1-2, TORC2, HNF4A, HDAC5, MEF2C, MLXIPL, FOXO3, EP300, TP53, PPARGC1A и CCND1 в нормальных клетках, в первичных опухолевых клетках и в клетках опухолевых метастазов из лимфатических узлов у больных РШМ.
Материалы и методы исследования
Для проведения данного исследования в качестве исходного материала брали срезы тканей из FFPE-блоков 50 пациентов с диагнозом «рак шейки матки» и метастатическим поражением регионарных лимфоузлов. Срезы размером 3 мкм фиксировали на особых предметных стеклах, покрытых полиэтилен-нафталатной мембраной. Клетки опухоли, опухолевых метастазов и нормальных тканей выделяли со срезов с помощью лазерной микродиссекции с бесконтактным захватом – использовалась система Palm MicroBeam производства Carl Zeiss. [6, 7]. Из извлеченных клеток методом фенол-хлороформной экстракции проведено выделение 150 образцов ДНК (50 образцов из клеток первичной опухоли, 50 образцов из клеток опухолевых метастазов и 50 образцов из клеток нормальных тканей).
Предварительно проведенный биоинформационный скрининг с использованием базы TCGA (The Cancer Genome Atlas, https://portal.gdc.cancer.gov/) позволил сформировать перечень, состоящий из 14 генов (LAMP3, PRKAA1, TORC2, FOXO3, HDAC5, MEF2C, MLXIPL, EP300, HNF4A, TP53, SREBF1, SREBF2, PPARGC1A и CCND1). Для последующего определения показателя относительной копийности генов методом Real-Time qPCR с использованием базы данных NCBI GenBank были разработаны последовательности 16 пар синтетических олигонуклеотидов, включая 2 пары для референсных локусов (ACTB, GAPDH) (табл. 1).
Таблица 1
Нуклеотидные последовательности праймеров для определения показателя копийности генов
|
№ |
Генетический локус |
Последовательность прямого праймера |
Последовательность обратного праймера |
|
1. |
GAPDH |
CGCTGAACGGGAAGCTCACT |
GCAGGTTTTTCTAGACGGCAGT |
|
2. |
ACTB |
CCACCCTGAAGTACCCCATCG |
TGTAGAAGGTGTGGTGCCAGA |
|
3. |
LAMP3 |
CTTCCTGTGATTGGGGCCAT |
CCCCCGGGCAACAATTAGAT |
|
4. |
PRKAA1 |
CATGCGCAGACTCAGTTCCT |
GTAGTGGCCGATCTTCACCC |
|
5. |
TORC2 |
GCTCTGACTCTGCCCTTCAT |
TAGCAGGTACTTTGGGGTCC |
|
6. |
FOXO3 |
GGCCCGGGATAACCAACTCT |
CTCCACTTCGAGCGGAGAGA |
|
7. |
HDAC5 |
TCCCGTCCGTCTGTCTGTTA |
TCGTTGGGAGAGTTCATGCC |
|
8. |
TP53 |
GGTCGGTGGGTTGGTAGTTT |
GTGTGGGATGGGGTGAGATT |
|
9. |
MEF2C |
GAAGCACTTCAACGCTGGAC |
TGCACAGCTCAGTTCCCAAA |
|
10. |
MLXIPL |
AGCCTCTCTTCTCTCCCAGG |
AAAGGCAGGCTCCGAATACC |
|
11. |
EP300 |
TCGGCGAATTTGTGCTCTTG |
AGAGGGATGCGGACTCGATA |
|
12. |
HNF4A |
CCCCCAGTCATTCTGGGAAC |
GGATGAGGTTGGGTTGGAGG |
|
13. |
SREBF1 |
CCTCCATGGGGTCAGTTGTC |
GACTTCTTGCAGGGAGACCC |
|
14. |
SREBF2 |
CACAGGCTCCAACTCTGCAA |
CTGGATGATCCTCGTCTGCG |
|
15. |
PPARGC1A |
CCGAGAGTTTCCGTTCCCTT |
AAGAGGGTGTCTTCCGACAG |
|
16. |
CCND1 |
TGAGGGACGCTTTGTCTGTC |
GCCTTTGGCCTCTCGATACA |
ПЦР-амплификация проводилась в термоциклере CFX96 (Bio-Rad, США) для каждой пробы в трех технических повторах. Усредненные данные по каждому гену-мишени выравнивались по усредненному показателю референсных генов – величина ΔCt (т.е. ΔCt = Ct(среднее гена мишени) – Ct(среднее геометрическое референсных генов)). Относительную копийность генетического локуса (rC) вычисляли по формуле rC= Ē-ΔCt , где Ē – эффективность реакции амплификации, рассчитанная по формуле Ē = 10-1/k , где, в свою очередь, k – коэффициент из линейного уравнения C(T)=k•logP0+b, полученного путем аппроксимации экспериментальных данных (Ē=1,971). Далее определяли значение медианы rCоп1 для опухолевых клеток (или для образцов из метастазов rCоп2) и медианы rCн для образцов нормальных клеток по каждому локусу и вычисляли значение FC (fold change, кратность изменения) копийности генетического локуса в опухолевых образцах по отношению к нормальным: FC=rCопухоль(1 или 2)/rCнорма=1,971-ΔCt(опухоль1-2)/ 1,971-ΔCt(норма) [8].
Биоинформационный анализ данных выполняли с использованием языка программирования R. Критерий Колмогорова–Смирнова использовали, чтобы оценить нормальность распределения показателей. Значимость различий проверяли с использованием критерия Манна–Уитни и поправки Бонферрони (для учета множественного сравнения) [9]. Кластеризацию генетических локусов по выполняемой ими функции проводили с помощью стандартного алгоритма FMD (Functional module detection), основанного на методе k-ближайших соседей и Лувенском методе выделения сообщества тесно связанных генов в больших сетях. Значение Q для каждого члена подобной сети, связанного с функциональными модулями, рассчитывается с использованием критерия Фишера и поправки Бенджамини–Хохберга [6].
Результаты исследования и их обсуждение
В ходе нашего исследования выявлены статистически значимое (р<0,05) увеличение показателя копийности генетических локусов LAMP3 и TORC2 в 2,5 и 3,2 раза соответственно, а также уменьшение показателя копийности генетических локусов TP53 и FOXO3 в 2,3 и 2,0 раза соответственно в клетках первичной опухоли относительно нормальных клеток шейки матки. Эффект одновременного изменения копийности генов LAMP3, TORC2, TP53 и FOXO3 наблюдался у 60% выборки, а изменение копийности генов LAMP3 и TP53 – у 80% выборки. В клетках регионарных метастазов зафиксированы статистически значимое (р<0,05) увеличение показателя копийности локусов CCND1 и TORC2 в 2,0 и 3,5 раза соответственно, а также снижение копийности гена PPARGC1A в 2,1 раза и гена TP53 в 1,8 раза относительно нормальных клеток шейки матки (рис. 1).
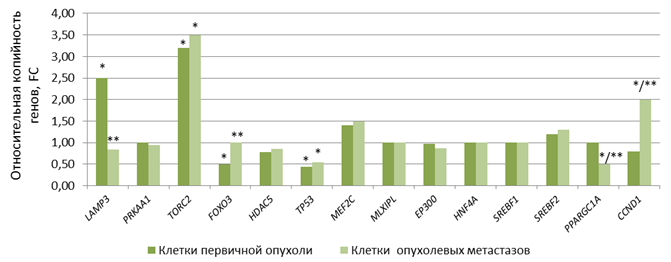
Рис. 1. Уровень относительной копийность генетических локусов в клетках первичной опухоли и опухолевых метастазов. * – статистически значимые отличия от копийности в нормальных клетках (р<0,05), ** – статистически значимые отличия от копийности в клетках первичной опухоли (р<0,05)
Эффект одновременного изменения копийности генов CCND1, TORC2 и PPARGC1A, TP53 наблюдался у 70% выборки, а изменение копийности генов CCND1 и TORC2 – у 85% выборки. Клетки первичной опухоли и метастазов отличались по копийности генов CCND1 (в 2,5 раза (р<0,05) выше в клетках метастазов), LAMP3 (в 3,0 раза (р<0,05) ниже в клетках метастазов), PPARGC1A (в 2,0 раза (р<0,05) ниже в клетках метастазов) и FOXO3 (в 2,0 раза (р<0,005) выше в клетках метастазов). Статистически значимых отличий в копийности генов PRKAA1, HDAC5, MEF2C, MLXIPL, EP300, HNF4A, SREBF1 и SREBF2 между нормальными клетками, клетками первичной опухоли и клетками опухолевых метастазов из лимфатических узлов не обнаружено (рис. 1).
Использование алгоритма FMD (Functional module detection) позволило разделить перечень исследуемых генов на 3 функциональных модуля (кластера), связанных с регуляцией следующих ключевых сигнальных путей: клеточный ответ на уровни питательных веществ, клеточный ответ на внешний раздражитель, регуляция изменения конформации ДНК, гомеостаз анатомической структуры, регулирование стабильности белка и др. (рис. 2, табл. 2).
Таблица 2
Кластеризация генов по выполняемой функции или участию в сигнальных путях
|
Кластер/модуль |
Сигнальный путь |
Q value |
Гены |
|
М1 |
cellular response to extracellular stimulus |
0.00013871 |
2 |
|
starvation cellular response |
0.00014058 |
||
|
nutrient levels cellular response |
0.00015050 |
||
|
starvation response |
0.00015751 |
||
|
nutrient levels response |
0.00016011 |
||
|
response to extracellular stimulus |
0.00016054 |
||
|
cellular response to external stimulus |
0.00016700 |
||
|
response to organonitrogen compound |
0.00066304 |
||
|
М2 |
DNA conformation change |
0.00110117 |
6 |
|
anatomical structure homeostasis |
0.00164874 |
||
|
М3 |
intracellular receptor signaling pathway |
0.00113906 |
5 |
|
regulation of protein stability |
0.00168551 |
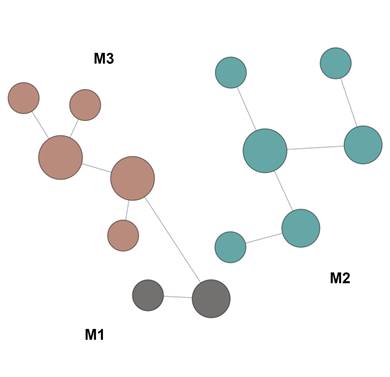
Рис. 2. Визуализации кластеризации генов по выполняемой функции или участию в сигнальных путях
Ген LAMP3 (Lysosomal-associated membrane protein 3) кодирует гликопротеин лизосомальной мембраны из семейства белков LAMP, экспрессируется в лимфоидных органах и в дендритных клетках. Повышенная экспрессия данного гена наблюдается в клетках злокачественных опухолей пищевода, кишечника, желудка, груди и ряда других тканей [10].
TORC2 является коактиватором транскрипции для транскрипционного фактора CREB и центральным регулятором экспрессии глюконеогенных генов в ответ на цАМФ [11]. Считается, что TORC2 управляет онкогенезом при различных видах рака [12].
Кодируемый геном TP53 транскрипционный фактор регулирует клеточный цикл, выполняет функцию супрессора образования злокачественных опухолей. Мутации в гене TP53 обнаруживаются в клетках около 50% известных злокачественных опухолей [13].
Ген FOXO3 кодирует белок из семейства факторов транскрипции Forkhead. Эти факторы транскрипции участвуют в регуляции сигнального пути PI3K. [14] FOXO3 также является триггером апоптоза за счет активации генов, необходимых для гибели клеток, таких как Bim и PUMA [15], или подавления антиапоптотических белков, таких как FLIP [16]. Гопинатх и иные (2014) [17] показали участие FOXO3 в регуляции сигнального пути Notch и самообновлении стволовых клеток. FOXO3 участвует в онкогенезе [18]. Подавление активности FOXO3 наблюдается при злокачественных опухолях (например, по увеличению активности Akt в результате потери PTEN).
Ген PPARGC1A (Peroxisome proliferator-activated receptor gamma coactivator 1-alpha) является основным регулятором глюконеогенеза в печени, вызывающим повышенную экспрессию генов, участвующих в энергетическом метаболизме [19]. Этот ген также служит главным регулятором в митохондриальном биогенезе [20]. Кодируемый им белок обеспечивает прямую связь между внешними физиологическими стимулами и регуляцией митохондриального биогенеза. Подтверждено влияние этого белка на поляризацию макрофагов посредством STAT6/PPAR и ингибирование образования провоспалительных цитокинов [21].
Копийности генов можно рассматривать как показатель нестабильности генома, поэтому можно сказать, что в клетках опухолевых метастазов у больных РШМ нестабильность генома выражена столь же значительно, как и в клетках первичной опухоли этих больных, при этом в процесс опухолевой трансформации включаются несколько другие гены (рис. 1). Схожесть молекулярного профиля первичной и метастатической опухоли в данном случае можно попытаться объяснить общностью происхождения этих клеток, а отличия по копийности ряда генов – клональной эволюцией этих клеток, обеспечившей их выживание в области метастатических ниш.
Заключение
Таким образом, клетки первичной опухоли и опухолевые клетки метастазов из лимфатических узлов отличаются по уровню копийности генов от нормальных клеток шейки матки. Соответственно, показатель копийности генов LAMP3, TORC2, TP53 и FOXO3 может иметь потенциал для диагностики первичной опухоли шейки матки, а показатель копийности генов LAMP3, FOXO3, CCND1 и PPARGC1A – для диагностики ее метастазов в регионарные лимфатические узлы.
Библиографическая ссылка
Кечерюкова М.М., Снежко А.В., Вереникина Е.В., Меньшенина А.П., Адамян М.Л., Арджа А.Ю., Кечерюкова Т.М. ОСОБЕННОСТИ КОПИЙНОСТИ ГЕНОВ В НОРМАЛЬНЫХ КЛЕТКАХ, КЛЕТКАХ ПЕРВИЧНОЙ ОПУХОЛИ И КЛЕТКАХ ОПУХОЛЕВЫХ МЕТАСТАЗОВ ИЗ ЛИМФАТИЧЕСКИХ УЗЛОВ У БОЛЬНЫХ РАКОМ ШЕЙКИ МАТКИ // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30904 (дата обращения: 05.02.2026).
DOI: https://doi.org/10.17513/spno.30904



