Некротический энтероколит является тяжелым приобретенным заболеванием желудочно-кишечного тракта неонатального периода. В последние годы наблюдается тенденция увеличения этого заболевания не только среди недоношенных, но и у доношенных новорожденных. Хотя во многих научно-исследовательских работах основная роль в этиологии НЭК отводится недоношенности, тенденция повышения частоты встречаемости НЭК среди доношенных новорожденных ставит под сомнение эту гипотезу [1]. Этиология НЭК является многофакторной и зависит от гестационного возраста пациента. Высокий процент смертности среди новорожденных при НЭК (30%) и сепсисе (70%) способствует более глубокому изучению и проведению дифференциальной диагностики этих двух патологических состояний [2]. Необходимо выявление новых биомаркеров, которые могли бы помочь в проведении дифференциации НЭК от болезней со схожими симптомами [3; 4]. Дифференциальную диагностику НЭК важно провести с сепсисом, спонтанной перфорацией кишечника, вирусным энтероколитом, энтероколитом, индуцированным молочным белком. Эти заболевания имеют похожие клинические симптомы, но различаются по патогенезу и методам лечения [5].
Цель исследования: выявить диагностическую значимость биомаркеров NO, ЭПО и Са+2 в дифференциации некротического энтероколита от сепсиса у доношенных новорожденных.
Методы и материалы исследования
Проспективное исследование случай-контроль проводилось в отделениях интенсивной терапии и патологии доношенных новорожденных госпиталя Научно-исследовательского института педиатрии имени К.Я. Фараджевой, в городе Баку Азербайджана. Обследуемые новорожденные были приняты в нашу клинику из родильных домов города Баку и других районов Азербайджана. Критериями включения в группу исследования были наличие соответствующих клинических абдоминальных (вздутие живота, рвота с желчью, гиперемия передней стенки или болезненность живота, отсутствие или учащение стула, кровь в стуле) и системных признаков (нарушение сознания различной степени, дыхательная недостаточность, сердечно-сосудистая недостаточность, мраморность или цианотичность кожи) НЭК у доношенных новорожденных. Сбор данных проводился у больных, поступивших в наш госпиталь в первые две недели постнатальной жизни, большинство из которых были в раннем неонатальном возрасте. Сбор данных и соответствующие анализы у младенцев, в возрасте старше двух недель, не проводились. Группы исследования формировали методом «случай-контроль», при этом статистически значимых межгрупповых различий по возрасту, полу, акушерскому и соматическому анамнезу матерей не было. Первую группу составили 83 новорожденных с НЭК, вторую – 17 пациентов с септическим осложнением течения болезни.
Анализы и статистическая обработка результатов исследования были проведены с использованием Python 3 – sklearn 0.22 и scipy 1.6.1. Статистический анализ полученных цифровых данных был выполнен по критерию Манна-Уитни и ROC-curve (receiver operating characteristic curve) анализа. Мы определили медиану, а также 1 и 3 квартили (Median [Q1;Q2]).
У новорожденных в плазме крови были определены уровни NO колориметрическим методом (Caymans Nitrate/Nitrite Colorimetric Assay Kit, Canada) на приборе ELISYS UNO HUMAN, ЭПО иммуноферментным анализом Human (EPO) ELISA Kit (Canada). Уровень ионов кальция был определен фотометрическим тестом на аппарате BioScreen MS-2000. Показатели Са+2 были взяты из медицинских карт пациентов.
Результаты исследования и их обсуждение
Исследование было проведено с января 2017 по май 2019 г. Были обследованы 100 больных доношенных новорожденных с НЭК I (53 больных), НЭК II (30 больных), НЭК III (17 больных) стадиями болезни по классификации M.J. Bell. При поступлении в стационар для каждого больного были составлены медицинские карты с подробным описанием анамнестических и клинических данных, клинического диагноза, результатов проведенных обследований. У новорожденных гестационный возраст был в пределах от 37 до 42 недель. Масса тела детей колебалась в пределах от 2500 до 4400 граммов. 36 новорожденных принадлежали женскому полу, а 64 – мужскому. У 83 пациентов был диагностирован НЭК без септического осложнения течения болезни. У 17 больных было выявлено септическое осложнение течения некротического энтероколита. НЭК+сепсис наблюдался у новорожденных с НЭК I (4 больных), НЭК II (3 больных) и НЭК III (10 больных). У троих детей с НЭК I+сепсис беременность матерей протекала на фоне внутриутробной инфекции, а у одного был выявлен мекониальный илеус. У больных с НЭК I заболевание проявилось в виде неспецифических признаков общей интоксикации (нарушение деятельности нервной, сердечной и дыхательной систем) и гастроинтестинальных проявлений (вздутие живота и рвота с желчью), рентгенологически - метеоризма и расширения кишечных петель. В клинической картине НЭК II, НЭК III и НЭК+сепсис имеются одинаковые симптомы, такие как расстройство сознания, вялость и адинамия, дыхательная недостаточность, гипертермия, вздутие живота с отёчностью передней стенки, рвота с желчью, неустойчивый стул. Однако в клинике у пациентов с НЭК II и НЭК III доминировало проявление гипоксического фактора - со стороны центральной нервной системы (внутричерепное кровоизлияние у 18, судороги - 19, тяжёлое нарушение сознания – 15 больных), сердечно-сосудистой системы (у 10 врожденные пороки развития), респираторные нарушения. Тогда как у больных с НЭК+сепсис особенностью клиники являлось превалирование проявления инфекционного фактора, то есть наличие очагов инфекции в различных органах и системах (вентрикулит, перитонит, остеомиелит, омфалит, пневмония). Нужно отметить, что случаи смерти среди детей с септическим осложнением были больше, чем с НЭК III. В нашем исследовании смертность среди новорожденных с НЭК II и НЭК III составляет 8.4%, а с НЭК+сепсис - 47%.
В плазме крови у больных доношенных новорожденных были определены уровни NO, ЭПО и Са+2. У 83 пациентов с НЭК наблюдалось повышение уровней NO, ЭПО и снижение показателей Са+2. У 17 больных с НЭК+сепсис были выявлены низкие значения NO, ЭПО и Са+2. Нужно отметить, что у пациентов с НЭК с септическим осложнением NO ниже даже его значения, чем при I стадии болезни (p1 < 0.001). Уровень ЭПО также низкий по сравнению с его значением у больных с НЭК II (p5 = 0.09) и НЭК III (p6 = 0.01) стадиями, а в уровне Cа+2 наблюдается незначительное повышение только по сравнению его показателей с НЭК III (p9 = 0.16). То есть наибольшее изменение уровней биомаркеров в плазме у больных наблюдалось только в значении показателей NO.
Для выявления статистически значимой разницы уровней NO, ЭПО, Cа+2 у больных с НЭК и НЭК+сепсис мы провели тест по критерию Манна-Уитни, результаты которого продемонстрированы в таблице 1.
Таблица 1
Значение уровней NO, ЭПО и Cа+2 у больных с НЭК и НЭК+сепсис
|
Показатели |
НЕК I (n = 49) |
НЭК II (n = 27) |
НЭК III (n = 7) |
НЭК + сепсис (n=17) |
|
NO (мкмоль/л) |
54.40 [43.70; 78.90] (р1 <0.001) |
81.90 [53.23; 101.55] (р2 <0.001) |
117.90 [115.35; 127.00] (р3 <0.001) |
35.60 [32.10; 49.90] |
|
ЭПО (ммоль/л) |
17.80 [14.90; 19.70] (р4 <0.50) |
19.50 [15.90; 21.55] (р5<0.09) |
23.10 [19.35; 26.00] (р6 <0.01) |
18.50 [14.50; 20.10] |
|
Cа+2 (ммоль/л) |
1.68 [0.81; 1.90] (р7 <0.11) |
0.80 [0.69; 1.26] (р8 <0.40) |
0.80 [0.46; 0.88] (р9 <0.16) |
0.97 [0.66; 1.87] |
Примечание: р - уровень статистической значимости различий по критерию Манна-Уитни между данной группой и НЭК+сепсис.
Цифровые данные плазменных уровней ЭПО, NO, Ca+2 были использованы также для построения ROC-кривой. В связи с тем что развернутая клиническая картина НЭК II, НЭК III и НЭК+сепсис имеют сходства, для проведения ROC-анализа были сравнены эти группы больных. ROC-анализ проведен с учетом разных комбинаций биомаркеров у больных с НЭК+сепсис. Путем расчета площади под кривой (ППК) были получены лучшая точка отсечения, специфичность, чувствительность. В нашем исследовании наибольшая диагностическая ценность наблюдается при использовании NO и комбинаций NO+ ЭПО, NO+ ЭПO+ Ca+2. Так как в показателях ППК комбинаций NO+ ЭПО и NO, ЭПO, Ca+2 нет никакой значимой разницы, следовательно, Ca+2 можно не применять для проведения дифференциальной диагностики этих двух патологий. А значение ЭПО не оказывает существенного влияния на результаты анализа. Таким образом, для проведения дифференциации НЭК от сепсиса достаточно использовать NO. Результаты теста, отражающие статистическую значимость биомаркеров и их комбинаций в дифференциальной диагностике НЭК и НЭК+сепсис, показаны в таблице 2.
Таблица 2
Значимость биомаркеров и их комбинаций в дифференциальной диагностике НЭК и НЭК+сепсис
|
Биомаркеры |
ППК, % |
Чувствительность, % |
Специфичность, % |
ВО |
ЛП
|
ЛО
|
ВП |
|
NO |
79.3 |
87.1 |
71.4 |
10 |
4 |
4 |
27 |
|
ЭПO |
57,5 |
93,5 |
21,5 |
3 |
11 |
2 |
29 |
|
NO, ЭПO |
81.2 |
83,9 |
78,6 |
11 |
3 |
5 |
26 |
|
NO, ЭПO, Ca+2 |
81.2 |
83,9 |
78,6 |
11 |
3 |
6 |
26 |
Примечания: ППК – наибольшая диагностическая ценность биомаркеров; ВО – верно отрицательный; ЛП – ложно положительный; ЛО – ложно отрицательный; верно положительный.
На основе значений чувствительности и специфичности построена характеристическая ROC-кривая, количественная оценка которой определяется площадью под кривой. В проведении дифференциации НЭК от НЭК+сепсис у доношенных новорожденных NO был выявлен в качестве эффективного предиктора по показаниям чувствительности и специфичности (рис. 1). Диагностическая ценность NO незначительно повышается при комбинации с ЭПO, а при дополнительном сочетании их с Ca+2 никаких изменений не наблюдается (рис. 2).
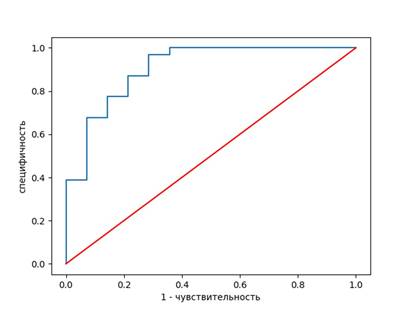
Рис. 1. ROC-кривая чувствительности и специфичности NO в дифференциальной диагностике НЭК с НЭК+сепсис
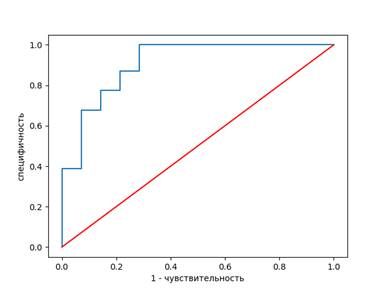
Рис. 2. ROC-кривая чувствительности и специфичности NO, ЭПO, Ca+2 в дифференциальной диагностике НЭК с НЭК+сепсис
В этом проспективном одноцентровом исследовании случай-контроль мы стремились выявить диагностическую ценность NO, ЭПО и Ca+2 в дифференциации НЭК и НЭК+сепсис в отдельности и их комбинаций. При НЭК было обнаружено повышение сывороточных уровней NO, ЭПО и понижение Ca+2, тогда как при НЭК+сепсис наблюдались низкие значения этих биомаркеров. Уровень NO в плазме крови у группы случай-контроль был ниже, чем у больных с НЭК I, НЭК II, НЭК III. Согласно нашему исследованию, изменение уровня NO в плазме у пациентов с некротическим энтероколитом и с септическим осложненным течением болезни можно использовать в дифференциальной диагностике этих двух патологических состояний. Связь этих биомаркеров с НЭК можно объяснить, исходя из факторов риска развития и патогенеза заболевания. Гипоксически-ишемическое поражение центральной нервной системы и мезентериальная гипоперфузия считаются основными патогенетическими механизмами развития НЭК у доношенных новорожденных [6]. Оксид азота и эритропоэтин являются медиаторами гипоксии [7]. Взаимосвязанное повышение уровней этих биомаркеров является одной из причин дисфункции эндотелия мезентериальных сосудов и нарушения кишечного кровообращения у новорожденного, способствует формированию патогенеза НЭК. Вследствие гипоксии снижение уровня кислорода в крови вызывает уменьшение мозгового кровообращения. Для улучшения кровоснабжения и обеспечения метаболических потребностей головного мозга происходит централизация кровообращения за счет вазоконстрикции и снижение периферического кровотока [8; 9]. Это осуществляется путем компенсаторной вазоконстрикции сосудов, которой способствует повышение уровня ЭПО в плазме крови. В результате этого процесса возникает мезентериальная ишемия, занимающая важную роль в патогенезе НЭК. В качестве защитной реакции ишемия кишечника способствует вазодилатации, которая реализуется повышением синтеза NO. Гиперпродукция NO, вызванная ферментом - индуцибельной синтазой (iNOS), приводит к персистирующей барьерной недостаточности слизистой оболочки кишечника и создает условия для бактериальной инвазии, в результате чего развертывается полная клиническая картина НЭК [10; 11]. Одновременно, под воздействием этой повышенной продукции NO, происходит внутриклеточная миграция ионов кальция (цитозольный кальций), чем и объясняется снижение его уровня в плазме. Известно также, что внутриклеточный ион Са+2 ингибирует производство NO, путем стабилизации mRNA – messenger ribonucleic acid в макрофагах, подверженных действию бактериального эндотоксина [12]. По этой причине мы ожидали повышение уровней ЭПО и NO и снижение уровня иона Са+2 при НЭК, что нами и наблюдалось. Однако в крови у детей с НЭК+сепсис наблюдается низкий уровень NO в отличие от другой группы. Согласно литературным данным и нашему исследованию, инфекция тоже является немаловажным фактором риска развития НЭК. Под воздействием инфекционного агента иммунными и тканевыми клетками вырабатывается NO ферментами - синтазой оксида азота – конституциональной эндотелиальной синтазой (eNOS). eNOS экспрессируется в кишечной сосудистой сети и отвечает за низкие уровни NO, для активации которого требуются ионы Са+2. NO, продуцированный eNOS, оказывает сосудорасширяющее действие в кишечнике новорожденного, диффундирует в соседние клетки сосудов гладкомышечных тканей. При длительном воздействии инфекции eNOS вызывает снижение продукции NO, что наблюдается при сепсисе [13].
Заключение
Результаты нашего исследования показывают, что NO является биомаркером, который может быть использован для проведения дифференциальной диагностики некротического энтероколита от сепсиса у доношенных новорожденных. Гиперпродукция NO при НЭК, вызванная гипоксическим поражением центральной нервной системы и мезентериальной гипоперфузией, ускоряет эпителиальное повреждение кишечника, притупляет восстановительные механизмы путем супрессии пролиферации и миграции энтероцитов. Дисбаланс между повреждающими и восстанавливающими механизмами приводит к персистирующей барьерной недостаточности, бактериальной инвазии, устойчивой активации воспалительных медиаторов, что ведет к развертыванию полной клинической картины НЭК. Гипопродукция NO, вызванная eNOS, при генерализации инфекционного процесса тоже способствует повреждению кишечника у новорожденных. Следовательно, повышенная при НЭК и пониженная при НЭК+сепсис продукция NO является показателем патологического процесса в кишечнике новорожденного. Соответствующие пограничные значения уровней NO для каждого патологического процесса могут применяться в дифференциальной диагностике некротического энтероколита от сепсиса у доношенных новорожденных.
Библиографическая ссылка
Маммадова Т.А. НОВЫЕ БИОМАРКЕРЫ ДЛЯ ПРОВЕДЕНИЯ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ НЕКРОТИЧЕСКОГО ЭНТЕРОКОЛИТА ОТ СЕПСИСА У ДОНОШЕННЫХ НОВОРОЖДЕННЫХ: ИССЛЕДОВАНИЕ СЛУЧАЙ-КОНТРОЛЬ // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30898 (дата обращения: 05.02.2026).
DOI: https://doi.org/10.17513/spno.30898



