Оценка молекулярных основ поддержания гомеостазиса клеток, органов, тканей и целого организма является актуальным направлением медико-биологических исследований. В связи с этим поиск веществ для активации компенсаторно-восстановительных процессов, способных повышать защитные и регенерационные функции организма, управляя процессами клеточного цикла, становится актуальной задачей биомедицинских исследований.
Кожа выполняет барьерную, иммунную и эндокринную функции и снижение ее функциональной активности может отрицательно сказываться на поддержании гомеостаза организма и состоянии здоровья лиц старших возрастных групп [1]. Кроме того, возрастная инволюция кожи является медико-социальной проблемой, т.к. неудовлетворенность пациентов внешним видом может привести к снижению их социальной активности и качества жизни. В связи с этим важной задачей медицинской косметологии является обнаружение субстанций, обладающих регуляторными свойствами, эффективно и безопасно нормализующих гомеостаз и улучшающих внешний вид кожи.
В АНО НИЦ «Санкт-Петербургский институт биорегуляции и геронтологии» создана технология выделения полипептидных комплексов из различных органов и тканей молодых животных. Эти полипептиды оказывают тканеспецифическое действие, стимулируя пролиферацию и замедляя апоптоз клеток в органотипических культурах различных тканей. Таким образом, появилась инновационная группа пептидных препаратов (цитомединов), которые тканеспецифически способствуют нормализации функций органов и тканей при старении и различной патологии. Активным началом цитомединов являются ди-, три и тетрапептиды в их составе. В условиях нарушения клеточного гомеостаза при патологии и старении пептиды стимулируют биосинтеза белков и репарацию ДНК.
Полипептидный комплекс сосудов нормализует функции кардиоваскулярной системы, предотвращая развитие атеросклеротического поражения сосудов и гипертонической болезни. Из неспецифических биологических активностей полипептидного комплекса сосудов следует отметить нормализующее действие на гемостаз, иммунную и антиоксидантную систему. При ранговом анализе в полипептидном комплексе сосудов телят было определено наибольшее количество аминокислот Lys, Glu, Asp, из которых затем был синтезирован пептид KED (Lys-Glu-Asp). Пептид KED при использовании у пациентов с кардиоваскулярной патологией per os, при изучении в моделях сердечно-сосудистых заболеваний in vivo и in vitro проявлял вазопротекторный эффект, активировал метаболизм эндотелиальных клеток и дермальных фибробластов [2; 3].
За последние десятилетия усилился интерес к изучению влияния кодируемых аминокислот на функции клеток. При оценке различных параметров специфической и неспецифической резистентности организма показано, что глутаминовая (Glu), аспарагиновая (Asp) кислоты и лизин (Lys) стимулируют фагоцитоз, обладают иммуномодулирующим и противотоксическим действием [4]. В экспериментальной модели на животных выявлено, что на различных этапах эмбриогенеза потребление разных типов аминокислот отличается [5]. Кроме того, в литературе имеется информация о воздействии аргинина на процессы клеточного обновления [6]. Аргинин также способствует снижению выраженности апоптоза клеток сетчатки в исследовании in vitro.
Цель исследования - изучить влияние полипептидного комплекса сосудов, аминокислот (Lys, Glu, Asp) и пептида KED (Lys-Glu-Asp) на апоптоз клеток дермы крыс в условиях органотипического культивирования.
Материалы и методы исследования
Исследование проведено на самцах крыс линии Wistar массой 200-250 г в возрасте 3 месяцев, полученных из биоколлекции «Коллекция лабораторных млекопитающих разной таксономической принадлежности» Института физиологии им. И.П. Павлова РАН, которая поддержана программой биоресурсных коллекций ФАНО России. Крыс умерщвляли путем помещения в эксикатор с высокой концентрацией паров эфира с хлороформом. При проведении исследования по органотипическому культивированию дермы оценивали рост 1200 эксплантатов кожи животных. Органотипическая культура является оптимальным объектом для оценки активности субстанций потому, что в ней нет нервных, гуморальных и других регуляторных воздействий, присущих целому организму. Это позволяет оценить непосредственное влияние изучаемых аминокислот и пептидов на клетки кожи.
Фрагменты дермы крыс диаметром 1 мм3 выделяли в стерильном боксе. Затем их помещали в чашки Петри с поли-L-лизиновым покрытием. Для культивирования ткани кожи готовили питательную среду, которая состояла из 35% среды ИMEM, 35% раствора Хенкса, 25% фетальной бычьей сыворотки. В культуральную среду также добавляли 0,6% раствор глюкозы, 0,5 ед/мл инсулина и 4 ед/мл гентамицина. К исследуемым эксплантатам дермы добавляли 3 мл питательной среды с полипептидным комплексом сосудов в концентрации 20 нг/мл, пептидом KED в концентрации 0,05 нг/мл или с одной из аминокислот (Lys, Glu, Asp) в концентрации 0,05 нг/мл. Эти концентрации изучаемых веществ были выбраны как наиболее активные по результатам предварительно проведенного исследования. В контрольные образцы органотипических культур дермы добавляли 3 мл культуральной среды. При таком дизайне эксперимента эксплантаты кожи опытных и контрольной групп развивались в одинаковом количестве среды. Культивирование осуществляли в СО2-инкубаторе при температуре 37 °С. На 3-й день культивирования осуществляли морфометрию и проводили иммуноцитохимическое исследование. Для каждой группы анализировали 25 эксплантатов дермы.
В формировании зоны роста культивируемых фрагментов кожи участвуют пролиферационные и миграционные механизмы. Характерной структурной организацией периферической зоны дермальных эксплантатов является подкапсульная область, в которой и проводился морфометрический анализ данных иммуноцитохимии. Также определяется капсула эксплантата, которая состоит из нескольких слоев фибробластоподобных клеток продолговатой формы. Капсула покрыта однослойным плоским эпителием (мезотелием). При этом образование сплошного мезотелиального пласта не происходит. Мезотелиальные клетки нередко отходят друг от друга, приобретают овальную форму и отделяются от базальной мембраны. Дермальные фибробласты, макрофаги и некоторые другие типы клеток способны к миграции в разрывы мезотелиального пласта. Таким образом, происходит формирование периферической зоны роста.
Классическими маркерами клеточного старения, по данным базы PubMed, являются протеины p53, p21, p16. Фактор транскрипции p53 активирует сигнальные каскады каспаза-зависимого и митохондриального апоптоза. Белки p16 и p21 служат мишенями р53 и являются посредниками апоптотического каскада.
Протеин р53 участвует в обеспечении гомеостаза генома и поддерживает генетическую однородность клеток. Инициация сигнального каскада с участием р53 происходит в ответ на стрессорные сигналы: укорочение теломер, повреждение двунитевой ДНК, активацию онкогенов, гипоксию, недостаток питательных веществ. При активации нижележащих белков – мишеней может наблюдаться арест клеточного цикла, запрограммированная клеточная гибель, репарация двунитевой ДНК, дифференцировка, клеточное старение. Установлено, что белок р53 играет важную роль в старении кожи. При активации р53 наблюдается уменьшение толщины эпидермиса и дермы, снижение темпа роста волос и репарации дермы. Кроме того, транскрипционный фактор р53 регулирует секрецию сальных желез кожи и способствует уменьшению количества подкожных адипоцитов [7]. Протеин p21 или CDKN1A (cyclin-dependent kinase inhibitor 1A) является основной мишенью p53 и осуществляет арест клеточного цикла в стадии G1. Белок p21 при участии р53 препятствует возникновению повреждений ДНК, активируя систему репарации. Р21 ингибирует прохождение точек рестрикции клеточного цикла (G1-S, G2). Уменьшение активности транскрипционного фактора p21 коррелирует с повышением способности клеток к пролиферации и репарации тканей [8]. Протеин p16 относят к супрессорам опухолей, останавливающим клеточный цикл путем инактивации циклин-зависимой киназы-2А. RelA, или субъединица p65 - белок из семейства NF-κB/Rel класса II, одна из основных субъединиц фактора транскрипции NF-κB. Димер p50/p65 является самой распространённой формой NF-κB и универсальным фактором транскрипции, обнаруживаемым практически во всех типах клеток.
Иммуноцитохимическое исследование эксплантатов дермы осуществляли авидин-биотиновым методом. Синтез белков р53, р21, р16, р65 в клетках кожи визуализировали с применением одноэтапного протокола для клеточных культур с фиксацией этиловым спиртом. Морфометрический анализ изображений культур фибробластов кожи проводили с использованием системы компьютерного анализа микрофотографий, включающей в себя микроскоп Nikon Eclipse E400, цифровую камеру Nikon DXM1200 и программу Videotest Morphology версии 4.0. Для каждой культуры анализировали 10 полей зрения при увеличении 400. Затем рассчитывали площадь экспрессии белков р53, р21, р16, р65. Этот показатель равен отношению площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражается в %. Полученные данные анализировали в программе Statistica 7.0. Для оценки статистических различий площади экспрессии между группами использовали t-критерий Стьюдента.
Результаты исследования и их обсуждение
При добавлении лизина в органотипическую культуру кожи крыс выявлено достоверное снижение площади экспрессии белка p53 на 61% по сравнению с контролем. Лизин не влиял на площадь экспрессии протеинов p16, р21, p65 в органотипической культуре кожи. При добавлении глутаминовой кислоты были получены схожие результаты. Наблюдалось достоверное уменьшение площади экспрессии белка p53 на 48%, а экспрессия белков p16, p21, p65 не изменялась. При воздействии аспарагиновой кислоты экспрессия проапоптотических белков р53 и р65 достоверно снизилась соответственно на 59% и 20% (рисунок).
Пептид KED статистически значимо снижал экспрессию белков р53, р16, р21 и р65 в органотипической культуре кожи крыс соответственно на 60%, 53%, 40% и 65% по сравнению с контролем. Полипептидный комплекс сосудов достоверно понижал экспрессию протеина р53 на 69%, р16 - на 61%, р21 - на 39% и р65 - на 64% в органотипической культуре кожи крыс (рисунок).
Таким образом, полипептидный комплекс сосудов и входящий в его состав трипептид KED проявляли более сильный антиапоптотический эффект в органотипической культуре дермы животных, чем аминокислоты, составляющие этот короткий пептид. Поскольку эффекты полипептидного комплекса сосудов и пептида KED были сопоставимы, можно предположить, что действие первого на клетки кожи достигается за счет пептида KED.
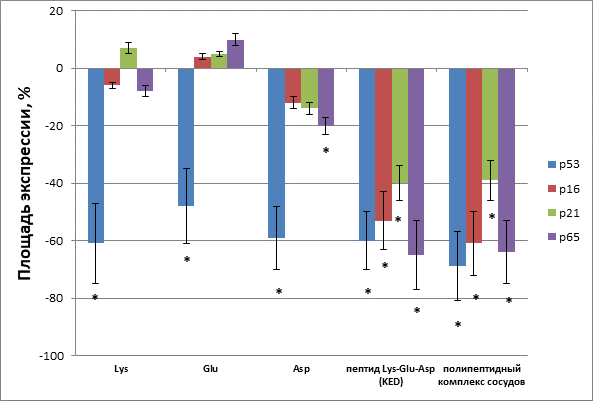
Влияние аминокислот Lys, Glu, Asp, пептида Lys-Glu-Asp (KED) и полипептидного комплекса сосудов на площадь экспрессии белков – активаторов апоптоза р53, р21, р16, р65 в органотипической культуре дермы крыс. * – р < 0,05 по сравнению с контролем. Все данные площади экспрессии приведены относительно контроля, который принят за 0
Ранее для иммунопротекторного пептида Lys-Glu было показано, что его биологическая активность выше, чем у аминокислот, входящих в состав этого пептида [9]. Обобщая эти данные с результатами нашего исследования, можно предположить, что короткие пептиды, благодаря пептидным связям, могут связываться с нуклеосомой, гистоновыми белками или двунитевой ДНК [2] и регулировать экспрессию определенных генов (в нашем исследовании – генов р16, р21, р53, р65). Это предположение подтверждается данными о том, что пептид KED может быть использован в качестве компонента в культуральной среде для снижения экспрессии геронтогенов p16 и p21 и синтеза соответствующих белков при длительном культивировании стволовых клеток [10].
Известно, что транскрипционный фактор р65 экспрессируется при клеточном старении. В ядре р65 ко-локализуется с молекулой NFϰB, вовлеченной в inflammaging (слабо выраженную воспалительную реакцию, развивающуюся при старении) [11]. Ранее для пептида KED было выявлено иммуномодулирующее действие. Таким образом, пептид KED, регулируя экспрессию белка р65, может не только снижать выраженность апоптоза фибробластов кожи, но и замедлять развитие воспалительных реакций в дерме.
Установлено, что экспрессия белков р16 и р21 возрастает в большинстве органов и тканей человека: в головном мозге, селезенке, печени, кишечнике, поджелудочной железе и коже. Предполагается, что эти молекулы важны для определения секреторного фенотипа клеток кожи, ассоциированного со старением (senescence-associated secretory phenotype) [12]. Кроме того, повышение экспрессии факторов транскрипции р16 и р21 выявлено при ускоренном старении фибробластов кожи, вызванном воздействием ультрафиолетового излучения. Авторы этого исследования полагают, что вещества, снижающие синтез этих молекул при ускоренном старении клеток кожи, являются перспективными геропротекторами [13]. Аналогичные эффекты выявлены для проапоптотического протеина р53. Белок р53 не только играет важную роль в старении клеток кожи, но и вовлечен в развитие патологии дермы. Установлено, что его синтез возрастает при псориазе. Пептид KED, снижая экспрессию циклин-зависимых киназ р16, р21, р53, предотвращает развитие секреторного фенотипа клеток кожи, ассоциированного со старением, что указывает на его геропротекторное действие.
Полученные данные дополняют результаты ранее проведенных исследований в диссоциированной культуре фибробластов кожи крыс при ее репликативном старении. В этой работе было установлено, что пептид KED уменьшает продукцию матриксной металлопротеиназы-9 (ММР9) и стимулирует синтез молекул, активирующих пролиферацию и замедляющих старение фибробластов кожи (Ki67, CD98hc) [3]. Кроме того, применение пептида KED в сочетании с другими пептидами путем электрофореза повышало толщину дермы и эпидермиса у женщин среднего возраста [14].
Заключение. Антиапоптотическое влияние полипептидного комплекса сосудов достигается за счет входящего в его состав пептида KED. Пептид KED способствует снижению экспрессии генов и синтеза проапоптотических белков р16, р21, р53, р65 и других протеинов (Ki67, CD98hc, ММР9), что выражается в нормализации толщины дермы и эпидермиса. Полученные данные позволяют сделать вывод о том, что полипептидный комплекс сосудов и пептид KED обладают антиапоптотическими свойствами в отношении клеток кожи и могут в дальнейшем изучаться в качестве активных компонентов средств, направленных на повышение функций и улучшение внешнего вида кожи при ее возрастной инволюции.
Библиографическая ссылка
Линькова Н.С., Чалисова Н.И., Рыжак Г.А., Гутоп Е.О., Кожевникова Е.О., Фридман Н.В. ВЛИЯНИЕ ВАЗОПРОТЕКТОРНЫХ ПЕПТИДОВ НА АПОПТОЗ ОРГАНОТИПИЧЕСКОЙ КУЛЬТУРЫ КОЖИ КРЫС // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30893 (дата обращения: 05.02.2026).
DOI: https://doi.org/10.17513/spno.30893



