Вспышка коронавирусного заболевания (COVID-19), вызванного вирусом SARS-CoV-2, произошла в конце 2019 года в городе Ухань (провинция Хубэй) в Китайской Народной Республике. Всемирная организация здравоохранения 11 февраля 2020 года объявила вспышку инфекции COVID-19 международной чрезвычайной ситуацией в области общественного здравоохранения и объявила о начале пандемии. Легкие считаются основным органом-мишенью коронавирусной инфекции. Несмотря на то что у большинства пациентов с COVID-19 наблюдаются типичные респираторные симптомы (повышение температуры, сухой кашель, одышка, ощущение заложенности в грудной клетке), часто во время заболевания возникают диспептические симптомы и признаки повреждение печени, которые могут проявляться как клинически (анорексия, тошнота, рвота, диарея, боль в животе), так и при лабораторном исследовании (гипербилирубинемия, повышение АЛТ, АСТ, ЩФ, ГГТ гипоальбуминемия) [1]. Целью данной работы явилась оценка влияния COVID-19 на печень на основе анализа имеющихся на сегодняшний день литературных данных.
Коронавирусы – это разнообразная группа вирусов, способных поражать различных животных, а также вызывать легкие и тяжелые респираторные инфекции у людей. Семейство коронавирусов включает 4 распространенных коронавируса человека, связанных с простудой, и 3 штамма, которые связаны с пневмонией, дыхательной недостаточностью и смертью, включая SARS-CoV (тяжелый острый респираторный синдром), MERS-CoV (коронавирус ближневосточного респираторного синдрома) и SARS-CoV-2 [2].
SARS-CoV-2 – одноцепочечный РНК-содержащий вирус, который относится к семейству Coronaviridae, роду Betacoronavirus. Вирионы имеют размер 80-220 нм. В его структуру входит нуклеокапсид, образованный гибкой спиралью, которая состоит из геномной плюс-нити РНК и большого количества молекул нуклеопротеина N. Имеется суперкапсид, в который встроены тримерные гликопротеиновые шипы (гликопротеин S), мембранные протеины М, оболочечный протеин E, гемагглютининэстераза [3]. Строение вируса можно схематично представить на рисунке 1.
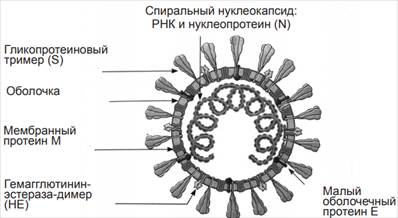
Рис. 1. Строение коронавируса [3]
Решающее значение для проникновения SARS-CoV-2 в клетки принадлежит ангиотензинпревращающему ферменту 2 (АПФ2). Вирус через гликопротеин S связывается с АПФ2-рецептором и проникает в клетку-мишень, этому процессу способствует трансмембранная сериновая протеаза 2 типа. Внутри клетки происходит репликация вируса, необходимая для генерации новой вирусной РНК и синтеза структурных белков для сборки новых вирусных частиц, которые выходят из нее путем экзоцитоза, способствуя дальнейшей виремии, и гибели пораженной клетки.
Ангиотензинпревращающий фермент 2 широко распространен в различных органах человека, включая слизистую оболочку полости рта и носа, носоглотку, мозг, легкие, тонкий и толстый кишечник, почки, селезенку, печень и холангиоциты. В здоровых гепатоцитах уровни рецепторов АПФ2 значительно ниже. АПФ2-рецепторы экспрессируются в 59,7% холангиоцитов, пропорция аналогична таковой в пневмоцитах II типа [4; 5]. Однако при определенных заболеваниях наблюдается увеличение количества данных рецепторов. Во-первых, фиброз и цирроз увеличивают экспрессию рецептора АПФ2, подтверждая более высокий риск гепатоцеллюлярного тропизма SARS-CoV-2 у пациентов с уже имеющимися заболеваниями печени. Во-вторых, гипоксия является еще одним обстоятельством, при котором в гепатоцитах повышается экспрессия АПФ2 [6].
По результатам многочисленных зарубежных исследований общую частоту различных нарушений функции печени при COVID-19 можно представить в виде диаграммы (рис. 2). Распространенность гипербилирубинемии составила 10,98%, совокупное повышение аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) составило 23,28% и 23,41%, суммарная распространенность повышения ЩФ и ГГТ составила 7,48% и 27,94%, суммарная распространенность гипоальбуминемии составила 61,27%. Общая объединенная частота повышенных уровней глобулинов составила 20,17% [7].
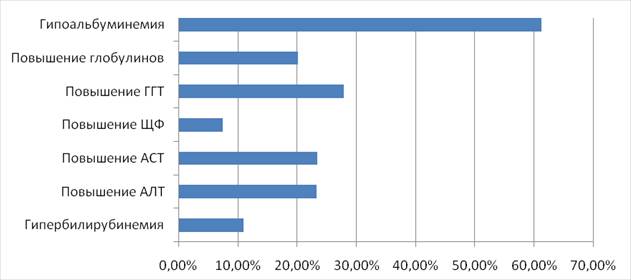
Рис. 2. Общая частота различных нарушений функции печени при COVID-19
Повреждение печени у пациентов с COVID-19 может быть вызвано вирусом, непосредственно повреждающим клетки печени. Экспрессия АПФ2 в холангиоцитах в 20 раз выше, чем в гепатоцитах. Характер экспрессии АПФ2 показывает, что SARS-CoV-2 может напрямую инфицировать холангиоциты и вызывать дисфункцию желчных протоков [8]. Имеются данные, что предварительная инкубация S-белка коронавируса с трипсином усиливает сродство к его рецептору на поверхности клетки-хозяина. Трипсин, среди других протеаз, экспрессируется в эпителиальных клетках печени, поскольку они имеют решающее значение для ремоделирования внеклеточного матрикса. Этого повышенного сродства к S-белку в присутствии трипсина может быть достаточно, чтобы компенсировать более низкие уровни экспрессии ACE-2 в здоровых гепатоцитах [9]. Холангиоциты многофункциональны и играют важную роль в регенерации печени и иммунных ответах, что указывает на то, что вирусное иммунологическое повреждение может играть важную роль в повреждении печени при COVID-19. Поскольку вирусная РНК может быть обнаружена в образцах крови пациентов с COVID-19, а печень является органом с обильным кровоснабжением, это дает вирусу возможность вызвать прямое цитопатическое повреждение печени. Результаты аутопсии у пациентов с SARS показали большое количество митотических клеток печени, баллонную дегенерацию гепатоцитов, легкое воспаление, умеренную инфильтрацию лимфоцитов, стеатоз и центральный лобулярный некроз, сопровождающийся очевидным апоптозом [10].
Ишемия - реперфузионное повреждение также может способствовать повреждению печени. Сложное кровоснабжение и высокая метаболическая активность печени делают ее особенно уязвимой для нарушений кровообращения. Гипоксический гепатит, также называемый ишемическим гепатитом, часто встречается у пациентов в критическом состоянии и представляет собой осложнение сердечно-сосудистой или дыхательной недостаточности, вызывая пассивный застой или снижение перфузии печени [11]. В ситуациях системного стресса наблюдается компенсаторное снижение периферического и внутреннего кровотока, что приводит к уменьшению кровотока в печени и тем самым приводит к гепатоцеллюлярной гипоксии. Реперфузионное повреждение опосредуется генерацией активных форм кислорода, когда ишемизированные гепатоциты повторно подвергаются воздействию кислорода, что приводит к повреждению клеток посредством перекисного окисления липидов. Кроме того, клетки Купфера могут продуцировать цитокины в ответ на ишемию и запускать активацию полиморфноядерных лейкоцитов. Это явление быстро прогрессирует с резким повышением уровня трансаминаз, сопровождающимся повышением уровня ЛДГ, который может восстановиться по мере коррекции гипоксии [8].
Повреждение печени может быть связано с системным воспалительным ответом и повреждением иммунной системы. Под влиянием вируса активируются Toll-подобные рецепторы, Т-киллеры и другие воспалительные сигналы, разрушающие инфицированные клетки организма, приводят к их апоптозу и некрозу. Со временем Т-лимфоциты после истощения не могут контролировать вирусные и бактериальные инфекции [12]. Синдром цитокинового шторма может вызывать обильное высвобождение множества провоспалительных цитокинов и воспалительных маркеров, таких как фактор некроза опухоли, ИЛ-2, ИЛ-6, ИЛ-7, ИЛ-18, гранулоцитарно-колониестимулирующий фактор, интерферон-γ и ферритин [13]. Фульминантная и фатальная гиперцитокинемия может инициировать цепочку событий, которые приводят к повреждению тканей и полиорганной недостаточности. Воспалительный ответ может вызвать гепатомегалию и повышение уровня трансаминаз в сыворотке крови, а также желтуху и энцефалопатию [14].
Клиническая картина лекарственного поражения печени варьируется от чисто гепатоцеллюлярных вариантов до холестатических. Нарушения функции печени при COVID-19 характеризуются в основном гепатоцеллюлярным повреждением. Первоначальные проявления COVID-19 характеризуются лихорадкой, кашлем, утомляемостью и одышкой. Для купирования этих симптомов некоторые пациенты используют жаропонижающие препараты, в состав которых чаще всего входит парацетамол. Препарат вызывает истощение в организме запасов глутатиона, а накапливающиеся продукты метаболизма обладают гепатотоксическим действием.
Кроме того, для лечения COVID-19 широко используются противовирусные препараты, антибиотики и стероиды. В инструкциях к противовирусным препаратам описаны возможные побочные реакции (часто – повышение активности АЛТ, АСТ, ГГТ; редко – повышение активности ЩФ, повышение концентрации билирубина в крови), свидетельствующие о повреждении печени. По результатам зарубежных исследований, лечение кортикостероидами не влияет на время выведения вируса, продолжительность пребывания в стационаре или продолжительность симптомов у пациентов с легкой формой COVID-19. Повреждение печени более вероятно у пациентов, получавших несколько видов лекарств, а также большое количество глюкокортикостероидов. Это может объяснить то, что повреждение печени чаще наблюдается при тяжелых и критических состояниях, поскольку пациентам с легким заболеванием обычно назначают меньше лекарственных препаратов. Поскольку метаболизм препаратов происходит в печени и почках, повреждение печени может нарушать их метаболизм, выведение, дозировку и эффективные концентрации, что приводит к повышенному риску токсичности. Поэтому следует придавать большое значение мониторингу функции печени при лечении COVID-19 [15].
У пациентов, получающих искусственную вентиляцию легких, может повышаться давление в правом предсердии. В результате этого будет развиваться препятствие венозному возврату и застой крови в печени, что будет способствовать ее повреждению. Это наблюдение может свидетельствовать о более высокой частоте поражения печени у тяжелых и критических пациентов, чем в других легких случаях [16].
Кроме того, некоторые хронические заболевания печени способствуют большей вероятности инфицирования SARS-CoV-2, поскольку у них имеется более слабая иммунная реакция организма. Точно так же руководство, предложенное Азиатско-Тихоокеанской ассоциацией по изучению печени, предполагает, что пациенты с запущенным циррозом, раком печени, аутоиммунными заболеваниями печени и после трансплантации печени более восприимчивы к инфекции COVID-19 из-за ослабленного иммунитета [17].
Исследование COVID-19 показало, что из 22 исследуемых пациентов поражение печени отмечалось на фоне имеющихся хронических заболеваний печени (16 пациентов – 72,7%) [18]. Половина пациентов с отклонениями в результатах «печеночных» показателей крови: разнообразные хронические заболевания печени, включая неалкогольную жировую болезнь печени, алкогольную болезнь печени и хронический вирусный гепатит B. Другое исследование при COVID-19 показало, что частота хронических заболеваний печени (10,81%) у пациентов с симптомами диспепсии была значительно выше, чем у пациентов без заболеваний желудочно-кишечного тракта (2,95%), что указывает на потенциальную связь между хроническим заболеванием печени и повреждением печени. У пациентов, инфицированных вирусом гепатита B (HBV) и вирусом гепатита C (HCV), с SARS-CoV-2, наблюдается более высокая вероятность развития тяжелого гепатита, что может быть связано с усилением репликации вируса во время заражения SARS-CoV-2. Также есть данные о том, что пациентам с хроническим гепатитом B и инфекцией SARS-CoV-2 может потребоваться больше времени, чтобы вывести вирус из своего организма. Этот механизм может быть связан с дисфункцией Т-клеток у пациентов с хронической инфекцией HBV в ответ на другие вирусы [19; 20].
Прогностическое значение повышения ферментов печени у пациентов, инфицированных SARS-CoV-2, в настоящее время обсуждается. Есть данные о том, что повышение уровня ферментов печени в сыворотке крови связано с неблагоприятными исходами, включающими шок, перевод в отделение интенсивной терапии с подключением к механической вентиляции легких [21; 22]. Повышенные уровни ферментов печени, особенно повышение уровня АСТ и АЛТ, более чем в пять раз превышающие верхний предел нормы, связаны с повышенным риском смерти. Однако эти исследования могут быть подвержены систематической ошибке, так как пациенты с тяжелым заболеванием получат более интенсивный лабораторный мониторинг, увеличивающий вероятность обнаружения повреждения печени. Существуют и другие данные, согласно которым нет очевидной связи между повышением уровня ферментов печени и смертностью [23].
Для профилактики поражения печени у всех пациентов с COVID-19 необходимо анализировать биохимические показатели печени, такие как АЛТ, АСТ, ЩФ, ГГТ, ЛДГ, общий билирубин и его фракции, холестерин, общий белок и его фракции, показатели коагулограммы, чтобы вовремя обнаружить повреждение печени. Бывает так, что если уровни АСТ и ЛДГ в сыворотке были повышены, а уровень АЛТ в норме, следует учитывать возможное повреждение скелетных мышц или миокарда, а не повреждение печени. Учитывая, что хроническое заболевание печени также является серьезным обстоятельством для течения COVID-19, необходимо уделять внимание его коррекции. При ведении хронического гепатита B следует избегать отмены противовирусных препаратов, чтобы предотвратить реактивацию гепатита B, следует рассмотреть возможность применения анти-HBV препаратов, когда пациенты проходят лечение глюкокортикостероидами. Получающим гормоны или иммунодепрессанты пациентам с аутоиммунным заболеванием печени следует внимательно следить за профилактикой других возможных инфекцией. У пациентов с циррозом печени их иммунодефицитный статус требует интенсивного наблюдения за частотой осложнений и вторичных инфекций. Учитывая, что новый коронавирус вызывает цитокиновый шторм, следует ожидать серию серьезных иммунных ответов организма. У некоторых пациентов может быстро развиться острый респираторный дистресс-синдром и септический шок, а в конечном итоге – полиорганная недостаточность или смерть. Поэтому своевременное лечение критических случаев имеет большое значение в профилактике вторичных повреждений печени [24; 25].
Заключение. Таким образом, симптомы поражения пищеварительной системы и нарушения функции печени часто встречаются у пациентов с COVID-19. Повреждение печени чаще бывает преходящим и проявляется в основном гепатоцеллюлярным, а не холестатическим повреждением. Однако, несмотря на уже имеющиеся данные исследований, другие возможные механизмы поражения печени при SARS-CoV-2 остаются загадкой и требуют дальнейшего изучения. Сложно сказать точно, что служит причиной развития печеночного повреждения, прямое влияние вируса или вторичное поражение, обусловленное лекарственной индукцией, синдромом системного воспалительного ответа, гипоксией. Скорее всего, нарушение функции печени обусловлено сочетанием нескольких механизмов повреждения, поэтому медицинские работники должны уделять внимание лечению ранее существовавшего заболевания печени и контролировать функцию печени у пациентов с COVID-19 во время проводимого лечения.
Библиографическая ссылка
Суркова Е.Ю., Мосина Л.М., Есина М.В. К ВОПРОСУ О НЕКОТОРЫХ ПАТОГЕНЕТИЧЕСКИХ ОСОБЕННОСТЯХ ПОРАЖЕНИЯ ПЕЧЕНИ ПРИ COVID-19 // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30880 (дата обращения: 05.02.2026).
DOI: https://doi.org/10.17513/spno.30880



