В настоящее время послеоперационные грыжи являются одной из наиболее частых нозологических единиц в хирургических стационарах. Ежегодно в России проводится до 200 000 операций по данному поводу, что составляет 10–21% всех вмешательств в абдоминальной хирургии [1]. Ю.Ю. Дедовец с соавт. отмечают, что имеется явная тенденция к увеличению числа пациентов с послеоперационными грыжами до 20–26% [2]. По мнению зарубежных коллег, пластика брюшной стенки является одним из наиболее распространенных вмешательств. Sean R. Maloney с соавт. приводят данные о проведении в США более 350 000 таких операций ежегодно [3]. В мировом хирургическом сообществе при больших грыжах чаще всего применяют два варианта вмешательств, основанных на разделении компонентов брюшной стенки: переднюю сепарацию (anterior components separation – ACST) и заднюю (posterior components separation – PCST) [4]. В свою очередь, при выполнении ACST используют технику Ramirez. При задней сепарации большинство хирургов применяет TAR – transversus abdominis release [5]. Последний способ в настоящее время занимает лидирующую позицию. До настоящего времени нет полного консенсуса по поводу указанных методик оперативного лечения пациентов с грыжами, что обусловлено высокой сложностью этих операций и относительно небольшим количеством исследований [6]. Выбор конкретного метода чаще всего связан с опытом оперирующего хирурга, его навыками и предпочтениями. Возможности и недостатки обеих методик, их преимущества, показания и противопоказания остаются предметами обсуждения [7]. Пациенты с большими грыжами представляют собой весьма гетерогенную категорию. Часто это лица, перенесшие целый ряд вмешательств, имеющие различный коморбидный фон. Достаточно сложно сформировать стандартные, сопоставимые клинические группы для сравнения результатов сепарационных вмешательств, тем более – выполнить рандомизацию пациентов. Исследования CST на лабораторных животных до настоящего времени носят единичный характер. Работ, в которых операции Ramirez и TAR сопоставлены в остром эксперименте, к данному моменту не опубликовано.
Цель исследования: сравнить особенности передней и задней сепарационной протезирующей пластики брюшной стенки в условиях острого эксперимента на животных.
Материалы и методы исследования. Работа выполнена на 30 половозрелых кроликах массой от 3,0 до 4,6 кг в рамках цикла «Экспериментальная хирургия» на кафедре общей, оперативной хирургии и топографической анатомии им. А.И. Кожевникова с разрешения локального этического комитета № 1 ФГБОУ ВО «ПИМУ» Минздрава России (протокол № 7 от 05.07.2018 г.) в соответствии с требованиями действующего законодательства РФ («Правила гуманного обращения с лабораторными животными», «Деонтология медико-биологического эксперимента»), Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей, принятой в Страсбурге 18.05.2014 г., а также с постулатами National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals (2011) [8]. План эксперимента и его методика полностью отвечали трем правилам R (reduction, refinement, replacement), принятой в экспериментальной хирургии и биологии [9]. Суть эксперимента заключалась в моделировании грыжевого дефекта путем иссечения тканей передней брюшной стенки с последующей полной реконструкцией брюшной стенки с помощью сепарационной протезирующей пластики. Рандомизацию производили методом конвертов. В первой группе (n=15) иссекали участок брюшной стенки овальной формы высотой 15 см, шириной 5 см (рис. 1), далее для его закрытия выполняли переднюю сепарацию в модификации Ramirez II (рис. 2–4). Во второй группе (n=15) создавали аналогичный дефект высотой 15 см, шириной 10 см, затем осуществляли реконструкцию брюшной стенки с помощью методики transversus abdominis muscle release – TAR (рис. 5–8). Хирургическая техника полностью соответствовала общепринятым подходам, применяемым у человека, в понимании авторов данных методик, подробно описанных в литературе [4–6]. В качестве эндопротеза использовали полипропиленовую сетку отечественного производства (ES3030), которую в обеих группах располагали ретромускулярно в медиальном сегменте брюшной стенки, фиксировали ее узловыми швами. Все манипуляции на животных проводились в условиях общей анестезии комбинацией препаратов Золетил 100 (25 мг/кг) и Ксилавет (3 мг/кг) внутримышечно. В ходе эксперимента измеряли внутрибрюшное давление (ВБД), окружность живота, определяли площадь передней брюшной стенки животного, соотношение последней и размеров грыжевого дефекта. Эксперимент завершали путем воздушной эмболии 7 мл/кг в условиях общей анестезии. Данные изучали способом Shapiro–Wilk. В большинстве последовательностей распределение отличалось от нормального, поэтому для анализа использовали критерий Mann–Whitney. Различия считали значимыми при p<0,05.
Результаты исследования и их обсуждение. В первой группе масса животных составляла 3,74 кг с интерквартильным размахом (ИКР 3,5–4,0 кг), во второй группе – 3,71 кг (ИКР 3,4–4,0 кг). При этом достоверных отличий между группами не было (p=0,69, Mann–Whitney). Сводные данные приведены в таблице, где Mean – среднее, Median – медиана, Q1 – Q3 – первый и третий квартили, IQR – интерквартильный размах.
|
|
|
|
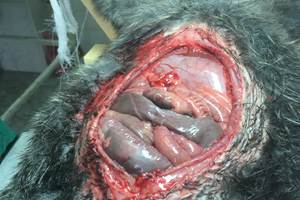
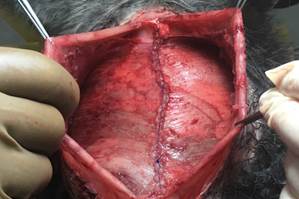
Рис. 1. Дефект брюшной стенки |
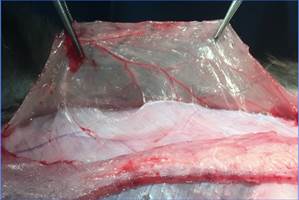
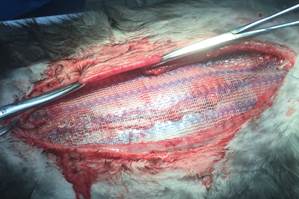
Рис. 2. ACST. Прием Ramirez. Инструменты удерживают рассеченный апоневроз наружной косой мышцы живота |
|
|
|
|
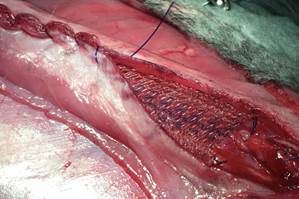
Рис. 3. ACST. Протезирование медиального сегмента брюшной стенки. Ушивание передних листков влагалищ прямых мышц живота над эндопротезом непрерывным швом |
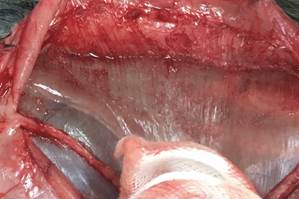
Рис. 4. ACST. Протезирование латерального сегмента брюшной стенки. Фиксация медиального края сетки лигатурой 4/0 |
|
|
|
|
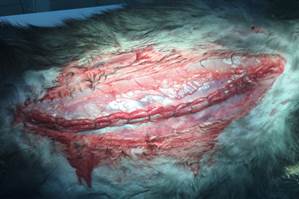
Рис. 5. PCST. Диссекция тканей задних слоев брюшной стенки с пересечением поперечной мышцы живота |
Рис. 6. PCST. Задние слои брюшной стенки ушиты, брюшная полость закрыта |
|
|
|
|
Рис. 7. PCST. Протезирование брюшной стенки сеткой, располагаемой ретромускулярно |
Рис. 8. PCST. Передние листки влагалищ прямых мышц живота ушиты над сеткой |
Данные эксперимента
|
Параметры |
Группа |
p, Shapiro–Wilk |
Median |
Mean |
Q1 |
Q3 |
IQR |
SD |
p, Mann–Whitney |
|
Масса животных |
ACST |
0,11 |
3,6 |
3,74 |
3,5 |
4 |
0,5 |
0,39 |
0,69 |
|
PCST |
0,12 |
3,6 |
3,71 |
3,45 |
4 |
0,55 |
0,33 |
||
|
Площадь брюшной стенки |
ACST |
0,92 |
288 |
285,07 |
259,75 |
306,25 |
46,5 |
30,09 |
0,85 |
|
PCST |
0,93 |
288 |
287,27 |
270,5 |
302,25 |
31,75 |
22,99 |
||
|
Уменьшение окружности живота |
ACST |
0,001 |
1 |
1,13 |
0 |
2 |
2 |
0,92 |
0,003 |
|
PCST |
0,17 |
2 |
2,53 |
2 |
3,5 |
1,5 |
1,26 |
||
|
Отношение площадей дефекта и брюшной стенки |
ACST |
0,81 |
20,44 |
20,89 |
19,24 |
22,67 |
3,43 |
2,23 |
0,000003 |
|
PCST |
0,71 |
40,89 |
41,26 |
38,96 |
43,55 |
4,59 |
3,38 |
||
|
ВБД до операции |
ACST |
0,06 |
4,4 |
4,42 |
3,7 |
4,8 |
0,9 |
0,83 |
0,44 |
|
PCST |
0,03 |
4,1 |
4,19 |
3,7 |
4,4 |
0,7 |
0,65 |
||
|
ВБД после операции |
ACST |
0,01 |
7,4 |
6,75 |
5,9 |
7,4 |
1,5 |
0,96 |
0,12 |
|
PCST |
0,02 |
7,4 |
7,26 |
6,6 |
8,1 |
1,5 |
0,74 |
||
|
Повышение ВБД |
ACST |
0,02 |
2,2 |
2,33 |
1,75 |
2,6 |
0,75 |
0,75 |
0,01577 |
|
PCST |
0,08 |
3 |
3,07 |
2,9 |
3,5 |
0,6 |
0,61 |
||
|
Продолжительность операции |
ACST |
0,62 |
112 |
111,13 |
100,5 |
121,5 |
21 |
16,97 |
0,08 |
|
PCST |
0,82 |
123 |
121,13 |
115 |
125 |
10 |
8,97 |
Площадь передней брюшной стенки в первой группе была 285,07 см2 (ИКР 259,75–306,25 см), во второй группе – 287,27 см2 (ИКР 270,5–302,25). Площадь грыжевого дефекта в первой группе составляла 58,875 см2, во второй – 117,75 см2, что связано с узким ретромускулярным пространством у данной модели и сложностью моделирования грыжевого дефекта шире 5 см при выполнении ACST в остром эксперименте. Отношение площадей грыжевого дефекта и передней стенки живота в первой группе было 20,89% (ИКР 19,24–22,67), во второй группе – 41,26% (ИКР 38,96–43,55). Тем не менее, в ходе эксперимента у всех животных (в обеих группах) удалось осуществить полную реконструкцию передней брюшной стенки с помощью сепарационной пластики, применять бриджинг не потребовалось. Таким образом, эффективность сравниваемых методик вполне достаточна, при этом с помощью PCST были закрыты достоверно более обширные дефекты брюшной стенки (p=0,000003, Mann–Whitney). Исходные значения ВБД в группах не имели достоверных отличий (p=0,4399, Mann–Whitney). ВБД до операции в первой группе составляло 4,42 мм рт. ст. (ИКР 3,7–4,8), после выполнения передней сепарационной пластики – 6,74 мм рт. ст. (ИКР 5,9–7,4). Это увеличение оказалось статистически значимым (p=0,00001, Mann–Whitney). Во второй группе ВБД до операции составило 4,2 мм рт. ст. (ИКР 3,7–4,4), после осуществления задней сепарационной пластики – 7,26 мм рт. ст. (ИКР 6,6–8,1) соответственно. Указанные изменения также были достоверными (p=0,00002, Mann–Whitney). Следует особо отметить, что конечные значения ВБД после ACST и PCST значимо не отличались (p=0,12, Mann–Whitney). Таким образом, безопасность данных вариантов операции в отношении риска развития компартмент-синдрома вполне сопоставима.
Длительность операции составляла от 80 до 135 мин и в среднем оказалась для первой группы 111 мин (ИКР 100,5–121), для второй 121 мин (ИКР 115–125). Эти различия не были статистически значимыми (р=0,08, Mann–Whitney). Таким образом, осуществление любого способа сепарационной пластики на животных является сопоставимо длительным, сложным и трудоемким процессом, особенно на этапе освоения и обучения.
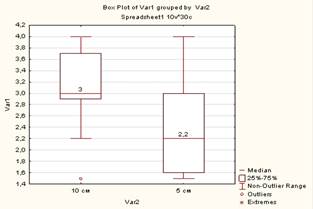
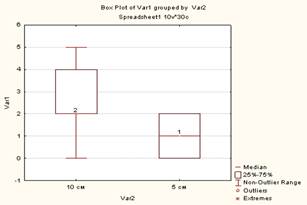
В ходе эксперимента установлена взаимосвязь между шириной грыжевого дефекта и уменьшением окружности талии животного после операции. В первой группе ширина грыжевых ворот составляла 5 см, окружность талии уменьшилась на 1,13 см (ИКР 0–2), во второй ширина грыжевого дефекта была 10 см, уменьшение окружности талии оказалась 2,53 см (ИКР 2–4). Различия оказались статистически достоверны (p=0,003, Mann–Whitney). Данные представлены на рисунке 9. Установлена достоверная взаимосвязь между шириной грыжевых ворот и повышением ВБД. В первой группе ВБД повысилось в среднем на 2,33 мм рт. ст. (ИКР 1,75–2,6), во второй – на 3,07 мм рт. ст. (ИКР 2,9–3,5). Различия оказались достоверны (p=0,01577, Mann–Whitney). Данные представлены на рисунке 10.
|
|
|
|
Рис. 9. Взаимосвязь между шириной грыжевого дефекта и уменьшением объема талии. По горизонтали: Var 2 – ширина грыжевых ворот при задней сепарации 10 см, при передней 5 см. По вертикали: Var 1 – шкала в см |
Рис. 10. Взаимосвязь между шириной грыжевого дефекта и увеличением ВБД. По горизонтали: Var 2 – ширина дефекта брюшной стенки в первой группе (10 см) и во второй (5 см). По вертикали: Var 1 – увеличение ВБД после операции, мм рт. ст. |
Реконструкция брюшной стенки с помощью сепарационной протезирующей пластики являются технически сложной и трудоемкой процедурой. Данный вид вмешательства требует от хирурга хороших знаний анатомии передней брюшной стенки, опыта и постоянного совершенствования мануальных навыков. Зарубежные коллеги активно создают и внедряют наглядные модели сепарационных методик на кадаверном материале в качестве учебных пособий для демонстрации студентам и ординаторам. Анатомические препараты позволяют наглядно изучать анатомию передней брюшной стенки, четко дифференцировать ее слои, поскольку очень важно понимать и видеть разницу между техниками передней и задней сепарации [10]. Также за рубежом динамично развиваются дополнительные курсы по освоению столь ценных практических навыков. Обучение проводится на трупном материале, непосредственно из рук опытных хирургов-наставников, специалистов в области герниологии, демонстрирующих современные хирургические подходы к осуществлению реконструкции брюшной стенки, основанные на CST как открытым способом, так и с помощью малоинвазивных вмешательств [11, 12].
Осуществление ACST и PCST на лабораторных животных оказалось сложной и кропотливой работой, что связано с трудностями освоения данных методик и анатомическими особенностями строения передней брюшной стенки животного, которые необходимо учитывать. К последним относят практическое отсутствие подкожной, предбрюшинной клетчатки, а также минимальную толщину мышечного каркаса. В ходе работы удалось постепенно, шаг за шагом отработать все этапы выполнения передней и задней сепарации методики, что позволило изучить особенности работы с тканями брюшной стенки животного. С учетом того, что анатомия передней брюшной стенки кролика кардинально не отличается от таковой у человека, можно сделать вывод, что данная экспериментальная модель подходит для детального изучения, отработки, а также совершенствования технических навыков диссекции тканей, обучения распознавания и определения слоев брюшной стенки, а также для изучения сепарационных методик в хроническом эксперименте. Поэтапное освоение CST на кроликах наглядно демонстрирует трудность обучения технике разделения компонентов, учит особенностям работы с живыми тканями, что особенно важно в работе будущих специалистов в клинических условиях.
Заключение. В рамках данного исследования в эксперименте впервые были сравнены две наиболее известные методики сепарационной протезирующей пластики. Получены навыки поэтапного осуществления операций. Установлено, что оба варианта сепарационной пластики у животных являются весьма продолжительными и трудоемкими. Использование передней сепарации позволяет закрыть дефекты, составляющие в среднем 20,44% площади брюшной стенки, применение TAR – еще больших (41,89%). Оба варианта реконструкции сопровождаются достоверным увеличением внутрибрюшного давления, что обусловлено размерами экспериментально созданных грыжевых ворот. Конечные значения ВБД после операции не имели достоверных отличий и не зависели от варианта сепарации. Выбранная экспериментальная модель подходит как для обучения, так и для изучения результатов применения сепарационных методик при моделировании больших грыжевых дефектов.
Библиографическая ссылка
Паршиков В.В., Зарубенко П.А., Базаев А.В., Хазова К.Д., Эсенкулова Э.Э., Волчкова А.Р. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ОПЕРАЦИЙ RAMIREZ II И TAR В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30829 (дата обращения: 05.02.2026).
DOI: https://doi.org/10.17513/spno.30829