Несмотря на то что хромосомная нестабильность и соматический мозаицизм связаны с широким спектром заболеваний, механизмы возникновения данных форм вариабельности генома до настоящего времени остаются загадкой [1, 2]. Тем не менее, в литературе имеются описания катастрофического поведения генома, приводящего к особым видам его нестабильности: хромотрипсис, хромоанасинтез и хромоанагенез [3]. Изучение процессов, лежащих в основе наиболее распространенных типов хромосомной нестабильности и мозаицизма (например, соматической анеуплоидии), показало, что данные формы межклеточной вариабельности генома, вероятно, являются результатом изменений ряда молекулярных/клеточных процессов, связанных с генными и хромосомными мутациями, а также с генетическими взаимодействиями с окружающей средой. В биомедицинском контексте становится необходимой оценка вклада наследственных и спорадических (цито)геномных вариаций на хромосомном и субхромосомном уровнях в формирование геномной нестабильности и соматического мозаицизма с помощью полногеномного анализа и методов, основанных на теории систем (биоинформатики или биологии систем). К сожалению, исследования генных сетей («молекулярных путей», или pathways), связывающих наследуемые/спорадические регулярные аномалии хромосом и/или вариации числа копий последовательностей ДНК (CNV) с хромосомной нестабильностью, крайне редки [4, 5]. Геномная архитектоника на молекулярном уровне (последовательность ДНК), по-видимому, играет определяющую роль в формировании различных вариаций генома. Серия исследований с использованием молекулярных, цитогеномных и биоинформатических методов показала, что структурные геномные варианты (хромосомные перестройки и CNV) часто возникают за счет процессов рекомбинации и репликации ДНК с участием повторяющихся некодирующих последовательностей ДНК, фланкирующих точки разрыва перестроек. На хромосомном или субхромосомном уровнях эти явления до настоящего времени систематически не рассматривались. Однако было показано, что ошибки сегрегации хромосом и непосредственно хромосомная патология формируют широкий спектр соматических перестроек генома [6–8]. В ходе предыдущих исследований геномных вариаций при нервно-психических заболеваниях нами был обнаружен особый тип хромосомной нестабильности и соматического мозаицизма, возникающий за счет регулярных геномных перестроек. Изучение данной формы хромосомной патологии позволило сделать вывод о том, что полногеномный и биоинформатический анализы структурных вариаций хромосом (регулярных и мозаичных) позволяют определять ранее неизвестные механизмы вариабельности соматического генома [7].
Целью настоящего исследования явилась оценка соответствующей формы хромосомной нестабильности и соматического мозаицизма с точки зрения молекулярных аспектов ее возникновения, вклада в этиологию заболеваний центральной нервной системы (ЦНС) у детей и влияния на структурную организацию хромосомной ДНК.
Помимо этого, мы предлагаем цитогеномную теорию о роли специфических форм хромосомной нестабильности в патогенезе различных заболеваний и старении организма человека.
Материал и методы исследования
Молекулярное кариотипирование было выполнено для анализа хромосомных микроаномалий и CNV в российской когорте детей с заболеваниями ЦНС (такими как задержка психомоторного развития, умственная отсталость, аутизм, эпилепсия) и врожденными пороками (микроаномалиями) развития (n=705). Данная когорта была систематически описана в предыдущих исследованиях [7, 9]. SNP-array (молекулярное кариотипирование) выполнялось с помощью биочипов на платформе CytoScan HD Arrays (Affymetrix), включающих в себя примерно 2,7 млн ДНК-маркеров. Использованные методы были неоднократно и подробно описаны ранее [7, 10, 11]. Цитогеномные вариации визуализировали с помощью программного обеспечения Affymetrix ChAS (Chromosome Analysis Suite) (CytoScan® HD Array Version 4.1.0.90/r29400); версия референсного генома — GRCh37/hg19.
Биоинформатический анализ осуществлялся по оригинальной технологии приоритизации CNV, генов-кандидатов и процессов-кандидатов с применением данных молекулярного кариотипирования. Фильтрация и ранжирование генов основываются на их онтологических параметрах, извлеченных из клинических, геномных, эпигенетических, протеомных/интерактомных и метаболических баз данных. Анализ генных сетей проводился с использованием концепции CNVвариома (совокупности всех CNV, выявленных у каждого индивидуума) и протокола, который был подробно описан ранее [12–14]. Кроме того, определялось соотношение между размером регулярной и мозаичной хромосомной аномалии. Используя это соотношение, перестройки ранжировали по квартилям. «Насыщение» CNV, изменяющее генные сети поддержания стабильности генома, определялось с помощью статистического Z-теста.
Это исследование было одобрено этическим комитетом ОСП «Научно-исследовательский клинический институт педиатрии им. академика Ю.Е. Вельтищева» ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России.
Результаты исследования и их обсуждение
С помощью молекулярного кариотипирования российской когорты детей с заболеваниями ЦНС и врожденными пороками развития (n=705) было обнаружено, что сочетание регулярной и мозаичной перестройки в одном и том же хромосомном локусе (охватывающем аналогичные геномные области) выявляется у 57 пациентов (8,1%). Эти совместно локализованные структурные аномалии хромосом проявлялись в виде немозаичных делеций или дупликаций в сочетании с такой же мозаичной перестройкой, которая в основном была больше регулярной. Мы предположили, что совместное расположение этих форм аномалий генома не является случайным. Наблюдаемые изменения генома, скорее всего, представляли собой маркеры динамического процесса, который возникает из-за наличия регулярной перестройки хромосомы или CNV и распространяется посредством увеличивающегося с каждым делением клетки разрыва за счет потери или удвоения фланкирующих хромосомных локусов, приводя к образованию мозаичных вариаций. Фактически, регулярные структурные перестройки связаны с геномной нестабильностью в точках разрыва, которая приводит к более масштабной перестройке из-за нарушений репарации и репликации хромосомной ДНК. Согласно доступной биомедицинской литературе, подобной формы геномной/хромосомной нестабильности другими исследователями описано не было [7]. Обнаруженную форму нестабильности генома мы обозначили с помощью неологизма «хромохелкозис», что буквально означает «изъязвление хромосомы» (от древнегреч. «хромо», обозначающего хромосому, и «хелкоз» (ἕλκoς), означающего образование и распространение язвы или изъязвление). Способ формирования предлагаемого термина соответствует способам, ранее используемым для обозначения других особых типов нестабильности генома, связанных с различной патологией (таких как врожденные пороки развития, онкологические заболевания): хромотрипсис («расщепление хромосом», характеризующееся обильным количеством перестроек и вариабельным числом копий последовательности ДНК), хромоанасинтез (локальное расщепление хромосом, связанное со случайной перестановкой хромосомных фрагментов) и хромоанагенез (сложные перестройки в одном/нескольких локусах, вызванные «катастрофическим» разрушением структуры хромосомы) [3, 8]. На рисунке 1 показаны примеры хромосомных перестроек, связанных с хромохелкозисом.
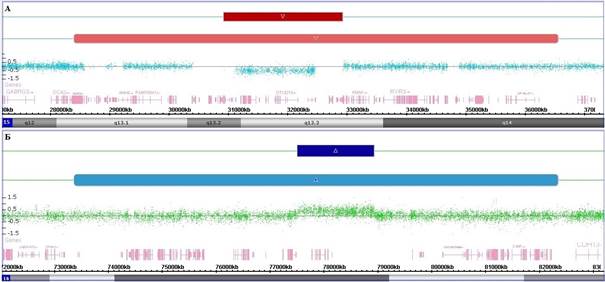
Рис. 1. Хромосомные перестройки, связанные с хромохелкозисом: (А) делеции в участке 15q13.2q13.3 (регулярная) и в участке 15q13.1q14 (мозаичная), (Б) дупликации в участке 16q23.1 (регулярная) и в участке 16q22.3q23.3 (мозаичная)
Обнаружено, что хромохелкозис выявляется в локусах всех хромосом, кроме 6, 8, 18–21 и Y. Перестройки были представлены 30 дупликациями и 27 делециями (53/47). Максимальные размеры регулярных хромосомных аномалий достигали 21,5 млн пн, тогда как минимальный размер CNV составил примерно 13 тыс. пн. Пять случаев хромохелкозиса были рекуррентными (неслучайные вариации в одних и тех же участках генома) (табл.). Это наблюдение позволило нам сделать вывод о том, что специфическая архитектура генома на уровне последовательности ДНК, вероятно, связана с хромохелкозисом.
Хромосомная локализация аномалий (делеций или дупликаций), ассоциированных с хромохелкозисом (n – число случаев)
|
Хромосома/плечо |
Делеция/дупликация |
n |
|
1p |
дупликация |
2 |
|
1q |
дупликация |
1 |
|
2p |
дупликация |
1 |
|
2q |
делеция |
4 |
|
3p |
дупликация |
2 |
|
3q |
делеция |
3 |
|
4q |
делеция |
1 |
|
5q |
делеция |
1 |
|
7p |
дупликация |
1 |
|
делеция |
1 |
|
|
7q |
делеция |
1 |
|
8p |
дупликация |
1 |
|
9p |
дупликация |
1 |
|
делеция |
3 |
|
|
9q |
дупликация |
1 |
|
делеция |
2 |
|
|
10q |
дупликация |
1 |
|
делеция |
1 |
|
|
11q |
дупликация |
1 |
|
12q |
дупликация |
2 |
|
13q |
дупликация |
1 |
|
делеция |
1 |
|
|
14q |
дупликация |
1 |
|
15q |
дупликация |
3 |
|
делеция |
3 |
|
|
16p |
дупликация |
1 |
|
16q |
дупликация |
1 |
|
делеция |
1 |
|
|
17p |
дупликация |
1 |
|
делеция |
1 |
|
|
17q |
делеция |
2 |
|
22q |
дупликация |
5 |
|
Xp |
дупликация |
1 |
|
Xp |
делеция |
2 |
|
Xq |
дупликация |
2 |
Были также выявлены реципрокные перестройки хромосом, ассоциированные с хромохелкозисом (делеции и дупликации в одном и том же хромосомном/геномном районе), в участках 9p24.3, 9q34.13q34.3 и 15q11.2. Этот факт подтверждает предположение о том, что специфичность локальной геномной архитектуры делает отдельные локусы восприимчивыми к геномным/хромосомным перестройкам [6]. Однако для эффективного определения молекулярных основ хромохелкозиса потребовался дополнительный анализ, в ходе которого исследовались соотношения размеров регулярных и мозаичных хромосомных аномалий. По этому параметру случаи были разделены на квартили: Q1 – наименьшее соотношение или наибольшее расстояние между точками разрыва регулярной и мозаичной перестройки; Q4 – наибольшее соотношение или кратчайшее расстояние между точками разрыва регулярной и мозаичной перестройки. В результате было обнаружено исключительное преобладание аномалий с резко увеличенными размерами при мозаицизме (Q1). Таким образом, аномалии Q1 с большей вероятностью связаны с высокой степенью локальной нестабильности в точках разрыва и в пораженных хромосомных локусах.
При исследовании хромосомной локализации перестроек, ассоциированных с хромохелкозисом, было обнаружено, что он может быть связан с клиническими проявлениями (микро)делеционных и (микро)дупликационных синдромов за счет прогрессирующего разрыва структуры хромосомы. Среди таковых были микроделеционные и/или микродупликационные синдромы 1p36 (микроделеции и микродупликации), 1q21.1 (микроделеции и микродупликации), 10q22.3q23.2 (микроделеции), 13q33q34 (микроделеции), 14q32 (микродупликации), 15q13.3 (микроделеции), 15q14 (микроделеции), 17p13.3 (микродупликации), 22q11.2 (микроделеции и микродупликации), 22q13 (микродупликации), Xq21 (микроделеции) и Xq28 (микродупликации), а также синдромы терминальной делеции коротких плеч хромосом 3, 9, 11, Вильямса, Ангельмана, Прадера–Вилли и Миллера–Дикера. Важно отметить, что клинические проявления данных синдромов соответствовали в большей степени перестройкам, которые образовались за счет хромохелкозиса (мозаичным). Большинство из них были представлены стертой клинической картиной. Таким образом, корреляции кариотип – фенотип свидетельствуют о том, что хромохелкозис имеет значение для клинико-генетической характеристики детей с заболеваниями ЦНС, обусловленными хромосомной патологией, примерно в 8% случаев.
С использованием ранее предложенной модели анализа CNV в каждом индивидуальном геноме [14] и статистического Z-теста было проведено соответствующее исследование у детей с хромохелкозисом. Было обнаружено, что данная форма хромосомной нестабильности и соматического мозаицизма связана с увеличением числа CNV, затрагивающих гены, которые вовлечены в сети поддержания стабильности генома (репарация ДНК, запрограммированная гибель клеток, регуляция клеточного цикла) за счет, своего рода, «насыщения» CNV. Наблюдалась также корреляция между более высокой нагрузкой CNV и показателем прогрессирования хромохелкозиса.
С учетом специфики организации повторяющихся элементов генома человека, которые предположительно участвуют в организации и стабильности генома [15], было сделано предположение о том, что вариабельность и локализация некодирующей сателлитной ДНК могут влиять на прогрессирование хромохелкозиса. Эта идея выглядит особенно перспективной в свете анализа перицентромерной сателлитной ДНК хромосом человека, вариации (хромосомные варианты) которой на протяжении долгих лет ассоциируют с различными процессами, обеспечивающими сохранность структуры и числа хромосом, продление жизни клетки, а также с различными патологическими состояниями (болезнями мозга, малигнизацией, бесплодием). Несмотря на это, достоверных данных относительно непосредственного функционального значения перицентромерной сателлитной ДНК, формирующей участки хромосомных вариантов, представлено не было [16, 17]. Поскольку хромохелкозис за счет прогрессирования может затрагивать данные последовательности, возникает потребность изучения роли участия хромосомных вариантов в процессах сохранения стабильности генома на хромосомном уровне. В связи с этим было проведено исследование хромосомных вариантов у детей с хромохелкозисом. Хромосомные варианты (по хромосомам: 1, 9, 13, 15, 16, 21, 22 и Y) обнаружены у 24 (42,1%) пациентов из 57 детей с хромохелкозисом (рис. 2). В 16 случаях (28,1%) это были одиночные (изолированные) хромосомные варианты: по хромосоме 15 – 4 случая (7%); по хромосомам 9 и Y – по 3 случая (5,3%); по хромосомам 13 и 21 – по 2 случая (3,5%); по хромосомам 1 и 22 – по 1 случаю (1,75%). Сочетанные хромосомные варианты выявлялись в 8 случаях из 57 (14%): 1 случай – 9qh+,16qh+; 3 случая – 9 phqh,21ps+; 4 случая – 9 phqh,9qh-. Во всех сочетанных случаях выявлена хромосома 9 в виде перицентромерных инверсий и увеличения/уменьшения перицентромерного гетерохроматина. Всего было обнаружено 14 различных хромосомных вариантов, включая сочетанные и одиночные: 1qh-, 9phqh, 9ph, 9qh+, 9qh-, 13рs+, 15cenh+, 15ps+, 16qh+, 21ps+, 21pss, 22ps+, Yqh+, Yqh-. В большинстве случаев (n=11) изолированных и сочетанных вариантов выявлена хромосома 9 (с хромосомами 21 и 16 в сочетанном виде). Рассматривая корреляцию наличия хромосомных вариантов и хромохелкозиса, мы пришли к выводу о том, что перицентромерная сателлитная ДНК может выступать, своего рода, «защитником» от прогрессирующей нестабильности, которая разрушает хроматиновые структуры, обеспечивающие функции центромеры.
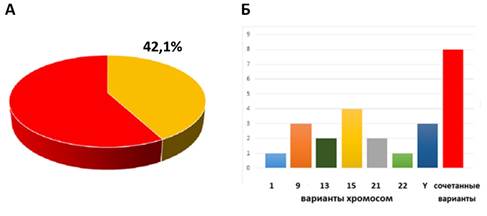
Рис. 2. Хромосомные варианты у детей с хромохелкозисом: (А) частота хромосомных вариантов в группе детей с хромохелкозисом (n=57); (Б) вклад изменений гетерохроматиновых участков по отдельным хромосомам в общее число хромосомных вариантов у детей с хромохелкозисом
Учитывая, что соматическая вариабельность генома ассоциирована с широким спектром различных процессов, происходящих в организме человека в норме и при патологии [18], ее моделирование может иметь исключительное значение для понимания механизмов генетически обусловленных заболеваний. Мы полагаем, что хромохелкозис может представлять модель вариабельности соматического генома в виде хромосомной нестабильности и мозаицизма. Было предположено, что делеции при хромохелкозисе вызывают локальную нестабильность в точках разрыва, ведущую к прогрессирующей потере соседних хромосомных областей. В результате этого мозаичные делеции обладают большим размером, чем регулярные. Этот механизм подобен тому, который обусловливает разрывы за счет локальной нестабильности в участках ломкости хромосом [19]. Хромохелкозис происходит за счет подобной нестабильности в двух точках разрыва перестройки, в результате чего «разрыв» хромосомной ДНК распространяется проксимально и дистально по длине хромосомы. Если хромохелкозис затрагивает центромеру, то должна произойти потеря всей хромосомы при последующем делении клетки. Примечательно, что нарушение стабильности центромеры (например, «расщепление» центромеры) ранее ассоциировалось с хромосомной нестабильностью и соматической анеуплоидией [20, 21]. Более того, косвенные данные указывают на то, что перицентромерная сателлитная ДНК (конститутивный гетерохроматин) участвует в обеспечении стабильности генома/хромосом [22, 23]. Следовательно, последствия воздействия хромохелкозиса на последовательности ДНК конститутивного гетерохроматина приведут к соматической анеуплоидии (потере хромосомы или мозаичной моносомии). Поскольку теломерные ДНК сохраняют стабильность концевых участков хромосом [24], последствия воздействия хромохелкозиса на данные последовательности будут связаны с хромосомными перестройками, возникающими за счет нарушения терминальных участков. На рисунке 3 схематически показан предполагаемый механизм хромохелкозиса, связанный с делециями.
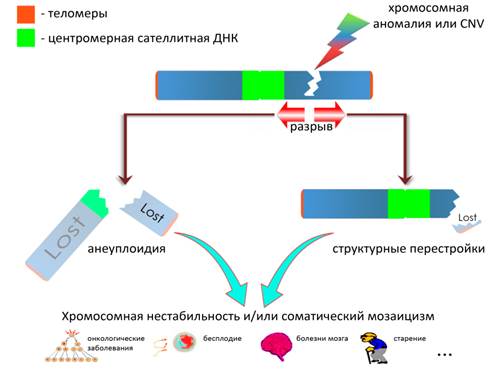
Рис. 3. Схематическое изображение механизма хромохелкозиса, связанного с делециями, и цитогеномной «теории всего». Хромосомная аномалия или CNV (делеция) вызывает нестабильность в точках разрыва, которая приводит к дальнейшему разрыву хромосомы: если разрыв затрагивает сателлитные ДНК, то возникает хромосомная нестабильность либо в виде анеуплоидии (потери хромосомы или моносомии) в случае нарушения перицентромерной ДНК, либо в виде структурных перестроек при нарушении теломерной ДНК
Хромохелкозис, связанный с дупликациями, вероятно, является причиной сбоев репарации хромосомной ДНК в точках разрыва, прогрессирующих из-за нарушения соответствующих геномных сетей и локальной нестабильности на молекулярном уровне. Похожие механизмы образования хромосомной нестабильности ранее предлагались для объяснения клональной эволюции геномных перестроек в раковых клетках [5, 20]. Эти дупликации могут также затрагивать кластеры повторяющейся (сателлитной) ДНК, обеспечивая прогрессирующий характер изменения структуры хромосом при хромохелкозисе. Вероятно, «превращение» делеций, подверженных хромохелкозису, в соматическую анеуплоидию (моносомию), приводящее к фактическому исчезновению самой делеции, обусловливает преобладание в исследованной группе дупликаций, которые увеличиваются в размере при данной форме хромосомной нестабильности.
Соматический мозаицизм и хромосомная нестабильность вносят значительный вклад в развитие организма человека и его гомеостаз (внутриутробное развитие плода и старение), обеспечивают межиндивидуальное и межклеточное разнообразие, а также являются распространенной генетической причиной многих заболеваний (онкологических заболеваний; болезней мозга; бесплодия; нарушения функционирования внутренних органов при старении) [1, 2, 4, 25–29]. Роль данных форм вариабельности генома довольно сложно переоценить. Учитывая высокую частоту хромохелкозиса среди детей с заболеваниями ЦНС и врожденными пороками развития, а также исключительное значение соматического мозаицизма и хромосомной нестабильности для нормального и аномального функционирования организма, мы предложили цитогеномную теорию (рис. 3), суть которой заключается в том, что в геноме каждого человека присутствует определенный набор CNV, или перестроек, которые при нарушении генных сетей сохранности геномной стабильности могут быть подвержены хромохелкозису. Последствиями такого процесса могут стать вышеуказанные заболевания, а также патологические процессы, связанные со старением. На наш взгляд, предложенная теория напоминает «теорию всего», сформулированную Стивеном Хокингом и Леонардом Млодином [30], поскольку она также претендует на объяснение «почти всех» процессов, связанных с вариабельностью структуры хромосомы в онтогенезе. В связи с этим мы метафорично обозначили эту теорию словосочетанием «цитогеномная теория всего». Признавая существование возможных ограничений данной теории, мы, тем не менее, полагаем, что необходимы дальнейшие исследования хромохелкозиса для понимания структурной изменчивости и пластичности генома.
Заключение
В настоящей работе было выявлено сочетание регулярных и мозаичных аномалий (делеций/дупликаций) в одних и тех же хромосомных локусах. Подробное изучение этого феномена с помощью оригинальных методов системной геномики (биоинформатики) позволило обнаружить необычную форму хромосомной нестабильности — хромохелкозис. Дальнейшее исследование хромохелкозиса привело к тому, что было обозначено функциональное значение классической/альфа-сателлитной ДНК («защита» центромеры от прогрессирующего разрыва хромосомы, вызванного хромохелкозисом), а также предложена «цитогеномная теория всего», объясняющая роль хромохелкозиса в генетически обусловленных болезнях мозга, онкологических заболеваниях и патологических процессах, связанных со старением. Предполагается, что хромохелкозис является результатом кумулятивного эффекта хромосомных перестроек (CNV) и мутационной нагрузки, которая изменяет генные сети сохранности стабильности генома. Таким образом, целью ряда последующих цитогеномных исследований должно стать определение спектра вариаций генома, ведущих к хромохелкозису, и роли последнего в широком спектре заболеваний, ассоциированных с хромосомной нестабильностью и соматическим мозаицизмом.
Работа была частично поддержана грантом РФФИ и CITMA (Ciencia, Tecnología y Medio Ambiente de la República de Cuba) в рамках научного проекта № 18-515-34005, а также частично Госзаданием Министерства науки и высшего образования России № AAAA-A19-119040490101-6 и частично Госзаданием Минздрава России № 121031000238-1.
Библиографическая ссылка
Юров И.Ю., Ворсанова С.Г., Куринная О.С., Зеленова М.А., Васин К.С., Демидова И.А., Харламова А.А., Юров Ю.Б., Куцев С.И. ХРОМОХЕЛКОЗИС — НЕОБЫЧНАЯ ФОРМА ХРОМОСОМНОЙ НЕСТАБИЛЬНОСТИ И СОМАТИЧЕСКОГО МОЗАИЦИЗМА, СВЯЗАННАЯ С БОЛЕЗНЯМИ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ У ДЕТЕЙ // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30817 (дата обращения: 03.01.2026).
DOI: https://doi.org/10.17513/spno.30817



