Качество зрения человека в большой степени зависит от состояния роговицы, поскольку она выполняет функцию защиты структур передней камеры, а также является важным элементом оптического аппарата глаза, обеспечивая две трети его преломляющей силы [1]. При возникновении различных патологий роговицы, приводящих к нарушению ее морфологической структуры и функции, нередко требуется ее трансплантация – кератопластика, являющаяся одной из самых распространенных операций по пересадкам солидных тканей в мире. Обычно кератопластика не требует системной иммуносупрессии или тканевого типирования в силу наличия механизмов иммунной привилегии роговицы и передней камеры глаза, что обеспечивает высокую (до 90% случаев) частоту приживления роговичных трансплантатов. Однако в случае нарушения иммунной привилегии роговицы или иных патологий может развиться реакция отторжения трансплантата, что в итоге приведет к его помутнению [2]. В связи с вышеизложенным особенно актуальным становится поиск методов профилактики и терапии отторжения донорской роговицы после кератопластики, среди которых потенциальный интерес представляет плазмаферез, как метод эфферентной терапии, уже активно применяющийся как в трансплантологии, так и при лечении различных офтальмологических заболеваний.
Цель данного обзора – проанализировав известную информацию об использовании плазмафереза в трансплантологии, оценить потенциальные перспективы его применения для предотвращения и терапии отторжения донорской роговицы при ее пересадке.
Плазмаферез как метод экстракорпорального очищения крови позволяет осуществить удаление из ее плазмы патологических элементов, например аутоантител, токсинов, липидов, циркулирующих иммунных комплексов провоспалительных цитокинов [3; 4], что обеспечивает его эффективность в терапии различных заболеваний. Согласно рекомендациям Американского общества афереза от 2016 года, плазмаферез является методом выбора для терапии острого быстро прогрессирующего гломерулонефрита, тромботической тромбоцитопенической пурпуры, синдрома Гийена-Барре, синдрома Гудпастура и отторжения сердечного аллотрансплантата [5].
Согласно Руководству Американского общества афереза по использованию терапевтического афереза, выделяют четыре категории заболеваний, для которых рекомендовано применение данной процедуры.
I категория – в данную категорию входят заболевания, для которых аферез является терапией первой линии либо в качестве основного самостоятельного лечения, либо в сочетании с другими методами лечения.
II категория – заболевания, при которых аферез считается терапией второй линии либо как отдельное лечение, либо в сочетании с другими методами лечения.
III категория – оптимальная роль терапии аферезом не установлена. Требуется индивидуальное принятие решений.
IV категория – заболевания, при которых опубликованные данные демонстрируют или предполагают, что аферез неэффективен или вреден [6; 7].
Весьма широкое применение плазмаферез, наравне с другими методами эфферентной терапии, находит в офтальмологии, например при лечении идиопатических аутоиммунных ретинопатий за счет выведения из крови антиретинальных антител. Также плазмаферез является эффективным средством лечения возрастной макулярной дегенерации и фокоанафилактического эндофтальмита после операций по удалению катаракты [3] и оптиконевромиелита [8].
Отдельно стоит отметить значимость плазмафереза в трансплантологии. Так, согласно ретроспективному исследованию, проведенному J. Schmidt и соавторами, значительная часть всех сеансов плазмафереза приходится на случаи, связанные с трансплантацией [9]. Трансплантация представляет собой один из лучших на сегодняшний день подходов к лечению пациентов с терминальной органной недостаточностью. Однако часто потенциальная польза от трансплантации резко ограничена из-за недостаточной доступности подходящих донорских органов, а также из-за ограниченной продолжительности нормального функционирования пересаженного органа [10]. В качестве ведущих причин отторжения трансплантата в настоящее время называют иммунологические процессы, связанные как с клеточно-опосредованным отторжением трансплантата, так и с гуморальным звеном иммунитета, на которые можно повлиять с помощью плазмафереза [11; 12].
Описание некоторых технологий афереза. Плазмаферез при отторжении аллотрансплантата может быть применен как для лечения самого отторжения, так и для профилактики отторжения при наличии высокого риска его развития. Чаще всего плазмаферез применяется в сочетании с другими методами, направленными на подавление отторжения аллотрансплантата, в частности вместе с иммуносупрессивной терапией [11; 13]. В качестве способа терапии отторжения трансплантата могут использоваться различные варианты афереза, среди которых наиболее известны – иммуноадсорбция, терапевтический плазмообмен, плазмаферез с двойной фильтрацией и экстракорпоральный фотоферез [3; 13].
Сущность терапевтического плазмообмена состоит в разделении плазмы и форменных элементов крови ex vivo, после чего плазма пациента удаляется, заменяясь плазмозамещающими растворами. В качестве последних может быть использован 5% раствор человеческого сывороточного альбумина или свежезамороженная плазма [14; 15]. Для разделения плазмы и форменных элементов при плазмаферезе применяются два метода – фильтрационный и гравитационный. Фильтрационный плазмаферез основан на использовании специальных плазмофильтров из полых пористых волокон, гравитационный заключается в осаждении эритроцитарной массы в специальных центрифугах [3]. Упрощенная схема процедуры плазмафереза представлена на рисунке 1.
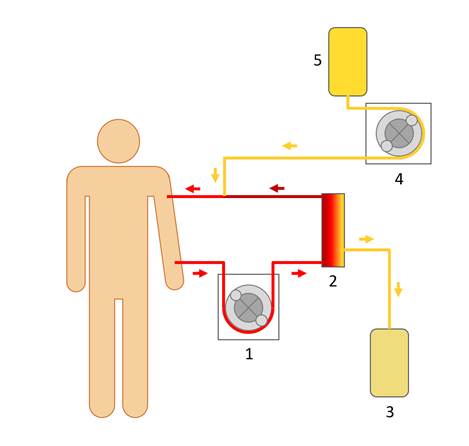
Рис. 1. Упрощенная схема терапевтического плазмообмена: 1, 4 – роликовые насосы; 2 – плазмофильтр или центрифуга для отделения плазмы от форменных элементов; 3 – удаленная плазма пациента с антителами; 5 – плазмозамещающий раствор
Данная процедура позволяет снизить уровень высокомолекулярных соединений в крови, воздействуя, таким образом, на гуморальное звено иммунитета при отторжении трансплантата [15]. Проблема эффективности терапевтического плазмообмена при трансплантации различных органов в настоящее время находится в процессе активной разработки. Наиболее полные и обширные данные об успешном применении терапевтического плазмообмена имеются для трансплантации почек, особенно AB0-несовместимой [11; 16]. Тем не менее данный метод не лишен недостатков. Среди них – необходимость применения большого количества донорских компонентов крови, возможность развития аллергических реакций, передозировка антикоагулянтами, цитратная интоксикация и др. [13; 17; 18].
Решением вышеуказанных проблем терапевтического плазмообмена может являться снижение использования донорских компонентов крови, либо в идеале – полный отказ от их использования, что может быть достигнуто путем каскадной плазмофильтрации. При выполнении каскадной плазмофильтрации сначала, как и при обычном плазмаферезе, происходит разделение крови на форменные элементы и плазму. Однако далее, вместо возмещения утраченного объёма жидкой части крови свежезамороженной донорской плазмой или раствором альбумина, производится фильтрация отделенной от эритроцитарной массы собственной плазмы пациента с удалением высокомолекулярных компонентов наиболее крупного размера, к которым относятся антитела, принимающие участие в отторжении трансплантата, с сохранением альбумина и иных соединений, необходимых для нормального выполнения плазмой своих функций. Обычно каскадная плазмофильтрация осуществляется с использованием систем фракционирования плазмы с различными размерами пор - 10, 20 и 30 нм. В итоге пациенту при каскадной плазмофильтрации вместо донорских компонентов возвращается его же плазма, только очищенная от антител и других патологических компонентов, что исключает развитие многих осложнений, характерных для обычного плазмафереза [13; 19].
Наиболее совершенным методом афереза является иммуносорбция, позволяющая осуществить высокоселективное удаление определенных молекул, в том числе иммуноглобулинов, из плазмы крови. Упрощенная схема, демонстрирующая принцип иммуносорбции, представлена на рисунке 2.
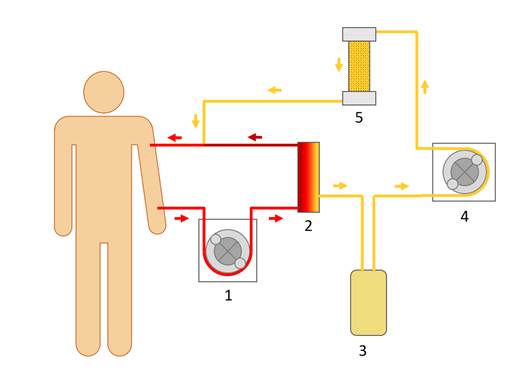
Рис. 2. Иммуносорбция: 1, 4 – роликовые насосы; 2 – плазмофильтр или центрифуга для отделения плазмы от форменных элементов; 3 – плазма пациента; 5 – иммуносорбционная колонка
По ключевым моментам техники выполнения она имеет сходство с вышеописанным методом каскадной плазмофильтрации. Сначала также происходит разделение крови на форменные элементы и плазму, после чего плазма проходит через специальные сорбционные колонки, заполненные адсорбентами, имеющими сродство с определенными молекулами. Далее происходит возврат плазмы, очищенной от нежелательных молекул, обратно пациенту. Используемые адсорбенты позволяют осуществлять извлечение целевых молекул разными путями, например – путем связывания молекул с антителами к ним, иммобилизованными на поверхности иммуносорбента. Также возможно использование в качестве лигандов рецепторов к извлекаемым молекулам, полученным синтетическим путем. Иммуносорбция обладает наибольшей степенью селективности среди всех методов коррекции состава плазмы, описанных в данном обзоре [19; 20].
Выше были описаны методы, позволяющие скорректировать состав плазмы, однако стоит упомянуть, что для влияния на клеточные звенья иммунитета при отторжении трансплантата возможно и селективное удаление определенных клеток методом иммуномагнитного и центрифужного цитофереза [19]. Еще одним методом, влияющим преимущественно на клеточный компартмент, является экстракорпоральный фотоферез. Данная процедура состоит из следующих этапов: отделение лейкоцитарной массы от других компонентов крови посредством центрифугирования (лейкофереза), введение фотосенсибилизатора, например 8-метоксипсоралена (8-MOP), в полученный клеточный продукт, последующая активация фотоактивного соединения путем облучения длинноволновым ультрафиолетом (320-400 нм). После суточного инкубационного периода обработанная лейкоцитарная масса реинфузируется обратно в кровеносное русло пациента [21].
Хотя механизмы, обеспечивающие эффективность данного метода в отношении предотвращения отторжения аллотрансплантата, известны не до конца, определенное представление о некоторых происходящих при экстракорпоральном фотоферезе процессах имеется. Известно, что 8-МОП, проникая через клеточные мембраны лимфоцитов и моноцитов, после воздействия ультрафиолета вызывает их апоптоз, обладая, таким образом, цитотоксическим эффектом. Инъекция апоптотических клеток оказывает на иммунную систему модулирующее влияние. Кроме того, анализ поверхностных антигенов до и после процедуры экстракорпорального фотофереза выявил популяцию дендритных клеток с повышенной фагоцитарной способностью, которые подавляют Т-лимфоциты. Ключевым моментом является то, что данный метод позволяет вместо генерализованной иммуносупрессии, обладающей большим количеством побочных эффектов, осуществить селективный контроль именно над аллореактивными Т-клетками, ответственными за возникновение реакции трансплантата против хозяина [22].
Плазмаферез при наличии антител против HLA и при AB0-несовместимой трансплантации. Около 30% пациентов-реципиентов имеют антитела против человеческих лейкоцитарных антигенов (HLA) [23], наличие которых может быть следствием предшествующих трансфузий, беременности или ранее проведённых трансплантаций. Антитела против HLA синтезируются зрелыми В-лимфоцитами и плазматическими клетками, представляя собой иммуноглобулины класса G, имеющие молекулярную массу около 160 кДа. Высокий титр данных антител оказывает негативное влияние на результаты последующей трансплантации, приводя к ухудшению работы трансплантированного органа, задержке восстановления его функции, и способствуют его отторжению [24-26]. Благодаря новым иммуносупрессивным препаратам и разработке инновационных протоколов лечения сегодня возможно преодолеть барьер для иммунизации. Следует подчеркнуть, что ряд подобных протоколов включает в себя в том числе и процедуру плазмафереза [27; 28]. Хотя при трансплантации легких или трансплантации печени от умершего донора еще не имеется достаточного уровня доказательности, для целого ряда других процедур, таких как трансплантация почки от живого донора, трансплантация сердца, а также при трансплантации печени от живого донора, имеются данные, говорящие об эффективности терапевтического плазмообмена в качестве десенсибилизирующего лечения. Американским обществом афереза плазмаферез при операциях по трансплантации сердца был отнесен ко II категории как для лечения, так и для профилактики его отторжения, а при трансплантации печени от живого донора – к I категории [11].
Плазмаферез позволяет не только преодолеть имеющийся при трансплантации донорских органов иммунологический барьер, но также позволяет решить проблему осуществления AB0-несовместимой трансплантации [29]. Нередко AB0-несовместимая трансплантация является единственным вариантом, когда имеются показания к выполнению трансплантации, но при этом отсутствует подходящий AB0-идентичный или AB0-совместимвый донор [30; 31]. Роль анти-A и анти-B антител при выполнении AB0-несовместимой трансплантации заключается в их способности фиксировать белки системы комплемента на поверхности клетки, запуская, таким образом, каскад процессов, приводящий в итоге к лизису клетки. Впервые подавить отторжение AB0-несовместимого трансплантата удалось в 1981 году при помощи плазмафереза [32]. Сейчас используемые протоколы десенсибилизации при AB0-несовместимой трансплантации подразумевают выполнение данного процесса единовременно с десенсибилизацией к HLA в одном протоколе [11]. Также стоит отметить, что Американское общество афереза относит AB0-несовместимую трансплантацию почки к I категории, т.е. при данной операции плазмаферез является терапией первой линии [6].
Обсуждение. Несмотря на малую изученность вопроса о применении плазмафереза, именно при трансплантации роговицы в настоящее время проанализированный материал о применении плазмафереза при трансплантации других органов и тканей, а также в лечении различных офтальмологических заболеваний позволяет выдвинуть предположения о наиболее вероятных патологических процессах, происходящих при отторжении трансплантированной роговицы, на которые можно воздействовать с помощью данного метода эфферентной терапии. Риск развития отторжения кератотрансплантата существенно возрастает при повторной пересадке роговицы, что связывают в том числе и с возможной пресенсибилизацией [33]. Поскольку плазмаферез позволяет добиться десенсибилизации, его использование при повторных трансплантациях роговицы может быть целесообразным. Также рядом исследователей были получены результаты, говорящие о важности AB0-совместмости донора и реципиента при выполнении кератопластики высокого риска [34], хотя другими авторами AB0-совместимость не считается фактором, оказывающим существенное влияние на успех операции и приживление трансплантата [35]. Очевидно, что данный вопрос еще требует дополнительного изучения, однако в случае подтверждения важной роли антигенов AB0-системы в процессе отторжения донорской роговицы плазмаферез, позволяющий преодолеть AB0-несовместимость при трансплантации других органов, может оказаться эффективным в данной ситуации. В отношении HLA-совместимости имеются данные, говорящие о целесообразности типирования на HLA типа I при пересадке роговицы [35], из чего следует потенциальная возможность улучшить приживляемость роговичного трансплантата при HLA-несовместимой трансплантации путем применения плазмафереза. Будучи востребованным методом повышения эффективности терапии различных заболеваний глаз, в том числе аутоиммунной и вирусной природы [36], плазмаферез, таким образом, может снизить влияние факторов риска на исход трансплантации роговицы.
Заключение. Эфферентная терапия имеет в настоящее время достаточно широкий спектр применения в клинической практике, как группа методов, позволяющих улучшить состав крови. Плазмаферез, будучи одним из ключевых методов эфферентной терапии, находит свое применение в трансплантологии для борьбы с отторжением аллотрансплантатов, особенно в случае пересадки органов, имеющих несовместимость по каким-либо антигенным свойствам. Его применение еще находится в стадии активной разработки – для одних органов уже накоплено достаточно материала и имеется обширный опыт применения плазмафереза, позволяющий говорить о его эффективности. Применение же плазмафереза при пересадке других органов и тканей еще находится в стадии активного изучения и накопления необходимого объёма данных, которые позволят сделать вывод о его эффективности. В офтальмологии плазмаферез, наравне с другими методами эфферентной терапии, уже активно используется для лечения множества различных патологий [37-39]. Сочетание активного интереса к методу плазмафереза, как в области трансплантологии, так и в офтальмологии, обеспечивает потенциально высокие перспективы в изучении эффективности плазмафереза при выполнении офтальмологических операций, связанных с трансплантацией, в том числе – роговицы.
Библиографическая ссылка
Сахнов С.Н., Мясникова В.В., Романов А.В., Кравченко С.В. ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ ПЛАЗМАФЕРЕЗА ДЛЯ ПРОФИЛАКТИКИ РЕАКЦИИ ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА РОГОВИЦЫ // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30806 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.30806



