Аллергический ринит – распространенное заболевание, охватывающее людей любого возраста, пик которого приходится на подростковый и трудоспособный возраст. Данную патологию часто игнорируют, недооценивают, неправильно диагностируют, проводят нерациональное лечение, что не только вредит здоровью, но и влечет за собой социальные издержки [1]. Аллергический ринит является серьезным заболеванием, имеющим большое клиническое значение, поскольку он служит основным фактором риска развития бронхиальной астмы, что влияет на качество жизни и продуктивность на работе или в школе. На сегодняшний день в лечении аллергического ринита применяют лекарственные препараты, относящиеся к различным фармакотерапевтическим группам. Согласно метаанализу, применение интраназальных кортикостероидов является самым эффективным методом лечения, сопряженным, однако, с развитием многочисленных нежелательных реакций фармакотерапии [2]. Также в лечении аллергического ринита особое место занимают антигистаминные препараты. Гистаминолитики второго поколения из-за их умеренного седативного действия и более значительного и стойкого лечебного эффекта по сравнению с антигистаминными препаратами первого поколения все чаще вытесняют последние в терапевтических стратегиях аллергии. Однако некоторые антигистаминные препараты второго поколения, такие как терфенадин и астемизол, используются редко в силу развития кардиотоксического эффекта. В связи с этим предполагается расширение спектра применения антигистаминов третьего поколения как основных средств в лечении аллергических заболеваний. Высокоселективный антагонист H1-гистаминовых рецепторов – фексофенадин – в ряду антигистаминов третьего поколения обладает самым выраженным антиаллергическим эффектом, не сочетающимся с кардио- и гепатотоксичностью. Кроме того, фексофенадин, выступая в качестве субстрата Р-гликопротеина, не проникает через гематоэнцефалический барьер и не нарушает функцию центральной нервной системы [3]. Моноаммонийная соль глицирризиновой кислоты также характеризуется широким спектром биологической активности, включая наличие антиаллергического действия, что делает данное соединение перспективным в терапии аллергического ринита [4].
Цель исследования. В условиях эксперимента оценить дозозависимое действие фексофенадина гидрохлорида и аммония глицирризината.
Материалы и методы исследования. Скрининговое исследование эффективности интраназального введения фексофенадина гидрохлорида и моноаммонийной соли глицирризиновой кислоты проводилось на модели овальбумин-индуцированного аллергического ринита у 78 мышей линии Balb/c (n=6 в каждой экспериментальной группе). Мышей иммунизировали в течение 14 дней ежедневным интраперитонеальным введением 1%-ного раствора овальбумина (ОВА, Panreac, Испания) с гидроокисью алюминия (квасцы) в соотношении 1:1 в количестве 0,2 мл. На 15-й, 16-й и 17-й день эксперимента животным провоцировали острый аллергический ринит путем интраназальной инстилляции раствора ОВА для иммунизации в объеме 25 мкл в каждую ноздрю. Предварительно (за 30 мин до провокации ринита) осуществляли интраназальное введение изучаемого спрея и препаратов сравнения [5]. Фексофенадина гидрохлорид и моноаммонийную соль глицирризиновой кислоты вводили интраназально в виде истинных растворов с рН 7,4 (10 мкл в каждую ноздрю) в конечной концентрации 1 мг/мл – 10 мг/мл с коэффициентом арифметической прогрессии дозы, равным 1 [5]. В качестве препарата сравнения использовали левокабастин («Tyzine® Allergy», Johnson & Johnson) в дозе 5 мкг/ноздря [12]. Введение фексофенадина гидрохлорида, моноаммонийной соли глицирризиновой кислоты и референта осуществляли за 30 мин до провокации ринита. После последней инстилляции (на 17-й день эксперимента) у мышей регистрировали число актов чихания и число актов параназального груминга. Оценку эффективности производили путем сравнения показателей с показателями группы негативного контроля (НК) и интактных животных (ИЖ). Анализ полученных данных проводился с использованием программного пакета «STATISTICA 6.0». Результаты выражали в виде M±SEM (среднее значение ± стандартная ошибка среднего). Сравнение средних осуществляли методом ANOVA с пост-тестом Ньюмена–Кейлса в случае подчинения данных закону нормального распределения и критерием Краскелла–Уоллиса при распределении данных, отличном от нормального. Отличия между исследуемыми группами считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
В результате исследования было установлено, что у НК группы мышей наблюдалось увеличение (в сравнении с ИЖ группой) числа актов чихания (рис. 1) в 19,6 раза (p<0,05) и числа актов околоносового груминга (рис. 3) в 8,6 раза (p<0,05). На фоне введения левокабастина отмечено снижение количества эпизодов чихания и груминга по отношению к НК группе мышей на 35,0% (p<0,05) и 30,1% (p<0,05) соответственно. При интраназальной инстилляции животным с аллергическим ринитом фексофенадина гидрохлорида было отмечено, что при увеличении дозы с 1 мг/мл до 3 мг/мл наблюдается повышение терапевтического эффекта, при этом число актов чихания (рис. 1) и груминга (рис. 3) у мышей, которым вводили фексофенадина гидрохлорид в дозе 3 мг/мл, уменьшилось в сравнении с НК группой животных на 58,8% (p<0,05) и 61,2% (p<0,05) соответственно. Следует отметить, что дальнейшее увеличение дозы фексофенадина гидрохлорида не приводило к существенному изменению терапевтического эффекта (рис. 1, 3). Введение мышам моноаммонийной соли глицирризиновой кислоты в диапазоне доз 1 мг/мл – 10 мг/мл характеризовалось развитием эквивалентного фармакологического эффекта без преимущественного повышения активности при увеличении вводимой дозы (рис. 2, 4).
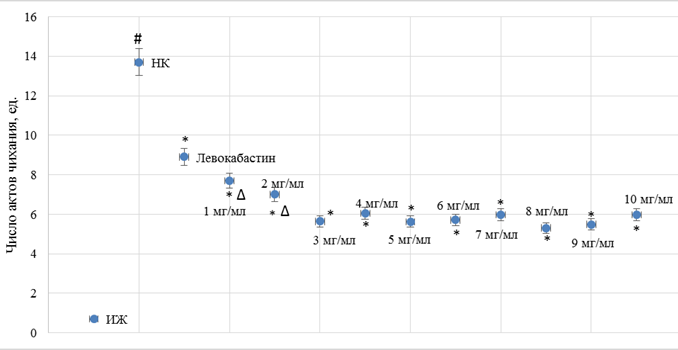
Рис. 1. Влияние различных доз фексофенадина гидрохлорида и левокабастина при интраназальном введении на изменение количества актов чихания у аллергизованных мышей
Примечание: # – достоверно относительно ИЖ группы (критерий Ньюмена–Кейлса (p<0,05)); * – достоверно относительно НК группы (критерий Ньюмена–Кейлса (p<0,05)); Δ – достоверно относительно дозы 3 мг/мл (критерий Ньюмена–Кейлса (p<0,05)).
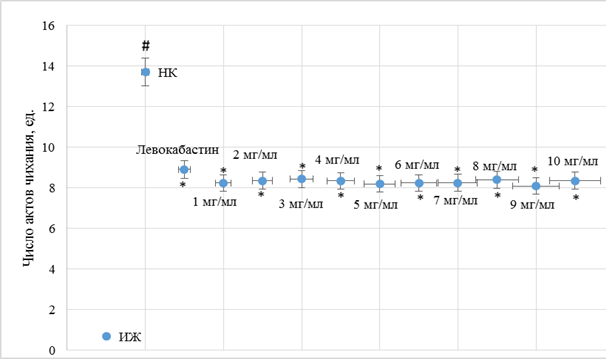
Рис. 2. Влияние различных доз моноаммонийной соли глицирризиновой кислоты и левокабастина при интраназальном введении на изменение количества актов чихания у аллергизованных мышей
Примечание: # – достоверно относительно ИЖ группы (критерий Ньюмена–Кейлса (p<0,05)); * – достоверно относительно НК группы (критерий Ньюмена-Кейлса (p<0,05)); данные ИЖ, НК групп и группы мышей, получавших левокабастин, аналогичны таковым на рисунке 1.
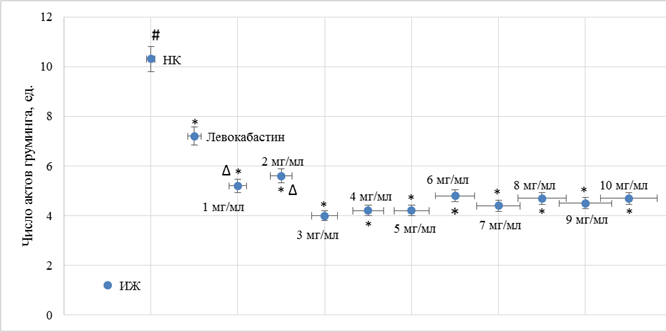
Рис. 3. Влияние различных доз фексофенадина гидрохлорида и левокабастина при интраназальном введении на изменение количества актов параназального груминга у аллергизованных мышей
Примечание: # – достоверно относительно ИЖ группы (критерий Ньюмена–Кейлса (p<0,05)); * – достоверно относительно НК группы (критерий Ньюмена–Кейлса (p<0,05)); Δ – достоверно относительно дозы 3 мг/мл (критерий Ньюмена–Кейлса (p<0,05)).
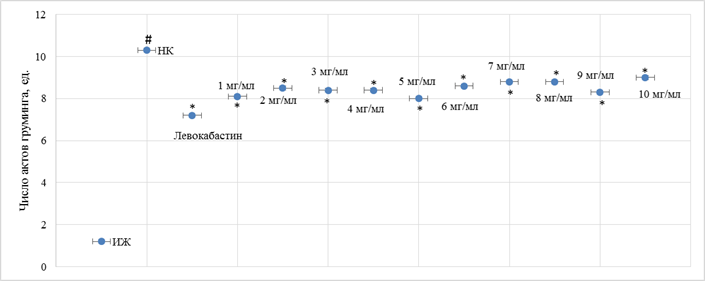
Рис. 4. Влияние различных доз моноаммонийной соли глицирризиновой кислоты и левокабастина при интраназальном введении на изменение количества актов параназального груминга у аллергизованных мышей
Примечание: # – достоверно относительно ИЖ группы (критерий Ньюмена–Кейлса (p<0,05)); * – достоверно относительно НК группы (критерий Ньюмена–Кейлса (p<0,05)); данные ИЖ, НК групп и группы мышей, получавших левокабастин, аналогичны таковым на рисунке 1.
Аллергический ринит (АР) является распространенной патологией респираторной системы с высоким текущим уровнем заболеваемости и неблагоприятными прогностическими выкладками, показывающими неуклонный рост числа случаев АР как в экономически развитых, так и в развивающихся странах. Кроме того, АР характеризуется значительной коморбидностью с бронхиальной астмой, атопическим дерматитом, синуситом, что значительно снижает качество жизни населения [7].
Имеющиеся на сегодняшний день стратегии фармакотерапии АР предусматривают как системное, так и местное воздействие на организм человека. Часто терапия АР может ограничиться гигиеническими мероприятиями, направленными на элиминацию причинных факторов (ограничение контакта с аллергеном, орошение слизистой оболочки носа солевыми растворами). Однако, как правило, данные методы либо не оказывают должного эффекта, либо их выполнение не представляется возможным (в ряде случаев не удается прервать контакт пациента с аллергеном) [8]. В случае неэффективности/невыполнимости гигиенических мероприятий лечение АР проводят фармакотерапевтическими методами. Основные принципы подбора лекарственных средств с целью терапии АР базируются на оптимальном соотношении эффективности и безопасности применения. Исходя из этого системное лечение АР, как правило, ограничивается пероральным введением антигистаминных препаратов, преимущественно избирательного противоаллергического действия (фексофенадин, дезлоратадин, левоцетиризин), которые эффективно элиминируют основные назальные симптомы АР – чихание, зуд и ринорею [98]. Однако длительное латентное время действия данных средств не позволяет использовать пероральные антигистаминные препараты с должной терапевтической эффективностью в лечении острых форм АР, что может являться предпосылкой создания интраназальных форм антигистаминных препаратов [10]. Преодолеть существующие недостатки лекарственных средств групп блокаторов Н1-гистаминовых рецепторов и глюкокортикоидов возможно за счет рационального комбинированного использования средств данных групп. Доступный на сегодняшний день назальный спрей «Димиста» (флутиказона пропионат/азеластин), хотя и показывает достаточный уровень терапевтической эффективности, но не обеспечивает должной безопасности использования, при этом частота и степень проявления побочных реакций препарата не отличаются от таковых у интраназальных глюкокортикоидов [11]. Проведенное исследование показало, что фексофенадина гидрохлорид и аммония глицирризинат при интраназальном введении способствуют устранению основных назальных симптомов АР. При этом в ряде работ установлено, что аммония глицирризинат имеет свойства эффективного пенетратора и, кроме того, сам обладает антиаллергической активностью. Противоаллергическое действие моноаммонийной соли глицирризиновой кислоты реализуется посредством торможения реакций тканеспецифичных иммунных реакций, а также за счет подавления рилизинга медиаторов аллергии [12].
Таким образом, можно предположить, что при совместном введении фексофенадина гидрохлорида и аммония глицирризината будет отмечаться синергетический эффект с увеличением противоаллергической активности обоих компонентов. В то же время отсутствие увеличения терапевтической эффективности при повышении вводимой дозы фексофенадина гидрохлорида и аммония глицирризината может объясняться активацией системы Р-гликопротеина и уменьшением степени пенетрации веществ через слизистую оболочку носа в силу высокой молекулярной массы.
Заключение
Проведенное скрининговое исследование показало, что интраназальное введение фексофенадина гидрохлорида и моноаммонийной соли глицирризиновой кислоты способствовало устранению симптомов аллергического ринита у мышей. В случае применения фексофенадина гидрохлорида наиболее эффективной дозой можно считать 3 мг/мл, так как повышение вводимой дозы в интервале 4 мг/мл – 10 мг/мл не приводило к значимому увеличению терапевтического эффекта, тогда как введение фексофенадина гидрохлорида в дозах 1 мг/мл и 2 мг/мл оказывало меньшее воздействие на течение аллергического ринита у мышей. Эффективная доза моноаммонийной соли глицирризиновой кислоты составляла 1 мг/мл, поскольку, как и в случае применения фексофенадина гидрохлорида, повышение дозы не сопровождалось увеличением эффективности.
Библиографическая ссылка
Позднякова А.Е., Поздняков Д.И., Лежнева Л.П., Рыбалко И.Е. ДОЗОЗАВИСИМЫЕ ЭФФЕКТЫ ФЕКСОФЕНАДИНА ГИДРОХЛОРИДА И АММОНИЯ ГЛИЦИРРИЗИНАТА В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОГО АЛЛЕРГИЧЕСКОГО РИНИТА // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30753 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30753



