Около трети пациентов с немелкоклеточным раком легкого (НМРЛ) имеют потенциально резектабельную опухоль. Однако только пациенты со стадией IA, подвергнутые хирургическому лечению, имеют низкую частоту рецидивов [1].
Пациенты cо стадией IIIA-N2 вариабельны в тактике ведения, что можно объяснить гистологией опухоли, иммуногистохимией (ИГХ) опухоли, локализацией, размером и статусом N2 [2; 3].
Немаловажным эффектом от неоадъювантного лечения может стать улучшение показателей спирометрии, что является важным критерием отбора пациентов на оперативное лечение. В результате проведенной химиотерапии опухолевые клетки могут терять способность к дальнейшему метастазированию [4; 5].
После проведения неоадъювантной полихимиотерапии (2-3 курса) у 8-12% пациентов происходит полная регрессия опухоли и регионарных метастазов, а у 17-63% частичная регрессия. Данные показатели позволяют выполнить радикальную операции более чем половине пациентов [3; 6].
Согласно метаанализу, проведенному Roth J., Fossella F., Komaki R., применение неоадъювантной химиотерапии и в дальнейшем проведение хирургического вмешательства увеличивает трехлетнюю выживаемость пациентов НМРЛ до 56% по сравнению лишь с одним оперативным лечением, где показатель трехлетней выживаемости остается до 15%. Однако, по другим данным литературы, применение неоадъювантного лечения может приводить к повышению послеоперационных осложнений, а также летальности [7; 8].
Цель работы отразить результаты комбинированного лечения НРМЛ, осложнения хирургического лечения, патоморфоза опухоли и лимфоузлов после проведенной неоадъювантной химиотерапии.
Материалы и методы исследования
С 2018 по 2020 год в торакальном хирургическом отделении номер 6 ГАУЗ «Свердловский областной онкологический диспансер» (СООД) радикально прооперировано 342 пациента по поводу НМРЛ. Из них неоадъювантное лечение получили 48 (14%) пациентов, из них ХТ с последующей дистанционной лучевой терапией (ДЛТ) – 3 (6,3%), ХЛТ - 5 (10,4%) человек, от 2 до 7 курсов полихимиотерапии (ПХТ) – 39 (81,3%). Из них мужчин было 31 (85,4%), женщин - 7 (14,6%). Средний возраст пациентов составил 61,4 года (43-81 год). 34 (70,8%) пациентов страдали центральным раком, 14 (29,2%) – периферическим. Справа заболевание было у 27 (56,3%) человек, слева, соответственно, у 21 (43,7%). По стадии заболевания больные распределились следующим образом (табл. 1).
Таблица 1
Распределение больных по стадиям заболевания
|
Стадия (TNM 7 пересмотр) |
TNM
|
Кол-во пациентов |
% от числа пациентов |
|
|
IIB |
T2bN1M0 |
3 |
5 |
10,4 |
|
T3N0M0 |
2 |
|||
|
IIIA |
T1N2M0 |
1 |
38 |
79,2 |
|
T2N2M0 |
22 |
|||
|
T3N1M0 |
1 |
|||
|
T3N2M0 |
12 |
|||
|
T4N0M0 |
1 |
|||
|
T4N1M0 |
1 |
|||
|
IIIB |
T4N2M0 |
4 |
4 |
8,3 |
|
IV |
T2N1M1b |
1 |
1 |
2,1 |
Всего проанализировано 48 пациентов.
Для оценки распространенности опухолевого процесса и N–статуса всем пациентам выполнялось КТ ОКГ, 22 (46%) больным проведено ПЭТ - КТ, в трех случаях подтверждение наличия метастазов в лимфоузлах группы N2 было получено гистологически.
В ходе диагностики картина верификации первичной опухоли выглядела так: плоскоклеточный рак – 32 (66,7%), аденокарцинома – 10 (20,1%), другие опухоли – 6 (13,2%).
В таблице 2 представлены схемы химиотерапии, которые использовались в рамках неоадъювантного лечения.
Таблица 2
Схемы неоадъювантной химиотерапии
|
Схема лечения |
Выполнено пациентам |
% от числа пациентов |
|
Карбоплатин + Паклитаксел |
21 |
43,7 |
|
Карбоплатин + Этопозид |
9 |
18,7 |
|
Цисплатин + Этопозид |
5 |
10,4 |
|
Гемцитабин + Цисплатин |
5 |
10,4 |
|
Винорелбин + Карбоплатин |
2 |
4,2 |
|
Доцетаксел + Цисплатин |
2 |
4,2 |
|
Гемцитабин + Карбоплатин |
2 |
4,2 |
|
Пеметрексед + Карбоплатин |
1 |
2,1 |
|
Пеметрексед |
1 |
2,1 |
|
Итого |
48 |
100 |
Для оценки эффективности предоперационной химиотерапии были использованы критерии RECIST: выделяются таргетные и нетаргетные очаги. Таргетные очаги: опухолевые очаги до 5 мм в теле пациента (до двух в органе), не менее 10 мм в диаметре, лимфатические узлы, измеряемые по короткой оси (КО) и не менее 15 мм в диаметре. Нетаргетные очаги: все остальные. Методика оценки эффективности химиотерапии представлена в таблице 3. Для оперативного лечения пациентов критериями отбора было: положительная динамика процесса в виде регресса или стабилизации опухоли и/или лимфаденопатии, что подтверждали КТ, ПЭТ-КТ, а также с помощью фибробронхоскопии.
Таблица 3
Критерии RECIST
|
Общий ответ |
Таргетные очаги |
Нетаргетные очаги |
Новые очаги |
|
Полный ответ |
Полный ответ |
Полный ответ |
Нет |
|
Частичный ответ |
Полный ответ |
Частичный ответ/стабилизация заболевания |
Нет |
|
Частичный ответ |
Частичный ответ |
Непрогрессирование заболевания |
Нет |
|
Стабилизация заболевания |
Стабилизация заболевания |
Непрогрессирование заболевания |
Нет |
|
Прогрессирование заболевания |
Прогрессирование заболевания |
Любой ответ |
Есть или нет |
|
Прогрессирование заболевания |
Любой ответ |
Прогрессирование заболевания |
Есть или нет |
|
Прогрессирование заболевания |
Любой ответ |
Любой ответ |
Есть |
В случае прогрессирования заболевания, нерезектабельности процесса и недостаточных функциональных способностей пациента после химиотерапии в виде лейкопении, тромбоцитопении, анемии тяжелых степеней хирургическое лечение не проводилось. Так, стабилизацию процесса авторы наблюдали в 26 (54,2%) случаях, частичный регресс опухоли в 21 (43,8%), полный регресс опухоли выявили у 7 пациентов (14,6%), что соответствует ответу на предоперационную химиотерапию согласно литературным данным [4; 5].
После ретроспективного анализа распределение операций по объему выглядит следующим образом (табл. 4).
Таблица 4
Виды проведенного хирургического лечения
|
Вид операции |
Выполнено операций |
% от всех операций |
|
Пневмонэктомия / R0 |
16 |
33,4 |
|
Билобэктомия/ R0 |
5 |
10,4 |
|
Лобэктомии всего/ R0 |
20 |
41,7 |
|
Эксплоративная торакотомия |
5 |
10,4 |
|
Сублобарная резекция (циторедукция) / R1 |
2 |
4,1 |
Всем пациентам выполнена билатеральная медиастинальная лимфаденэктомия.
Более 70% пациентов имели клинически значимую сопутствующую патологию. Так, более половины из всех пациентов страдали хронической обструктивной болезнью легких (ХОБЛ), 19 (40%) имели заболевания сердечно-сосудистой системы, из них 2 (4,2%) имели в анамнезе перенесенное аортокоронарное шунтирование, 1 (1,63%) перенес в прошлом стентирование коронарных артерий, у 3 (6,3%) пациентов в анамнезе острое нарушение мозгового кровообращения.
Результаты исследования и их обсуждение
Приведены результаты ранней послеоперационной летальности: три пациента умерло, что составило 4,4% от совокупности выборки, двое из них в результате декомпенсации деятельности сердечно-сосудистой системы, один в результате массивной тромбоэмболии легочной артерии на фоне нарушения сердечного ритма.
Таблица 5
Распределение хирургических осложнений в раннем послеоперационном периоде
|
Вид осложнения |
Кол-во осложнений |
% от числа пациентов |
|
|
Отграниченная остаточная полость |
3 |
6,3 |
|
|
Эмфизема |
2 |
4,2 |
|
|
Гиперэкссудация |
2 |
4,2 |
|
|
Хилоторакс |
1 |
2,1 |
|
|
Бронхоплевральный свищ |
2 |
4,2 |
|
|
Тромбоз анастомоза ЛА, инфаркт – пневмония |
1 |
2,1 |
|
|
Массивная ТЭЛА |
1 |
2,1 |
|
|
Интраоперационная асистолия |
1 |
2,1 |
|
Подкожная эмфизема у обоих пациентов сопровождалась длительным сбросом воздуха по дренажам и купировалась консервативно. Гиперэкссудация из плевральной полости купирована с помощью плевральных дренажей, поставленных интраоперационно. Кровопотеря в обоих случаях была умеренной и не сопровождалась выраженной анемией: в первом случае кровопотеря составила 100 мл, гемоглобин на 1 сутки после операции 120 г/л, содержание эритроцитов 4.5*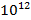 /л, во втором случае 150 мл, гемоглобин на 1 сутки 115 г/л, содержание эритроцитов 4.8*
/л, во втором случае 150 мл, гемоглобин на 1 сутки 115 г/л, содержание эритроцитов 4.8*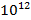 /л. Реторакотомия потребовалась двум пациентам, в одном случае произведена заключительная пневмонэктомия (нижняя лобэктомия по типу пневмонэктомии) на фоне тромбоза легочной артерии ниже сосудистого соустья после бронхоангипластической верхней лобэктомии слева по поводу центрального рака левого верхнедолевого бронха. Второй пациентке реторакотомия потребовалась из-за состоявшегося внутриплеврального кровотечения. Выполнено повторное дренирование в послеоперационном периоде пяти пациентам. Данный процент осложнений зафиксирован и у других авторов и является статистически сопоставимым с частотой осложнений с использованием лишь одного хирургического вмешательства [4; 9; 10]. Среднее количество койко-дней с момента поступления до выписки составило 18.
/л. Реторакотомия потребовалась двум пациентам, в одном случае произведена заключительная пневмонэктомия (нижняя лобэктомия по типу пневмонэктомии) на фоне тромбоза легочной артерии ниже сосудистого соустья после бронхоангипластической верхней лобэктомии слева по поводу центрального рака левого верхнедолевого бронха. Второй пациентке реторакотомия потребовалась из-за состоявшегося внутриплеврального кровотечения. Выполнено повторное дренирование в послеоперационном периоде пяти пациентам. Данный процент осложнений зафиксирован и у других авторов и является статистически сопоставимым с частотой осложнений с использованием лишь одного хирургического вмешательства [4; 9; 10]. Среднее количество койко-дней с момента поступления до выписки составило 18.
Патологоанатомическое исследование послеоперационного материала показало наличие терапевтического патоморфоза (ТПМ) у 23 пациентов (53,5%) от I до IV степени. ТПМ I степени выявлен у 8 пациентов (16,6%), II степени – у 6 (12,5%), III степени – у 3 (6,3%), IV степени - у 7 (14,5%). При исследовании удаленных лимфоузлов у 33 прооперированных N–2 позитивных пациентов (76,7%) наличие метастазов опухоли выявлено лишь в 18 случаях (54,5%), в 3 случаях выявлен ТПМ (9%), у остальных 12 пациентов (36,3%) в удаленных лимфоузлах зафиксированы синусовый гистиоцитоз и воспалительная реакция.
В настоящий момент имеются следующие результаты проспективного наблюдения: у 8 (16,6%) пациентов отмечено прогрессирование заболевания, трое пациентов не явились на плановый осмотр, многие пациенты на данный момент получают адъювантное лечение.
В своей работе авторы руководствуются Клиническими рекомендациями АОР, согласно последней редакции которых N–стадирование возможно путем морфологической верификации (эндобронхосонография (EBUS), медиастиноскопия, видеоторакоскопия) и/или с помощью ПЭТ – КТ [6]. Однако, по литературным данным, ряд авторов отмечает высокую чувствительность, но относительно небольшую специфичность этого метода исследования в сравнении с медиастиноскопией, видеоторакоскопией [11]. Также Kaseda K. (2016) указывает на центральное расположение опухоли легкого как на фактор риска ложноположительного результата в определении N-статуса с помощью ПЭТ.
По данным авторов, из 17 пациентов, N2-позитивных на ПЭТ – КТ, метастазы в лимфоузлах выявлены лишь у 11 (64,7%), соответственно у 6 пациентов (35,3%) результат оказался ложнопозитивным. Все пациенты с ложнопозитивным N–статусом, определенным на ПЭТ – КТ, страдали центральным плоскоклеточным раком, осложненным в разной степени выраженным воспалительным процессом в легочной ткани, обусловленным обтурационным пневмонитом. Гипердиагностика в определении метастазирования опухоли в медиастинальные лимфоузлы таит в себе несколько, на взгляд авторов, негативных последствий. Одним из наиболее важных авторы считают переход пациента из операбельной стадии заболевания в неоперабельную. В первую очередь это относится к больным НМРЛ с образованием «T3», т.к. если в 7-й редакции TNM классификации рака легкого при N2-позитивном статусе пациент относился к IIIA стадии заболевания и тактикой лечения было хирургическое после проведения неоадъювантной химиотерапии, то в соответствии с 8-м пересмотром стадия определяется как IIIB, которая предполагает консервативную терапию без операции [6].
Вторым не менее важным моментом является «напрасное» проведение предоперационной химио- либо химиолучевой терапии при опухоли «T1-Т2». В данном случае ошибочная тактика лечения может привести не только к настороженности ряда хирургов к проведению операции после химиотерапии, в связи с мнением, что неоадъювантная химиотерапия ухудшает послеоперационное течение пациентов, увеличивает послеоперационную летальность [4], но и к увеличению сроков начала показанного для данной стадии хирургического лечения с риском прогрессирования заболевания при неадекватном ответе опухоли на химиопрепараты.
Также необходимо учесть и побочное действие ряда химиопрепаратов, которое по ряду причин может усугубить функциональное состояние пациента, отсрочив либо полностью лишив больного возможности хирургического, показанного на данной стадии заболевания, лечения. Идеальным вариантом было бы проведение EBUS всем пациентам с рентгенологически подтвержденной лимфаденопатией внутригрудных лимфоузлов (ВГЛУ) при НМРЛ. Но необходимость госпитализации пациента в стационар, относительная дороговизна процедуры, занятость эндоскопического кабинета и другие аспекты не позволяют на сегодняшний день отнести данный вид исследования к рутинной практике.
Выводы
1. В определении N–статуса пациентов с НМРЛ, имеющих воспалительные процессы в легочной ткани, необходима гистологическая (либо цитологическая) верификация медиастинальных лимфоузлов под навигацией с использованием EBUS, EUS, а также может потребоваться медиастиноскопия/видеоторакоскопия
2. Согласно полученным данным, неоадъювантное лечение не увеличивает частоту хирургических осложнений, а также не усугубляет послеоперационный период.
Библиографическая ссылка
Руденко М.С., Мотус И.Я., Салоутин М.В., Елисеева А.П., Русинов В.В., Александров М.А., Каменев Р.О. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ КАК ЭТАП КОМБИНИРОВАННОЙ ТЕРАПИИ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО (НМРЛ) // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30752 (дата обращения: 28.01.2026).
DOI: https://doi.org/10.17513/spno.30752



