Микроокружение опухолевых клеток интересует исследователей на протяжении последних десятилетий, изучение касается: тучных клеток [1–3]; макрофагов [4–6]; ангиогенеза [7, 8] и др.
В мировой литературе прогностическому значению B-лимфоцитов в перитуморозной зоне (ПЗ) злокачественных новообразований посвящены единичные исследования. Короткое выживание пациентов после оперативного лечения было ассоциировано с увеличением числа перитуморозных CD20+ B-лимфоцитов при саркомах мягких тканей. При проведении многофакторного анализа высокое содержание CD20+ лимфоцитов в ПЗ сарком мягких тканей явилось независимым фактором неблагоприятного прогноза [9].
Для распространенного плоскоклеточного рака легкого с метастазами было характерно возрастание числа CD20+ лимфоцитов в ПЗ опухоли [10].
По данным М.А. Сенчуковой и соавт. (2015), ранние стадии рака желудка характеризовала невысокая очаговая плотность распределения CD20+ В-лимфоцитов в ПЗ, которая не была связана с отдаленными результатами оперативного лечения, а наличие в ПЗ выраженных инфильтратов с множественными лимфоидными фолликулами из CD20+ клеток ассоциировалось с диффузным типом рака желудка и плохим прогнозом [11]. Инфильтрация ПЗ B-лимфоцитами была взаимосвязана с распространенностью и размером опухолей. Так, О.Н. Томчук (2016) показала, что при раке желудка выраженные CD20+ В-лимфоцитарные инфильтраты отмечали в ПЗ крупных карцином (>5 см) и при множественных метастазах [12].
При раке молочной железы высокой степени злокачественности численность CD20+ B-лимфоцитов в ПЗ увеличивалась, при этом отмечали тенденцию к образованию фолликулоподобных структур без герминативных центров [13].
В ПЗ рака гортани плотность воспалительного инфильтрата была наибольшей в карциномах высокой степени злокачественности, при этом инфильтрат характеризовался большим количеством CD20+ B-лимфоцитов с наличием фолликулоподобных образований [14].
Таким образом, работы, где было изучено прогностическое значение количественного содержания B-лимфоцитов в ПЗ злокачественных новообразований, немногочисленны, а исследований, посвященных количественному анализу B-лимфоцитов в ПЗ почечно-клеточного рака (ПКР), в доступной литературе нами не обнаружено.
Целями исследования являлись проведение количественного анализа популяций B-лимфоцитов в ПЗ ПКР и выявление взаимосвязей с клинико-анатомическими факторами прогноза и 5-летней послеоперационной выживаемостью пациентов.
Материалы и методы исследования
Всего был изучен послеоперационный материал 53 больных ПКР. Мужчин было 28 (52,8%), женщин – 25 (47,2%). Возраст пациентов в среднем составил 56,7±1,2 года.
Классификацию ПКР осуществляли в соответствии с классификацией ВОЗ 2016 г. [15]. Светлоклеточный рак был в 28 (52,8%) случаях, папиллярный рак – в 10 (18,9%) случаях, хромофобный рак – в 10 (18,9%) случаях и неклассифицируемый рак – в 5 (9,4%) случаях.
Пациентов с Ι клинической стадией (T1N0M0) в исследовании было 30 (56,6%); со стадией ΙΙ (T2N0M0) – 6 (11,3%); со стадией ΙΙΙ (T1N1M0, T2N1M0, T3N0M0, T3N1M0) – 10 (18,9%) и с ΙV стадией (T4N0M0, T4N1M0, TлюбаяN2M1, TлюбаяNлюбаяM1) – 7 (13,2%).
Степень анаплазии по Фурману GI была в 21 опухоли (39,6%), GII – в 10 (18,9%) опухолях, GIII – в 11 (20,75%) опухолях и GIV – в 10 (20,75%) новообразованиях.
Опухолей без метастазов было 40 (75,5%), с метастазами – 13 (24,5%).
Размер новообразований в среднем составил 6,8±0,2 см.
Материал фиксировали в 10%-ном р-ре нейтрального формалина в течение 24 ч. B-лимфоциты выявляли иммуногистохимическим методом с помощью моноклональных мышиных антител к CD97α (клон HM47, Becton) по протоколу производителя. С помощью компьютерной морфометрической программы Image Tool. 3.0. при увеличении микроскопа х400 подсчитывали среднее количество B-лимфоцитов в 3 полях зрения в ПЗ карцином.
Статистическую обработку полученных данных проводили при помощи пакета Statistica 10.0. Если полученные цифровые данные имели нормальное распределение, то для оценки достоверности применяли t-test Стьюдента, а если данные не соответствовали нормальному распределению, то использовали U-тест Манна–Уитни или Колмогорова–Смирнова. Достоверными данные считали при р<0,05. Корреляционный анализ осуществляли расчетом коэффициента Пирсона.
Результаты исследования и их обсуждение
Результаты исследования позволили выявить, что без учета клинических и анатомических особенностей новообразований число B-лимфоцитов в ПЗ ПКР составило 55,7±6,9 в 3 полях зрения при большом увеличении микроскопа. Очаговая инфильтрация ПЗ В-лимфоцитами отмечалась в 47,2% случаев, диффузную инфильтрацию В-лимфоцитами выявляли в 13,2% случаев и диффузную инфильтрацию с образованием лимфоидных фолликулов определяли в 39,6% случаев.
При поиске корреляционных взаимосвязей выявлено, что с содержанием B-лимфоцитов в ПЗ были взаимосвязаны: стадия заболевания (r=0,62; p=0,0001); размер опухоли (r=0,58; p=0,0001); степень анаплазии по Фурману (r=0,64; p=0,0001); возникновение метастазов (r=0,30; p=0,03) и послеоперационная выживаемость пациентов (r=0,31; p=0,025). Не было обнаружено взаимосвязей с полом, возрастом больных и гистологическим вариантом опухолей (табл. 1).
Таблица 1
Корреляционные взаимосвязи содержания B-лимфоцитов в ПЗ с клинико-анатомическими особенностями карцином
|
Клинико-анатомический параметр |
Коэффициент корреляции (r) |
р |
|
Пол больных |
0,04 |
0,79 |
|
Возраст больных |
0,10 |
0,46 |
|
Гистологический вариант опухоли |
0,11 |
0,43 |
|
Стадия заболевания |
0,62 |
0,0001 |
|
Размер опухоли |
0,58 |
0,0001 |
|
Степень анаплазии опухоли по Фурману |
0,64 |
0,0001 |
|
Наличие метастазов |
0,30 |
0,03 |
|
Послеоперационная выживаемость больных |
0,31 |
0,025 |
Число B-лимфоцитов в ПЗ у мужчин было равно 60,4±8,3, у женщин – 50,9±11,2 (p=0,5) (табл. 2). У мужчин среднее число B-лимфоцитов в ПЗ составило 60,4±8,3, у женщин – 50,9±11,2 (p=0,5) (табл. 2). Очаговую инфильтрацию В-лимфоцитами в ПЗ у мужчин отмечали в 39,3% случаев, диффузную инфильтрацию – в 10,7% случаев, диффузную инфильтрацию с образованием лимфоидных фолликулов – в 50% случаев, а у женщин очаговую, диффузную и диффузную инфильтрацию с образованием лимфоидных фолликулов инфильтрацию отмечали в 56%, 16% и 28% случаев соответственно.
Возраст влиял на содержание В-лимфоцитов в ПЗ. Наибольшее содержание B-лимфоцитов в ПЗ отмечали в возрастной группе от 40 до 49 лет (73,7±17,5), а наименьшее – в возрасте от 30 до 39 лет (5,0±0,6) (табл. 2). При возрасте пациентов 30–39 лет в 100% случаев в ПЗ присутствовала очаговая инфильтрация B-лимфоцитами. При возрасте 40–49 лет очаговая инфильтрация В-лимфоцитами в ПЗ присутствовала в 50% случаев, диффузная инфильтрация – в 20% случаев и диффузная инфильтрация с образованием лимфоидных фолликулов – в 30% случаев.
На содержание B-лимфоцитов в ПЗ оказывал влияние гистологический тип опухоли. Наиболее высокое количество B-лимфоцитов в ПЗ было при неклассифицируемом раке (62,8±10,7), а наиболее низкое – при папиллярном раке – 5,6±0,6 (табл. 2). При неклассифицируемом раке в ПЗ в 100% случаев отмечали диффузную инфильтрацию с образованием лимфоидных фолликулов, а при папиллярном раке в 100% случаев присутствовала очаговая инфильтрация.
При ранних стадиях (I–ΙΙ стадия заболевания) количество B-лимфоцитов в ПЗ равнялось 15,05±1,08 (табл. 2). Очаговую инфильтрацию В-лимфоцитами в ПЗ при ранних стадиях отмечали в 69,4% случаев, диффузную инфильтрацию – в 8,4% случаев и диффузную инфильтрацию с образованием лимфоидных фолликулов – в 22,2% случаев. При IIΙ–ΙV стадии содержание B-лимфоцитов в ПЗ возрастало в 8,5 раза и составило 128,6±14,8 (табл. 2). При этом диффузная инфильтрация возрастала в 2,8 раза (до 23,5%), диффузная инфильтрация с образованием лимфоидных фолликулов – в 3,45 раза (до 76,5%), а очаговая инфильтрация отсутствовала.
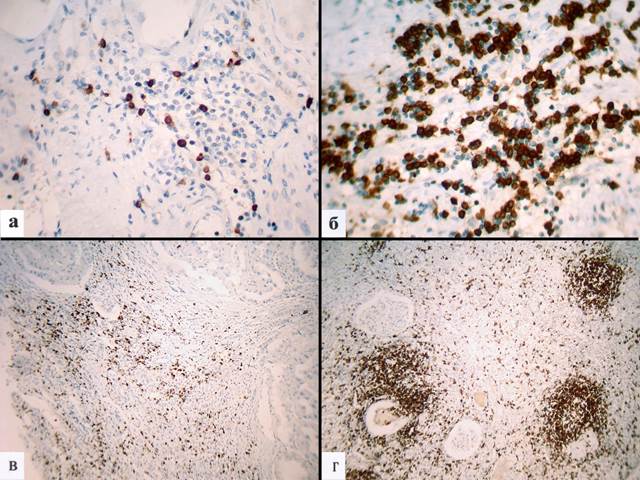
Рис. 1. Экспрессия B-лимфоцитов в ПЗ ПКР: а – небольшое количество B-лимфоцитов в ПЗ при I степени анаплазии по Фурману, ув. х400; б – большое количество B-лимфоцитов в ПЗ при IV степени анаплазии по Фурману, ув. х400; в – диффузная инфильтрация ПЗ В-лимфоцитами при большом размере опухолевого узла, ув. х100; г – диффузная инфильтрация В-лимфоцитами с образованием лимфоидных фолликулов в ПЗ местнораспространенных карцином, ув. х100. Иммуногистохимическая окраска на CD97α
При степени анаплазии карцином по Фурману GI–GΙΙ содержание B-лимфоцитов в ПЗ составило 14,1±1,7, а при GIIΙ–GΙV оно было больше в 8,6 раза (табл. 2) (рис. 1а, 1б). Очаговую инфильтрацию B-лимфоцитами ПЗ карцином степени анаплазии GI–GΙΙ наблюдали в 75% случаев, диффузную – в 9,4% случаев и диффузную инфильтрацию с образованием лимфоидных фолликулов – в 15,6% случаев. Очаговая инфильтрация B-лимфоцитами в ПЗ при GIIΙ–GΙV степени анаплазии уменьшалась в 15,6 раза (4,8%), диффузная инфильтрация возрастала в 2,8 раза (до 19%) и диффузная инфильтрация с образованием лимфоидных фолликулов снижалась в 4,9 раза (до 76,2%).
Таблица 2
Плотность распределения B-лимфоцитов в ПЗ в зависимости от клинико-анатомических особенностей ПКР
|
Клинико-анатомический параметр |
Количество B-лимфоцитов в ПЗ |
р |
|
Пол: мужской женский |
60,4±8,3 50,9±11,2 |
p=0,5 |
|
Возраст: 30–39 лет (1) 40–49 лет (2) 50–59 лет (3) 60–69 лет (4) 70–79 лет (5) |
5,0±0,6 73,7±17,5 58,3±9,6 50,2±14,8 38,3±11,2 |
P1-4=0,05
|
|
Гистологический вариант карцином: папиллярный (1) хромофобный (2) светлоклеточный (3) неклассифицируемый (4) |
5,6±0,6 40,2±17,7 60,2±8,1 62,8±10,7 |
P1-4=0,00002
|
|
Стадия TNM: І–ΙΙ ІІΙ–ΙV |
15,05±1,8 128,6±14,8 |
p=0,0000001 |
|
Степень анаплазии по Фурману: GІ–ΙΙ GІІΙ–ΙV |
14,1±1,7 122,4±14,5 |
p=0,0000001 |
|
Размер опухоли: <7,0 см ≥7,0 см |
14,7±1,9 113,6±13,6 |
p=0,0000001 |
|
Распространенность опухолевого процесса: N0 N+ |
42,1±7,9 97,7±12,2 |
p=0,00045 |
Когда размер опухоли был <7,0 см, число B-лимфоцитов в ПЗ составило 14,7±1,9, а при размере ≥7,0 см оно достоверно возрастало в 7,7 раза (табл. 2, рис. 1в). Очаговую инфильтрацию В-лимфоцитами в ПЗ при размере опухолевого узла <7,0 см отмечали в 71% случаев, диффузную инфильтрацию – в 6,4% случаев и диффузную инфильтрацию с образованием лимфоидных фолликулов – в 22,6% случаев. Если размер опухоли был >7,0 см, диффузная инфильтрация ПЗ В-лимфоцитами возрастала в 3,5 раза (до 22,7%), диффузная инфильтрация с образованием лимфоидных фолликулов возрастала в 2,8 раза (до 63,6%), а очаговая инфильтрация уменьшалась в 5,2 раза (13,6%).
У пациентов с локализованными опухолями количество B-лимфоцитов в ПЗ составило 42,1±7,9, а в ПЗ карцином с метастазами оно достоверно увеличивалось в 2,3 раза (табл. 2, рис. 1г). Очаговую инфильтрацию ПЗ B-лимфоцитами локализованных карцином наблюдали в 62,5% случаев, диффузную – в 5% случаев и диффузную инфильтрацию с образованием лимфоидных фолликулов – в 32,5% случаев. В ПЗ местнораспространенных карцином диффузная инфильтрация B-лимфоцитами возрастала в 7,7 раза (38,5%), диффузная инфильтрация с образованием лимфоидных фолликулов возрастала в 1,9 раза (до 61,5%), очаговая инфильтрация отсутствовала.
При проведении анализа 5-летней послеоперационной выживаемости больных по Каплану–Майеру обнаружено, что если число B-лимфоцитов в ПЗ было <56, то через 5 лет доля выживших была равна 0,84 (84%), а если содержание B-лимфоцитов в ПЗ было ≥56, то доля выживших снижалась до 0,54 (54%). Применение log-rank-критерия показало, что различия между кривыми выживания были достоверны (p=0,03) (рис. 2).
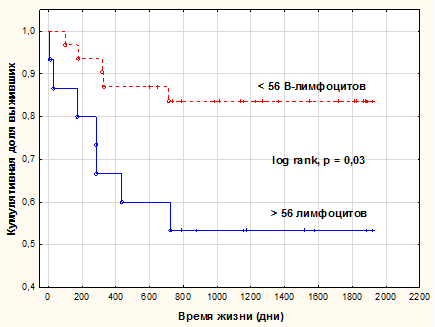
Рис. 2. Доля выживших пациентов через 5 лет наблюдения в зависимости от плотности распределения B-лимфоцитов в ПЗ карцином
Заключение
Таким образом, результаты исследования позволяют заключить, что количество B-лимфоцитов в ПЗ зависело от клинико-анатомических характеристик карцином. Число B-лимфоцитов в ПЗ увеличивалось при III–IV стадиях заболевания, GIII–IV степенях анаплазии по Фурману, в неклассифицируемом раке, при увеличении размера опухоли и возникновении метастазов. Количественную оценку содержания B-лимфоцитов в ПЗ можно использовать в качестве дополнительного прогностического фактора при почечно-клеточном раке.
Библиографическая ссылка
Бобров И.П., Черданцева Т.М., Долгатова Е.С., Долгатов А.Ю., Лепилов А.В., Лушникова Е.Л., Бакарев М.А. ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ В-ЛИМФОЦИТОВ В ПЕРИТУМОРОЗНОЙ ЗОНЕ РАКА ПОЧКИ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30739 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30739



