За последние десятилетия онкологическая служба шагнула далеко вперед, мы стали свидетелями беспрецедентных изменений и значительных достижений в лечении злокачественных опухолей как среди взрослого населения, так и среди детей и подростков. Это связано с ранней диагностикой, усовершенствованием оборудования для проведения инструментальных методов исследования, открытием маркеров, отражающих развитие опухолевого процесса, в связи с чем общая выживаемость детей с онкологической патологией значительно повысилась. Однако, несмотря на этот прогресс, онкологические заболевания остаются основной причиной смерти в детском и подростковом возрасте.
Группа эмбриональных опухолей занимает ведущую позицию в структуре солидных опухолей детского возраста. Особый интерес представляют эмбриональные опухоли, такие как нейробластома, нефробластома и рабдомиосаркома, ввиду частоты их встречаемости в детском и подростковом возрасте [1].
Нейробластома – наиболее часто встречающаяся экстракраниальная опухоль у детей, которая представляет собой новообразование, развивающееся из зачатков нервного гребня во время закладки симпатической нервной системы [2]. Манифестирует данное заболевание в возрасте до 5 лет, также оно может встречаться и в более раннем возрасте, с этим связана особенность данного опухолевого процесса, а именно способность опухоли в раннем детском возрасте к самостоятельному регрессу. Заболевание является гетерогенным и способно поражать любую часть тела, но наиболее частой локализацией являются забрюшинное пространство, преимущественно надпочечники, и средостение. Также стоит отметить, что данный вид опухоли подразделяется на недифференцированную, низкодифференцированную и высокодифференцированную нейробластомы. Ответ на лечение зависит не только от типа опухолевого процесса, его локализации, пола и возраста ребенка, стадии опухолевого процесса, но также и от наличия или отсутствия генетических мутаций. Одним из наиболее важных биологических маркеров данной опухоли является MYCN.Этот онкоген сверхэкспрессируется почти у 25% пациентов с верифицированной нейробластомой. В свою очередь, у пациентов с «положительным» геном MYCN отмечаются быстрое прогрессирование опухолевого процесса и неблагоприятные исходы лечения[3].
Характеристики нефробластомы во многом схожи с таковыми при нейробластоме, однако данный тип опухолевого процесса отличается своим благоприятным течением и выраженным ответом на комплексное лечение. Причина развития нейробластомы, или опухоли Вильмса, до конца неизвестна, однако считается, что одной из причин возникновения являются генетические изменения, происходящие на этапе развития мочеполовой системы. Также установлено, что нефробластома развивается из стойкой метанефрической ткани или нефрогенных остатков. Данный вид опухолевого процесса манифестирует в раннем возрасте, пик заболеваемости приходится на возраст 3–4 года, при этом опухолевое поражение почек может иметь как односторонний характер поражения, так и двусторонний, но последний встречается крайне редко. Существует ряд опухолевых маркеров, которые связаны с развитием нефробластомы: WT1, CTNNB1 и WTX [4].
Еще одним представителем среди часто встречающихся эмбриональных опухолей является рабдомиосаркома. она занимает лидирующую позицию среди сарком мягких тканей в детском возрасте. На ее долю приходится около 4,5% всех случаев злокачественных опухолей среди детей и подростков. Клетки рабдомиосаркомы во многом схожи с клетками – предшественниками скелетных мышц. В клинической практике рабдомиосаркома подразделяется на эмбриональную (приблизительно 60%), альвеолярную (приблизительно 20%), плеоморфную (приблизительно 10%) и веретеновидную/склерозирующую (приблизительно 10%). В детской онкологической практике чаще всего встречаются эмбриональная и альвеолярная рабдомиосаркомы, последняя характеризуется агрессивным течением и способностью к раннему метастазированию и рецидивированию. Однако благодаря межпрофессиональным подходам в лечении данной патологии выживаемость пациентов с рабдомиосаркомой значительно повысилась [5].
За последние десятилетия были выявлены новые биомаркеры, несущие в себе прогностическую информацию для эффективного лечения рака. Одним из таких биомаркеров является Ki-67, в настоящее время он считается одним из перспективных маркеров в изучении и прогнозировании лечения [6]. Ki-67 представляет собой белок, который экспрессируется в ядре клеток во все фазы клеточного цикла, за исключением состояния покоя (G0). Данный белок является широко используемым антигеном пролиферации опухолевых клеток путем иммуногистохимического исследования (ИГХ), в 2015 г. он был предложен в качестве меры для количественной оценки пролиферации клеток в образцах рака молочной железы [7]. Высокие уровни экспрессии Ki-67 в ткани опухоли коррелируют с более стойкой пролиферацией и неблагоприятным прогнозом [8].
Ki-67 широко применяется для оценки эффективности лечения злокачественных опухолей у взрослого населения [9-11].
В 2003 г. был описан способ прогноза при остеосаркомах у детей с помощью исследования уровня моноклональных антител Ki-67 [12]. Авторами исследования было установлено, что индекс связывания вышеуказанных антител в среднем составил до 9,7% при саркомах костей, что статистически достоверно превышало аналогичный показатель при доброкачественных опухолях костей. Одновременно с этим было продемонстрировано, как экспрессия данного антигена коррелировала со степенью биологической активности опухоли и с клиническим течением заболевания. Однако в отношении предложенного способа прогноза отсутствовали соответствующие исследования, связанные с возможностью его использования для оценки течения злокачественности процесса у больных детей, что не позволяет применять его с подобной целью.
Однако подобных прогностических исследований среди опухолей детского возраста, в частности эмбриональных опухолей, предложено не было.
Цели исследования – исследование и анализ уровня пролиферативной активности Ki-67 в первичной опухолевой ткани у пациентов детского и подросткового возраста с эмбриональными опухолями (такими как нефробластома, нейробластома, рабдомиосаркома), а также в опухолевой ткани после проведенного химиотерапевтического лечения, оценка его в качестве прогностического фактора.
Материалы и методы исследования
Настоящее исследование было проведено на образцах опухолевой ткани до начала специального противоопухолевого лечения и после проведения первого этапа – неоадъювантного полихимиотерапевтического лечения. Все пациенты, включенные в исследование, проходили лечение в ФГБУ «НМИЦ онкологии» Минздрава России в отделении детской онкологии № 2 с января 2018 г. по декабрь 2019 г.
Отбор пациентов для участия в данном исследовании проводился методом сплошной выборки. Критерии включения: пациенты обоих полов; возраст пациентов от рождения до 18 лет; пациенты с верифицированным диагнозом «нефробластома», «нейробластома», «рабдомиосаркома»; пациенты, получившие предоперационное лечение (неоадъювантный курс ПХТ) и в последующем – оперативное лечение.
В настоящее исследования были включены 42 пациента, 16 из которых на этапе верификации процесса был выставлен диагноз «нейробластома», 20 пациентам – «нефробластома» и 6 – «рабдомиосаркома».
В возрасте до 1 года были 10 пациентов: все пациенты женского пола, у 2 пациенток – нейробластома, у 8 – нефробластома. В возрасте старше 1 года: 14 пациентов с диагнозом «нейробластома» (12 мальчика и 2 девочки), 12 пациентов с диагнозом «нефробластома» (6 девочек и 6 мальчиков), 6 – с рабдомиосаркомой (4 девочки, 2 мальчика).
Актуальное исследование было проведено на образцах опухолевой ткани, полученных на этапе верификации опухолевого процесса, а также на этапе оперативного лечения после проведения неоадъювантной полихимиотерапии, после получения согласия родителей/законных представителей. Под ингаляционно-масочной анестезией всем пациентам на этапе верификации была проведена трепанобиопсия опухолевого узла специализированными одноразовыми полуавтоматическими биопсийными иглами фирмы «GTA medical devices» под ультразвуковым контролем УЗ системы Philips IU22 (USA), Logic 400 MD (GE, USA) конвексными датчиками (3,5–5,5 МГц), стандартно в режиме двухмерного изображения [13]. Перед проведением трепанобиопсии пациенты проходили предварительную компьютерную томографическую разметку на аппарате GE LightSpeed VCT XT (64-срезовый). Полученный материал был направлен на гистологическое и иммуногистохимическое исследования. После верификации процесса все пациенты получили специальное противоопухолевое лечение согласно утвержденным протоколам. Второй этап забора опухолевой ткани, как упоминалось ранее, был произведен в операционной, после удаления остаточной опухоли. Оценка исследования была проведена на основании полученных результатов иммуногистохимического исследования (количество позитивных к маркеру пролиферативной активности Ki-67 ядер опухолевых клеток в процентном соотношении). Обработка полученных результатов проводилась в программе Statistica 10.0 с использованием непараметрического критерия Вилкоксона–Манна–Уитни.
Результаты исследования и их обсуждение
При выполнении оценки уровня пролиферативной активности Ki-67 в опухолевой ткани нейробластомы (n=20) до начала специального лечения и в зависимости от распространенности опухолевого процесса было выявлено, что при распространенности опухолевого процесса Т3 уровень Ki-67 был выше на 32,6% (63,0%±6,1%), в отличие от уровня Ki-67 при Т2 (47,5%±4,6%), также было установлено повышение уровня Ki-67 в ткани опухоли у пациентов с метастатическим поражением лимфатических узлов (на 37%) и при отдаленном метастазировании (на 23,7%) (рис. 1). Достоверно установлено, что отмечалось снижение уровня пролиферативной активности Ki-67 в опухолевой ткани в зависимости от первоначального размера опухолевого узла после проведенного специального лечения: при Т2 он составлял 15,0%±1,3% (р=0,0217), а при Т3 составил 41,6%±4,01% (р=0,0013). Меньшее влияние на значение уровня экспрессии Ki-67 после проведенного лечения оказывало наличие метастатического поражения близлежащих лимфатических узлов, что составило при N0 34,1%±3,3% (р=0,0021), при N1 55,1%±5,31% (р=0,0019). Разнонаправленное значение имело изменение Ki-67 в остаточной опухолевой ткани при наличии отдаленного метастатического поражения, где его уровень составлял 82,5%±8,11% (р=0,0011), что на 20% выше, чем до начала специального лечения, когда при отсутствии метастатического поражения отмечено снижение уровня Ki-67 на 30% (19,1%±1,8% (р=0,0017)).
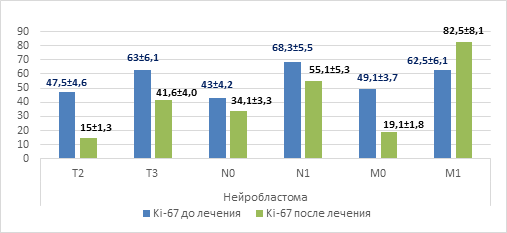
Рис. 1. Уровень Ki-67 в зависимости от распространенности опухолевого процесса при нейробластоме
При оценке ответа на противоопухолевое лечение было отмечено резкое снижение уровня пролиферации опухолевых клеток при регрессии заболевания на фоне проводимой терапии в 7,5 раза относительно уровня перед началом специального лечения – 45,1%±3,8% против 6,0%±0,51% (р=0,0000) (рис. 3). И, наоборот, при прогрессировании опухолевого процесса на фоне проводимой противоопухолевой терапии отмечалось повышение уровня пролиферации более чем на 20%, что составило 83,4%±7,4% против 63,3%±6,0% до начала специальной терапии. Таким образом, согласно полученным результатам можно сделать вывод о том, что уровень пролиферативной активности Ki-67 при нейробластоме может не только служить прогностическим фактором, отражающим размеры и распространенность опухолевого процесса, но и прогнозировать исход проводимой терапии.
При оценке уровня пролиферативной активности Ki-67 в ткани опухоли, представленной нефробластомой, до начала специального лечения и в зависимости от распространенности опухолевого процесса было выявлено следующее: при распространенности опухолевого процесса Т3 уровень составил 47,5%±4,1%, что ниже, чем уровень при Т2 (83,3%±7,9% (р=0,0003)), более чем на 40%, однако по сравнению с уровнем Т1 (41,7%±3,7%) уровень Т3 не имел достоверных отличий и был ниже уровня Т2 на >30%. В зависимости от наличия или отсутствия поражения лимфатических узлов, а также при наличии или отсутствии отдаленного метастатического поражения уровни Ki-67 не имели достоверных отличий. Однако при оценке изменений уровня пролиферации после проведенного противоопухолевого лечения отмечено, что уровень Ki-67 достоверно снижался независимо от размеров опухолевого узла, наличия или отсутствия поражения близлежащих к опухоли лимфатических узлов и отдаленных метастазов (рис. 2).
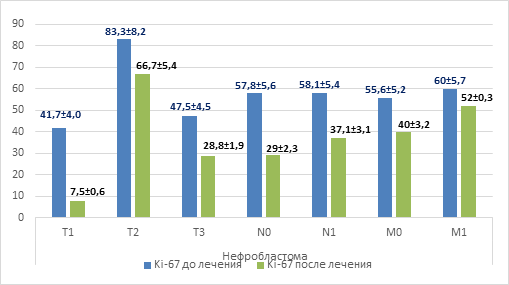
Рис. 2. Уровень Ki-67 в зависимости от распространенности опухолевого процесса при нефробластоме
При регрессии заболевания (n=16) на фоне проводимой полихимиотерапии отмечено снижение уровня Ki-67, что составило 18,8%±1,7% (р=0,0318) относительно уровня перед началом специального лечения (53,0%±5,0%) (рис. 3). И наоборот, при прогрессировании опухолевого процесса (n=2) на фоне проводимой противоопухолевой терапии отмечалось резкое повышение уровня пролиферации на 40%, что составило 90,0%±8,6% (р=0,0001) против 50,1%±4,8% до начала специальной терапии. При стабилизации опухолевого процесса (n=2) уровень пролиферации не имел достоверных изменений по отношению к значениям до проведенного противоопухолевого лечения. Подводя итог, можно достоверно сказать, что исследование уровня пролиферативной активности Ki-67 в ткани нефробластомы может служить информативным показателем, отражающим размер опухолевого узла и прогноз противоопухолевой терапии, но не может являться показателем, отражающим распространенность опухолевого процесса.
При изучении опухолевой ткани, полученной от пациентов с рабдомиосаркомой, нам, к сожалению, не удалось оценить влияния уровня Ki-67 на распространенность опухолевого процесса, так как все пациенты данной группы (n=6) имели одинаковую распространенность, но стоит отметить, что уровень пролиферативной активности у данной группы пациентов был высок и составил при Т2N0M0 65,1%±5,3%.
Но, несмотря на вышеописанное, нам удалось оценить изменение пролиферативной активности ткани Ki-67 после проведенного полихимиотерапевтического лечения. При исследовании ответа было выявлено, что при регрессе опухолевого процесса (n=5) уровень Ki-67 снизился практически на 50% и составил 23,3%±2,1% (р=0,0384), до лечения уровень составлял 70,0%±6,8%. При прогрессировании опухолевого процесса было отмечено повышение уровня пролиферации >30%, что достоверно составило 85,2%±8,31% (р=0,0004) относительно 50,1%±4,7% на этапе верификации до проведения специального лечения. Можно сделать вывод, что изменение уровня пролиферативной активности Ki-67 как прогностического фактора возможно только для оценки исхода проводимого лечения.
На рисунке 3 схематически отображено изменение уровня Ki-67 в зависимости от ответа на проведенную терапию, а также в зависимости от морфологической природы опухоли.
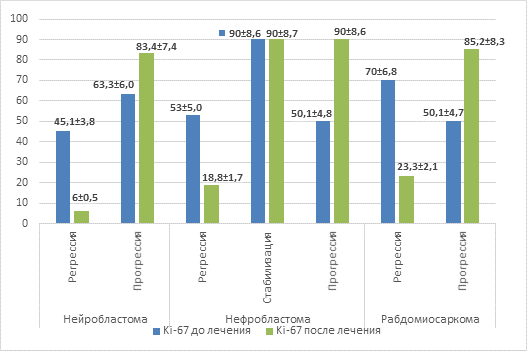
Рис. 3. Оценка уровня Ki-67 в зависимости от проведенного лечения при различных типах эмбриональных опухолей
Заключение
В результате проведенного ИГХ-исследования нами было установлено, что изменение уровня экспрессии Ki-67 при нейробластоме в ткани первичной опухоли соответствовало размерам опухолевого узла, а также стадии опухолевого процесса, при нефробластоме же он отражал лишь размер опухолевого узла. Достоверных данных об изменении размеров опухолевого узла и распространенности опухолевого процесса при рабдомиосаркоме получено не было. Однако при всех типах опухолевого процесса отмечалось достоверное изменение уровня пролиферативной активности Ki-67 в зависимости от ответа на противоопухолевое химиотерапевтическое лечение.
Таким образом, нами была подтверждена возможность применения в рутинном ИГХ-исследовании Ki-67 в качестве непосредственного маркера, характеризующего отдаленный прогноз опухолевого процесса.
Библиографическая ссылка
Поповян О.П., Франциянц Е.М., Кузнецов С.А., Беспалова А.И., Куштова Л.Б., Дмитриева В.В., Мкртчян Г.А., Старжецкая М.В., Димитриади С.Н., Пак Е.Е., Юрченко Д.Ю., Шашкина Л.Ю. KI-67 КАК МАРКЕР ОТВЕТА НА ЛЕЧЕНИЕ ЭМБРИОНАЛЬНЫХ ОПУХОЛЕЙ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30726 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30726



