Врожденные ложные суставы костей предплечья являются редкой костной патологией в детском возрасте. По данным литературных источников, с 1968 г. по 2018 г. всего было описано менее 100 случаев врожденного ложного сустава костей предплечья (ВЛСП). В большинстве случаев ВЛСП развивается у пациентов с нейрофиброматозом 1-го типа (NF1). ВЛСП может поражать локтевую и лучевую кости – как изолированно, так и совместно. По данным разных авторов, при отсутствии лечения ВЛСП у детей отмечается прогрессирование деформации костей предплечья ввиду наличия выраженного укорочения сегмента конечности. В результате у всех пациентов с данной патологией присутствует укорочение предплечья в сочетании с локтевой/лучевой девиацией кисти и функциональными ограничениями различной степени выраженности [1–3].
Консервативные методы лечения, такие как гипсовая иммобилизация или применение физиотерапии, редко приводили к консолидации фрагментов ложного сустава. В свою очередь, хирургический метод лечения является наиболее предпочтительным, однако в некоторых случаях может возникнуть необходимость проведения повторных оперативных вмешательств [1, 2]. Наиболее распространенными хирургическими методами лечения ВЛСП являются: пластика зоны ложного сустава фрагментом из малоберцовой кости с применением микрохирургического шва сосудов и пластика неваскуляризованным костным трансплантатом с последующим внутрикостным остеосинтезом. На сегодняшний день в литературе среди авторов нет единого мнения в отношении оптимального способа хирургического лечения ввиду редкости данного заболевания, что затрудняет проведение сравнительных исследований. При применении неваскуляризованной костной пластики аутотрансплантатом процент несращений составил 44–73% [3-5].
Материалы и методы исследования. В первой части публикации нами отражены результаты поиска научных статей, опубликованных в период с 2005 по 2020 гг. в научной базе Pubmed и Google Scholar. Словами для поиска служили «pseudarthrosis forearm», «fibular transfer», «microsurgical technique», «neurofibromatosis». Критериями включения являлись все статьи с результатами хирургического лечения ВЛСП у детей с нейрофиброматозом, которым была выполнена микрохирургическая аутотрансплантация фрагмента малоберцовой кости в позицию дефекта костей предплечья. Нашим критериям соответствовало всего 13 публикаций. Возраст пациентов в группах авторов на момент проведения оперативного вмешательства составлял в среднем от 4 до 9 лет.
Во второй части публикации нами представлен результат лечения пациента (девочка, 8 лет, нейрофиброматоз 1-го типа) с двусторонним поражением костей предплечья (локтевых костей), которой последовательно (с каждой стороны) была выполнена микрохирургическая аутотрансплантация малоберцовой кости. С целью оценки результатов нами были проведены такие обследования, как: ортопедический осмотр (определялись амплитуда движения в суставах, длина предплечий и ее укорочение, величина и вид девиации кисти (до и после вмешательств)), рентгенография костей обоих предплечий в двух проекциях с определением значений референтных углов костей, величины дефекта костей предплечья, наличия и видов имеющихся деформаций; рентгенография костей голеней с целью оценки состояния малоберцовой кости; дополнительно выполнялась компьютерная томография костей предплечья. С целью определения степени поражения нейромышечного аппарата пациентке была проведена электронейромиография верхних конечностей.
Результаты исследования и их обсуждение. По данным разных авторов, выполнение микрохирургической пластики зоны врожденного ложного сустава аутотрансплантатом из малоберцовой кости у детей с данной патологией приводит к сращению в 61–89% случаев [5–7]. При этом наибольший процент сращений отмечался у пациентов в возрасте 8–9 лет. Среднее время консолидации ложного сустава после проведенного лечения составило 5,5 месяца. Средний период наблюдения всех пациентов с ВЛСП, по данным авторов, составил 3,5 года [8–10].
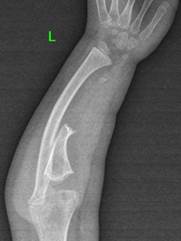
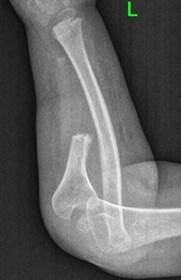
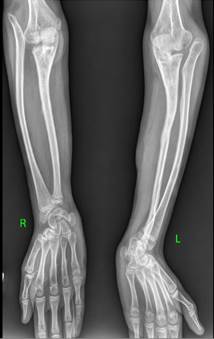
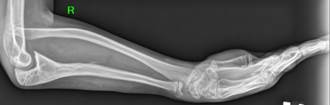
Нами представлен собственный клинический случай хирургического лечения двустороннего врожденного ложного сустава костей предплечий у пациентки с нейрофиброматозом. Из анамнеза известно, что в возрасте девочки 1 года 7 месяцев родители обратили внимание на деформацию левого предплечья. При объективном осмотре также отмечалось наличие на кожных покровах множества пятен кофейного цвета. После обследования у генетика пациенту был выставлен диагноз «нейрофиброматоз 1-го типа», в семье пациента родственники с данным заболеванием выявлены не были. При проведении рентгенологического исследования костей предплечья были выявлены ложные суставы обеих локтевых костей в сочетании с варусной деформацией костей предплечий до 20° и вывихами головок лучевых костей с двух сторон (рис. 1, 2). Хирургические вмешательства было принято отложить ввиду малого возраста ребенка.
В возрасте 2 лет 11 месяцев девочке в клинике института были выполнены открытое вправление головки левой лучевой кости с одномоментной корригирующей остеотомией левой локтевой кости, остеосинтез спицами. В послеоперационном периоде применялась иммобилизация задним гипсовым лонгетом, сроки достижения консолидации были без особенностей. В возрасте 3 лет 4 месяцев было выполнено повторное оперативное вмешательство на левом предплечье: резекция зоны ложного сустава левой локтевой кости, аутопластика области псевдоартроза трансплантатом из гребня подвздошной кости. Консолидации фрагментов, к сожалению, достичь не удалось.
Во время повторной госпитализации пациентки в возрасте 6 лет основными жалобами были: деформация костей обоих предплечий и ограничение самообслуживания ввиду функциональных ограничений. Рентгенологически отмечались выраженное укорочение и варусная деформация костей предплечий (больше правого), двусторонний вывих головок лучевых костей (рис. 1). Первоначально было выполнено хирургическое вмешательство на правом предплечье, состоящее из двух этапов: первым этапом было проведено наложение аппарата внешней фиксации (АВФ) на правое предплечье с последующей дистракцией для создания диастаза между костными фрагментами локтевой кости, вторым этапом – микрохирургическая пересадка фрагмента малоберцовой кости в позицию дефекта правой локтевой кости. Размер диастаза между костными фрагментами составил 5 см. Через 1 месяц после наложения АВФ была выполнена микрохирургическая пересадка фрагмента малоберцовой кости в позицию дефекта правой локтевой кости с микрохирургическим швом сосудов, а также создан межберцовый синостоз на правой голени (донорская зона). Через 7 месяцев после выполнения второго этапа вмешательства было достигнуто полное сращение зоны ложного сустава.
В возрасте 9 лет 5 месяцев ввиду того, что ранее отмечался лизис аутотрансплантата левой локтевой кости с формированием рецидива псевдоартроза, было принято решение о выполнении двухэтапной хирургической методики и на левом предплечье (рис. 1). Так же как и ранее, первым этапом было выполнено наложение АВФ с целью создания диастаза между костными фрагментами левой локтевой кости как подготовка ко второму этапу лечения – аутопластике дефекта локтевой кости трансплантатом из малоберцовой кости с применением микрохирургической техники. Методом дистракции создан диастаз между фрагментами локтевой кости, низведена головка лучевой кости. Размер диастаза между костными фрагментами составил 8,0 см. Через 2 месяца после первого этапа выполнена аутопластика дефекта локтевой кости трансплантатом из малоберцовой кости с применением микрохирургической техники. Достигнута консолидация фрагмента левой локтевой кости, устранен вывих головки лучевой кости.
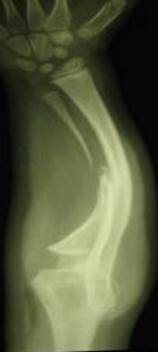
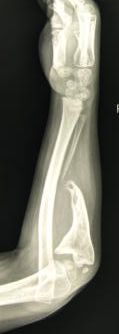
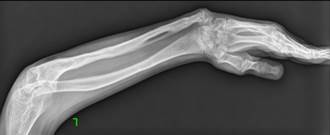
По результатам проведенного поочередного двухэтапного хирургического лечения достигнуто полное сращение ложных суставов локтевых костей с двух сторон, среднее время консолидации составило 8 месяцев. Период наблюдения данной пациентки после операции составил 4 года. При выполнении контрольных рентгенограмм предплечий в отдаленном периоде наблюдения отмечались незначительная варусная деформация локтевых костей (5–10º) и двусторонние вывихи головок лучевых костей. Несмотря на это, у пациентки отсутствовали функциональные ограничения: ограничение амплитуды ротационных движений, движений в лучезапястных суставах (тыльное ладонное сгибание), затруднение самообслуживания (рис. 2).
Со стороны донорской зоны в отдаленном периоде наблюдения у нашей пациентки отсутствовала вальгусная деформация на уровне голеностопного сустава ввиду того, что был создан межберцовый синостоз.
Осложнением является невропатия правого лучевого нерва, появившаяся после первого этапа хирургического лечения – наложения аппарата внешней фиксации. Данное осложнение в последующем было успешно устранено после проведения неврологической терапии с последующим проведением контрольной ЭНМГ.
|
|
|
|
Рис. 1. Рентгенограммы костей обоих предплечий в двух проекциях до этапа выполнения микрохирургической аутотрансплантации фрагмента малоберцовой кости в позицию дефекта локтевой кости
|
|
|
|
|
|
Рис. 2. Рентгенограммы костей обоих предплечий в двух проекциях через 2 года (слева) и 5 лет (справа) после проведения микрохирургической аутотрансплантации фрагмента малоберцовой кости в позицию дефекта обеих локтевых костей |
|
Дискуссия. Хирургическое лечение врожденных ложных суставов костей предплечья представлено в виде двух основных методов: простая костная аутопластика и микрохирургическая аутотрансплантация фрагмента малоберцовой кости в позицию псевдоартроза. Последний метод был впервые описан для этого указания в 1981 г. Allieu и иными, и к настоящему времени он является наиболее распространенным [11, 12].
Bauer и иные сообщили о 5 случаях врожденного ложного сустава предплечья с успешным сращением после микрохирургической аутопластики фрагментом из малоберцовой кости [13, 14].
Soucacos и иные опубликовали опыт успешного сращения врожденного ложного сустава предплечья у 4 пациентов, которым была выполнена микрохирургическая аутопластика фрагментом из малоберцовой кости. Средний возраст пациентов составил 10 лет (3–16 лет). Авторы отмечают, что хирургическое лечение необходимо проводить как можно раньше у растущих детей до прогрессирования деформации костей предплечья и, как следствие, появления вывиха головки лучевой кости [11, 14, 15].
По данным статистического анализа Solla и иных выявлено, что выбор метода лечения непосредственно влияет на частоту сращения фрагментов кости; применение микрохирургической аутотрансплантации фрагмента малоберцовой кости обеспечивает сращение ложного сустава более чем в 80% случаев; это больше, чем при обычной костной аутопластике. При этом доля пациентов, у которых уже после первой процедуры произошла консолидация фрагментов костей предплечья, была выше при микрохирургической аутотрансплантации фрагмента малоберцовой кости. По мнению авторов, широкая резекция участков пораженной кости (на концах фрагментов) и стабильная фиксация являются ключом к успешному результату. Но, по данным этого автора, возраст пациентов с ВЛСП не имеет корреляционной связи с частотой сращения ложного сустава (p=0,7). Однако присутствует слабая корреляционная связь между полом (мужским) и частотой сращений (p=0,2) [4, 16, 17].
Ding и иные в представлении своего клинического случая отмечали, что после проведения простой костной аутопластики у пациента 7 лет произошел лизис трансплантата, что потребовало в последующем проведения микрохирургической аутопластики для достижения сращения [3, 18, 19].
Такой же результат лечения был достигнут и у нашего пациента. Только выполнение микрохирургической аутотрансплантации фрагмента малоберцовой кости позволило добиться консолидации фрагментов локтевых костей [20, 21, 22].
Boyd и иные сообщают о значительной связи между несращением и возрастом, в котором проводится оперативное лечение. Несмотря на это, в 86% случаев у пациентов в возрасте старше 5 лет было достигнуто сращение [12, 23].
В 14% случаев сращение достигнуто у пациентов младше 5 лет. По мнению авторов, у более молодых пациентов чаще происходит резорбция костных аутотрансплантатов ввиду плохой фиксации и тонких остеопоротических фрагментов [24, 25].
Заключение. По данным разных авторов, при отсутствии лечения ВЛСП способствует прогрессированию деформации костей предплечья из-за их разницы в длине. В итоге результатом будет укорочение предплечья в сочетании с локтевой/лучевой девиацией кисти и различными функциональными ограничениями. Поэтому большинство авторов рекомендуют проводить хирургическое лечение как можно раньше, до начала прогрессирования деформации костей предплечья и, как следствие, появления вывиха головки лучевой кости. Однако применение микрохирургической аутопластики фрагментом малоберцовой кости обеспечивает больший процент сращений врожденного ложного сустава (более 80% случаев) у детей 9 лет и старше ввиду того, что в данном возрасте имеет место более выраженная толщина костных фрагментов, что важно для успешного выполнения остеосинтеза, а соответственно, и для более плотного контакта между костными фрагментами. При применении микрохирургической аутопластики фрагментом малоберцовой кости отмечается более высокая частота сращения врожденных ложных суставов костей предплечья у детей с нейрофиброматозом. Применение данного метода позволяет повысить эффективность лечения данной патологии и снизить частоту осложнений и неблагоприятных исходов.
Библиографическая ссылка
Сосненко О.Н., Белоусова Е.А., Поздеев А.П., Захарьян Е.А., Долгиев Б.Х., Чигвария Н.Г., Зубаиров Т.Ф., Поздеев А.А., Гаркавенко Ю.Е. ПРИМЕНЕНИЕ МИКРОХИРУРГИЧЕСКОЙТЕХНИКИ ПРИ ЛЕЧЕНИИ ВРОЖДЕННОГО ЛОЖНОГО СУСТАВА КОСТЕЙ ПРЕДПЛЕЧЬЯ У ДЕТЕЙ С НЕЙРОФИБРОМАТОЗОМ (НАБЛЮДЕНИЕ ИЗ ПРАКТИКИ) // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30722 (дата обращения: 23.02.2026).
DOI: https://doi.org/10.17513/spno.30722