Для лечения пациентов с церебральными аневризмами в остром периоде кровоизлияния одним из успешных методов является их внутрисосудистая окклюзия отделяемыми спиралями. Методика зарекомендовала себя меньшей травматичностью и большей безопасностью оперативного вмешательства, что особенно актуально для коморбидных пациентов, а также для больных, находящихся в тяжелом состоянии [1]. Несмотря на то что данные международного клинического исследования по лечению аневризм в остром периоде кровоизлияния (ISAT) первоначально показали клиническое преимущество внутрисосудистой методики при разрыве аневризмы, нестабильность комплекса спиралей, приводящая к восстановлению кровотока в аневризме и, как следствие, в ряде случаев требующая повторного вмешательства, является основным недостатком эндоваскулярного лечения [2; 3].
Наиболее часто кровоизлияние происходит из аневризм, расположенных на передней соединительной артерии, что может характеризовать их как одну из наиболее частых локализаций при внутрисосудистом лечении в остром периоде [4]. Chang Ki Jang с соавт. (2020) сообщили, что частота рецидивирования аневризм передней соединительной артерии после их окклюзии спиралями, в том числе с использованием стент-ассистенции, может достигать 14,6%, а необходимость в повторном вмешательстве - 3,8% [5].
Основной задачей лечения как первичных, так и рецидивных интракраниальных аневризм, на наш взгляд, является реконструкция несущего сосуда. Этого можно добиться как применением микрохирургической, так и внутрисосудистой методик.
Клинический случай
Пациент 48 лет поступил в РНХИ им. проф. А.Л. Поленова в плановом порядке с целью дообследования, определения дальнейшей тактики лечения. Из анамнеза известно, что длительно страдает артериальной гипертензией, регулярно принимает гипотензивную терапию, не курит, в июне 2018 г. после физической нагрузки появились выраженные головные боли, не купируюшиеся приемом анальгетиков, светобоязнь, тошнота, позывы к рвоте. Бригадой скорой помощи с подозрением на субарахноидальное кровоизлияние (САК) был доставлен в стационар по месту жительства (г. Чебоксары). При обследовании у пациента верифицировано базальное кровоизлияние (HH2, Fisher2). При церебральной ангиографии выявлен источник кровоизлияния - мешотчатая аневризма передней соединительной артерии, неправильной вытянутой формы, ориентированная книзу, размерами 5,7 х 2,9 мм, шейка - 2,2 мм (рис. 1).
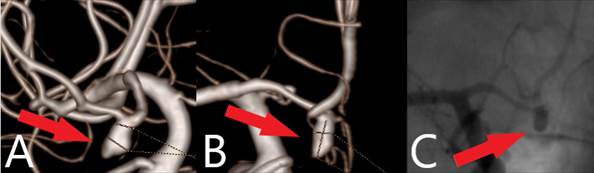
Рис. 1. А, В - церебральная СКТ-ангиография, С - селективная церебральная ангиография.
Визуализируется мешотчатая аневризма передней соединительной артерии (указана стрелкой)
В экстренном порядке пациент был прооперирован – выполнена внутрисосудистая субтотальная окклюзия аневризмы отделяемыми спиралями. На контрольной послеоперационной ангиографии отмечается пришеечное контрастирование аневризмы (рис. 2).
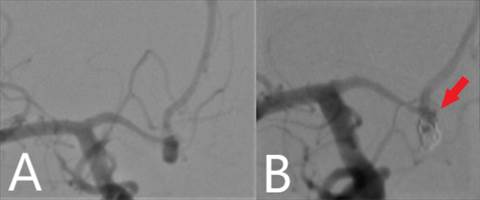
Рис. 2. Селективная церебральная ангиография до (А) и после (В) проведенного оперативного вмешательства. Сохраняется пришеечное контрастирование аневризмы (указано стрелкой)
В послеоперационном периоде проходил курс консервативной терапии, был выписан без очаговой и менингеальной неврологической симптоматики.
При поступлении в РНХИ им. проф. А.Л. Поленова через 10 месяцев после первичного оперативного вмешательства очаговая и менингеальная неврологическая симптоматика отсутствовала. Выполнена селективная церебральная ангиография, при которой отмечено значимое увеличение размеров заполняющейся аневризмы передней соединительной артерии. Размеры заполняемой части 3,3 х 3,3 мм, шейка - 2,9 мм (рис. 3).
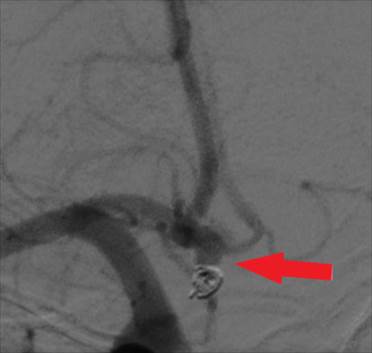
Рис. 3. Церебральная ангиография через 10 месяцев после перенесенного внутрисосудистого вмешательства. Отмечается значимое контрастирование аневризмы (указано стрелкой)
Таким образом, выявлен рецидив аневризмы передней соединительной артерии, вероятно, сформировавшийся за счет двух механизмов – уплотнения комплекса спиралей и миграции его в сторону купола аневризмы, а также рост аневризмы в пришеечной части.
Учитывая наличие значимого заполнения аневризмы, перенесенное САК в анамнезе, риски повторного кровоизлияния из данной аневризмы были расценены как относительно высокие, в связи с чем принято решение о необходимости выполнения повторного оперативного вмешательства. Первоначально рассматривались два варианта лечебной тактики: внутрисосудистая окклюзия заполняемой части аневризмы спиралями со стент-ассистенцией или её микрохирургическое клипирование. Из-за особенностей анатомии комплекса ПМА-ПСА, в частности острого угла отхождения А2-сегмента артерии, а также в связи с необходимостью использования т.н. сложного стентирования для достижения радикального результата, от внутрисосудистого лечения отказались в пользу микрохирургического. Дополнительными аргументами в пользу выбора методики «открытого» лечения явились отсутствие витков спиралей в пришеечной части аневризмы, которое могло бы вызвать определенные трудности при позиционировании клипсы, направленность аневризмы вниз, облегчавшей возможность ее выделения из спаек без необходимости дополнительной резекции мозговой ткани.
Аневризма была клипирована из правостороннего латерального супраорбитального, субфронтального доступа. Из особенностей вмешательства – отмечен выраженный спаечный процесс в области аневризмы, что существенно затрудняло этапы ее выделения, комплекс спиралей, расположенный в основном в купольной части аневризмы, несколькими витками выходил за границы стенок аневризмы в субарахноидальное пространство (т.н. протрузия) (рис. 4).
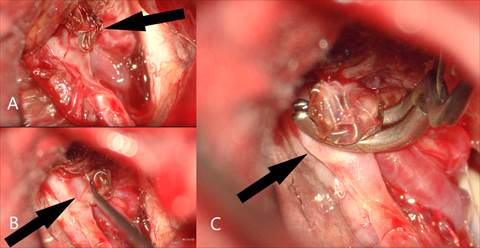
Рис. 4. Интраоперационная фотография. А - стрелкой указана протрузия и выход витков спиралей через купол аневризмы в субарахноидальное пространство. В - визуализируется зона рецидива аневризмы. С - аневризма выключена из кровотока клипсой, изогнутой по плоскости
В послеоперационном периоде – нарастания очаговой и менингеальной неврологической симптоматики не отмечено, рана зажила первичным натяжением. Пациент выписан на 8-е сутки после оперативного вмешательства, после чего вернулся к труду.
Через 6 месяцев после повторного оперативного лечения пациенту выполнена контрольная церебральная ангиография, по данным которой признаков контрастирования аневризмы не получено (рис. 5).
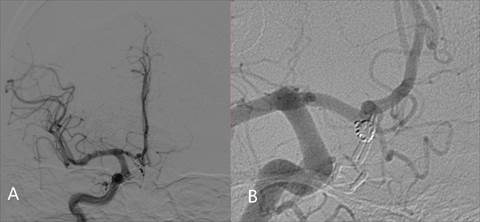
Рис. 5. Контрольная селективная церебральная ангиография через 6 месяцев после повторного оперативного вмешательства. Данных за контрастирование аневризмы не получено
Обсуждение
Широкое применение внутрисосудистых операций в лечении церебральных аневризм берет свое начало с 1990-х годов, когда G. Guglielmi была предложена методика окклюзии аневризм отделяемыми спиралями, которая в дальнейшем показала свою высокую эффективность и безопасность для лечения данной цереброваскулярной патологии [6-8].
Исследование ISAT (2002-2014), основной задачей которого было сравнить эффективность внутрисосудистых методик и открытых нейрохирургических вмешательств на церебральных аневризмах в остром периоде кровоизлияния, установило, что частота смертности и инвалидизации после внутрисосудистых вмешательств была значительно меньше, чем после открытых, что объяснимо меньшей инвазивностью и отсутствием интраоперационной травмы мозга. Однако было отмечено, что у пациентов после внутрисосудистого оперативного вмешательства нередко возникала необходимость повторной операции на той же аневризме, а частота повторных кровоизлияний из эмболизированной аневризмы в три раза превышала частоту кровоизлияний из аневризмы, прооперированной микрохирургическим способом [9].
Эффективность методики окклюзии аневризм спиралями с целью предотвращения повторного разрыва в остром периоде субарахноидального кровоизлияния показана несколькими крупными рандомизированными исследованиями [9-11]. В то же время долговечность и стабильность эмболизации остаются малоизученными. Последние публикации указывают, что частота рецидивов аневризм после внутрисосудистых вмешательств выше, чем после микрохирургического лечения, а также что рецидив аневризмы может возникнуть не только в короткое время (в течение года), но и в течение более длительного времени после перенесенного вмешательства [10; 12].
Причиной кровоизлияния из оперированной аневризмы могут являться как ее неполное выключение из кровотока, так и ее рецидив. Согласно данным Chen K.S. (2015), частота послеоперационного «роста» аневризм составляет примерно 13,3%, и большая их часть требует проведения повторного оперативного вмешательства [13].
Анализ литературных данных с 1998 по 2016 г. показывает, что частота рецидивов церебральных аневризм после внутрисосудистых вмешательств колеблется в пределах от 8 до 34% [10-12]. Внедрение в практику первой генерации ассистирующих самораскрывающихся стентов, изготавливаемых путем лазерной резки, позволило существенно снизить эти показатели до 13,2% [14]. В то же время необходимость повторных оперативных вмешательств остается достаточно высокой и может достигать 7% [15].
Основными факторами риска рецидивирования церебральных аневризм в послеоперационном периоде ряд авторов считают их крупный и гигантский размер, наличие ранее перенесенного кровоизлияния, недостаточную плотность упаковки аневризмы спиралями, а также артериальную гипертензию и молодой возраст пациента [16].
Дополнительно к факторам риска рецидива можно отнести структурные изменения в стенках несущих аневризму сосудов, что может быть связано с нарушением свойств коллагеновых и эластических волокон артериальной стенки [17; 18].
J. Raymond (2003) подразделяет рецидивы внутричерепных аневризм после эндоваскулярной эмболизации на ранние, связанные с особенностями морфологии первичной аневризмы или техникой оперативного вмешательства (в данном случае речь идет о неполной эмболизации аневризмы), и поздние, формирование которых может быть связано с продолжающимся действием гемодинамического стресса [19; 20]. Таким образом, необходимость выполнения первичной реконструкции несущей аневризму артерии не вызывает сомнений.
В заключение стоит отметить, что относительно высокая частота рецидивирования аневризм после внутрисосудистых вмешательств, большое количество факторов риска и механизмов формирования рецидивов, различные сроки их выявления, сохраняющиеся на этом фоне риски повторного внутричерепного кровоизлияния указывают на необходимость дальнейшего изучения данной проблемы.
Заключение
Результаты внутрисосудистого лечения церебральных аневризм в остром периоде субарахноидального кровоизлияния обнадеживают, показывая значимо лучшие клинические исходы в раннем и отдаленном послеоперационном периодах.
Основными проблемами эндоваскулярного направления в лечении данной патологии остаются высокое количество рецидивов, зачастую требующее повторных вмешательств, а также некоторая ограниченность возможности применения в остром периоде дезагрегантной терапии, что ограничивает в ряде случаев использование интракраниальных стентов. Появление новых генераций стентов, позволяющих применять монотерапию, призвано нивелировать эту проблему.
Контрольные ангиографические исследования в отдаленном периоде после проведенного внутрисосудистого вмешательства на церебральной аневризме являются неотъемлемой частью лечебной стратегии данного вида цереброваскулярной патологии. Сроки наблюдения за пациентами и выполнения контрольных исследований остаются обсуждаемыми, но, на наш взгляд, должны составлять не менее 36 месяцев после операции.
Целесообразной остается разработка критериев риска рецидива аневризмы с возможностью оценки еще на дооперационном этапе для выбора оптимальной тактики лечения. Среди факторов риска, которые можно выделить в представленном нами случае: артериальная гипертензия, перенесенный разрыв аневризмы, неполное ее выключение спиралями при первичном оперативном вмешательстве.
Наш опыт показывает, что церебральные аневризмы с признаками рецидива следует оперировать, выполняя реконструкцию несущего аневризму сосуда. Одним из методов решения данной проблемы является микрохирургическое реконструктивное клипирование, продемонстрированное в данном наблюдении.
Библиографическая ссылка
Бобинов В.В., Петров А.Е., Рожченко Л.В., Горощенко С.А., Коломин Е.Г. МИКРОХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПАЦИЕНТА С РЕЦИДИВОМ АНЕВРИЗМЫ ПЕРЕДНЕЙ СОЕДИНИТЕЛЬНОЙ АРТЕРИИ ПОСЛЕ ВНУТРИСОСУДИСТОЙ ОККЛЮЗИИ СПИРАЛЯМИ. СЛУЧАЙ ИЗ ПРАКТИКИ. // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30693 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.30693



