Несмотря на очевидный прогресс в понимании биологии возникновения и прогрессирования злокачественных опухолей толстой кишки, а также значительное улучшение стратегий лечения, разработка новых терапевтических алгоритмов по-прежнему является необходимым условием для улучшения показателей выживаемости при этом заболевании [1, 2].
Традиционно доклиническую оценку противоопухолевой эффективности фармакологических субстанций выполняют с использованием хорошо зарекомендовавших себя клеточных линий, ксенотрансплантированных мышам с ослабленным иммунитетом (например, мышам Nude, SCID, NOG) [3].Ксенографты клеточных линий (CDX – cell-line derived xenograft) фенотипически и генетически достаточно однородны и не воспроизводят гетерогенность реальных опухолей; кроме того, раковые клетки вследствие отбора в условияхin vitro обычно имеют тенденцию к слабовыраженной дифференцировке и более агрессивные характеристики по сравнению с человеческими злокачественными новообразованиями. Хотя однородность клеточной культуры может быть весьма полезным фактором для решения ряда проблем фундаментальной науки, например для изучения сигнальных путей, CDX имеют ограниченный трансляционный потенциал [4]. Обнадеживающие результаты доклинических исследований противоопухолевой активности новых фармакологических субстанций, протестированных на ксенографтах культурального происхождения, в подавляющем большинстве случаев не воспроизводятся в ходе клинических испытаний, и вероятность того, что лекарственное средство будет одобрено и зарегистрировано среди онкологических препаратов, ниже, чем в других медицинских областях [5].
Потребность в более эффективных инструментах для проведения трансляционных исследований в области онкологии привела к разработке ксенографтов, полученных путем имплантации опухолевых образцов, взятых от пациента (PDX – patientderived xenograft) в ходе биопсии или хирургического этапа лечения, мышам с ослабленным иммунитетом.Этот подход позволяет учитывать исходные параметры злокачественных новообразований, генетическую и молекулярную гетерогенность, что является ключевыми чертами человеческих опухолей.Уникальный характер таких моделей позволяет с большой точностью воспроизвести морфологический и биологический спектр заболевания [6, 7].
Наиболее часто используемой процедурой для создания PDX является подкожная (гетеротопическая) имплантация опухолевого материала. Преимущества этого метода очевидны: не требуется наличие навыков экспериментальной хирургии у персонала, возможна оценка роста ксенографта без использования специальных приборов для визуализации. Однако подкожные ксенографты имеют и ряд недостатков, такие как низкая метастатическая способность, а также отсутствие взаимодействия опухоли с соответствующей микросредой, что, как известно, является важным элементом, влияющим на степень подвижности и инвазивности злокачественных клеток [4].
Ортотопические модели, полученные путем имплантации опухолевого материала в гистологически соответствующий орган, делают возможным изучение локальной опухолевой инвазии, а также метастатического распространения, тем самым исключаются недостатки подкожных ксенографтов.
Цель исследования
Целью работы явилось создание ортотопической PDX-модели рака толстой кишки путем имплантации опухолевых образцов, взятых от пациента, иммунодефицитным мышам линии Balb/c Nude.
Материал и методы исследования
Лабораторные животные и их содержание
Работу выполняли на 21 самке иммунодефицитных мышей линии Balb/c Nude, полученной из «SPF-вивария» Института цитологии и генетики Сибирского отделения Российской академии наук (г. Новосибирск). Мыши содержались в SPF-блоке вивария федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр онкологии» в индивидуально вентилируемых клетках в помещении с контролируемыми параметрами микроклимата (температура 18–26˚C, влажность воздуха 30–60%, световой режим «день – ночь» по 12 ч). Все манипуляции выполняли, соблюдая «Правила проведения работ с использованием лабораторных животных».
Опухолевый материал
Для создания ортотопических PDX-моделей рака толстой кишки использовали образцы опухолей больных раком слепой кишки, полученные в результате хирургических резекций. От всех пациентов было взято письменное согласие на передачу биологического материала. Пациенты обратились в отделение абдоминальной онкологии № 1 «НМИЦ онкологии» в период с февраля 2020 г. по апрель 2020 г.
Создание ортотопической PDX-модели рака толстой кишки
Для создания 1-й генерации ортотопической PDX-модели рака толстой кишки применяли хирургический метод ортотопической имплантации – SOI (surgical orthotopic implantation). В ходе SOI выполняли имплантацию фрагмента опухоли пациента размером 2×2×2 мм в слепую кишку мышей линии Balb/c Nude. Последующие генерации ортотопической PDX-модели рака толстой кишки (2-ю и 3-ю генерации ксенографтов) получили путем последовательной серийной ортотопической трансплантации опухолевого материала методом SOI. Оценку приживления и роста ксенографта осуществляли, выполняя контрольную лапаротомию через 20, 50 и 70 дней после имплантации. Хирургические манипуляции выполняли с применением инъекционной анестезии для лабораторных животных, используя ветеринарные препараты «Ксила» и «Золелил-100» в дозах 20 мг/кг и 50 мг/кг соответственно. Эвтаназию производили методом дислокации шейных позвонков.
Анализ роста опухолевых ксенографтов
Измерения опухолевых узлов проводили в ходе лапаротомии при помощи штангенциркуля, их размеры рассчитывали по формуле Шрека для эллипсоида – V=а×в×с×p/6, где V – объем опухоли (мм3), а, в, с – максимальные диаметры эллипсоида в трех плоскостях (мм).
Гистологическое исследование
Опухолевые фрагменты фиксировали в 10%-ном формалине в течение 24 ч, затем заключали в парафин. После этого готовили гистологические срезы толщиной 2 мкм, которые окрашивали гематоксилином и эозином по стандартной методике. Проводили гистологическое исследование донорской и ксеногенных опухолей.
Статистический анализ
Полученные экспериментальные данные были обработаны статистически с помощью пакета программ STATISTICA 8.0. Данные об объемах ксенографтов представлены в виде среднего значения и стандартной ошибки среднего. Сравнение динамики роста между группами не выполнялось в связи с маленьким объемом выборки (n=3).
Результаты исследования и их обсуждение
В ходе работ по созданию ортотопической PDX-модели рака толстой кишки, максимально точно воспроизводящей особенности человеческого заболевания, была выполнена серия экспериментов, предполагающих процедуру ортотопической имплантации опухолевого материала в слепую кишку иммунодефицитным мышам линии Balb/c Nude.
Для создания 1-й генерации ксенографтов было выполнено 5 процедур. В рамках одной процедуры опухолевый материал, взятый от 1 пациента, имплантировали группе, состоящей из 3 животных. Общие характеристики пациентов и оценка результатов соответствующей процедуры ксенотрансплантации представлены в таблице 1.
Таблица 1
Характеристики пациентов – доноров опухолевого материала и оценка результатов ксенотрансплантации иммунодефицитным мышам линии Balb/c Nude
|
Общие характеристики ортотопической ксенотрансплантации опухолевого материала от пациентов иммунодефицитным мышам |
|||||||
|
Характеристики пациентов – доноров опухолевого материала |
Оценка результатов имплантации (1-я генерация) |
||||||
|
Порядковый номер процедуры |
Пол пациента |
Способ получения образца |
Стадия TNM |
Гистология |
Предшествующее специализированное лечение |
Результаты имплантации общ. кол-во/кол-во приживления |
Объем ксенографтов через 50 дней после имплантации (мм3сутки, среднее значение)
|
|
1
|
Ж |
Удаление опухоли |
T3N0M0 |
Высокодифференцированная аденокарцинома |
– |
3/0 |
– |
|
2
|
Ж |
Удаление опухоли |
T3N1M0 |
Умеренно дифференцированная аденокарцинома |
– |
3/2 |
65 |
|
3
|
Ж |
Удаление опухоли |
T4N1M0 |
Умеренно дифференцированная аденокарцинома |
– |
3/3 |
104 |
|
4
|
Ж |
Удаление опухоли |
T3N1M0 |
Умеренно дифференцированная аденокарцинома |
– |
3/0 |
– |
|
5
|
Ж |
Удаление опухоли |
T3N1M0 |
Высокодифференцированная аденокарцинома |
– |
3/0 |
– |
Для достижения положительного результата ксенотрансплантации крайне важно избегать участков некроза и ориентироваться на зоны роста опухоли при выборе фрагмента донорского биоматериала. В связи с этим было принято решение не использовать биопсийные образцы. Все образцы, используемые для создания PDX, были выделены из макропрепаратов удаленных опухолей, полученных в результате выполнения хирургического этапа лечения. Опухолевый материал тщательно промывали питательной средой RPMI1640 c содержанием гентамицина 10%, удаляли некротические ткани, затем делили на фрагменты размером около 2×2×2 мм для имплантации в купол слепой кишки животных-реципиентов разработанным нами способом (рис. 1) [8].
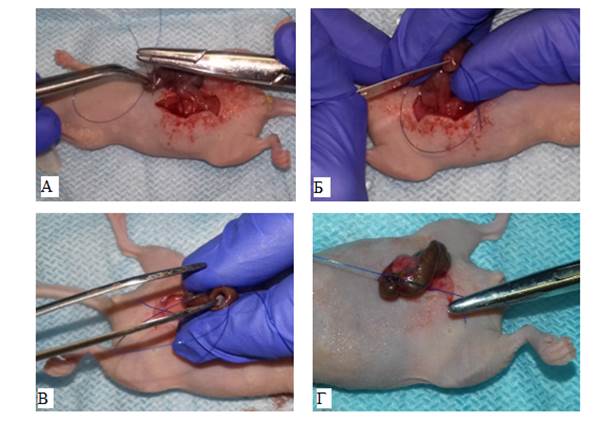
Рис. 1. Создание ортотопической PDX-модели имплантацией фрагмента опухоли толстой кишки человека в слепую кишку иммунодефицитных мышей. А – наложение кисетного серозно-мышечного шва в концевой части слепой кишки мыши; Б – рассечение серозно-мышечного слоя в концевой части слепой кишки; В – инвагинация концевой части слепой кишки и имплантация фрагмента опухоли толстой кишки человека в образовавшийся «карман»; Г – фиксация фрагмента опухоли путем затягивания кисетного шва на слепой кишке мыши
Две из пяти выполненных процедур привели к положительному результату в виде формирования ортотопических ксенографтов (рис. 2).
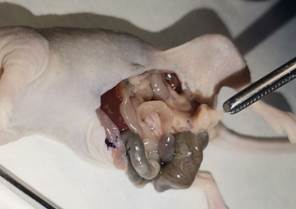
Рис. 2. Мышь линии Balb/c Nude с ортотопическим ксенографтом рака толстой кишки человека
Биоматериал пациента (фрагмент донорской опухоли) и ортотопические ксенографты последовательных трех генераций были охарактеризованы как умеренно дифференцированные аденокарциномы с очагами десмопластической реакции (рис. 3). Степень дифференцировки оставалась стабильной и не менялась от предыдущей генерации ксенографта к последующим. Эти наблюдения подтверждают наличие выраженного сходства между донорской и ксенотрансплантированными опухолями ранних генераций (1-я, 2-я и 3-я генерация).
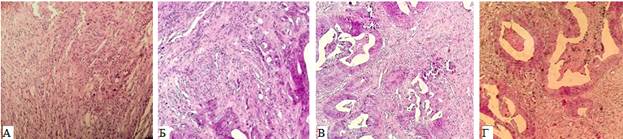
Рис. 3. Гистологические препараты рака толстой кишки. А – опухоль пациента (донорская опухоль). Окраска гематоксилином и эозином. ×200; Б – ксеногенная опухоль, 1-я генерация; В – ксеногенная опухоль, 2-я генерация; Г – ксеногенная опухоль, 3-я генерация
Контрольная лапаротомия, выполненная через 20, 50 и 70 дней, показала отсутствие положительного результата процедур имплантации № 1, № 4 и № 5; в результате процедуры № 2 наблюдался рост ксенографтов у двух из трех животных в группе, однако динамика увеличения объемов опухолевых узлов была незначительной (менее 100 мм3 через 70 дней после имплантации), в связи с этим животные были подвергнуты эвтаназии, а опухолевый материал был выделен и заморожен для дальнейшего изучения.
При лапаротомии, выполненной через 20 дней, в результате процедуры имплантации № 3 у всех мышей в группе наблюдался рост первичной опухоли, средний размер ксенографтов составил 47,6 мм3. Средние объемы ксенографтов через 50 и 70 дней после имплантации составили 104,1 мм3 и 157,0 мм3 соответственно.
2-я и 3-я генерации PDX, полученные путем последовательной серийной ортотопической трансплантации опухолевого материала, характеризовались более высокими темпами роста. Средние объемы ксенографтов 2-й генерации составили 67,9 мм3, 117,1 мм3 и 370,0 мм3 через 20, 50 и 70 дней после имплантации соответственно; средние объемы ксенографтов 3-й генерации составили 67,2 мм3,155,4 мм3 и 330,0 мм3 через 20, 50 и 70 дней после имплантации соответственно.
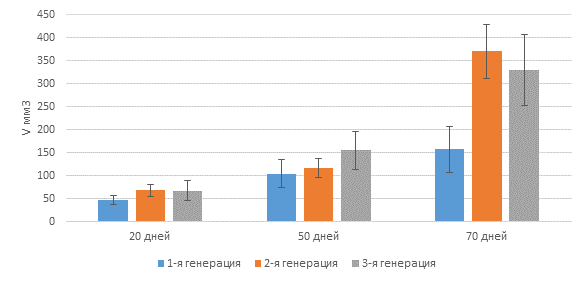
Рис. 4. Средние объемы ортотопических ксенографтов рака толстой кишки человека трех последовательных генераций через 20, 50 и 70 дней после имплантации опухолевого фрагмента иммунодефицитным мышам линии Balb/c Nude (процедура имплантации № 3)
Данные представлены в виде среднего значения, в качестве планки погрешности указана стандартная ошибка среднего.
Представленные результаты позволяют говорить о том, что стратегия последовательной ортотопической имплантации фрагментов опухолевого материала (создание 2-й и 3-й генераций PDX) позволяет добиться устойчивых трансплантационных и динамических характеристик, а отсутствие дезагрегации клеток для введения в соответствующий орган мыши, как это описано в ряде работ [9, 10, 11], способствует сохранению исходной структуры опухолевой ткани человека, что может иметь большое значение для определения биологического поведения опухоли.
Заключение
Для создания ортотопической PDX-модели образцы рака толстой кишки человека, полученные хирургическим путем у пациентов, были имплантированы ортотопически в слепую кишку мышей линии Balb/c Nude, при этом наблюдался обширный ортотопический рост у 3 из 15 животных при создании 1-й генерации ксенографтов рака толстой кишки человека. Полученная модель демонстрировала локальный рост, устойчивые характеристики приживления, а также воспроизводила гистологию донорской опухоли, что указывает на возможность ее применения для in vivo тестирования фармакологических субстанций, обладающих потенциальным противоопухолевым эффектом в отношении рака толстой кишки человека.
Библиографическая ссылка
Гончарова А.С., Егоров Г.Ю., Кит С.О., Максимов А.Ю., Енгибарян М.А., Николаева Н.В., Волкова А.В., Непомнящая Е.М., Заикина Е.В., Ходакова Д.В. МОДЕЛИРОВАНИЕ РАКА ТОЛСТОЙ КИШКИ ПУТЕМ ОРТОТОПИЧЕСКОЙ КСЕНОТРАНСПЛАНТАЦИИ // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30692 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.30692



