В настоящее время хорошо известно, что основные регуляторные системы организма: иммунная, нейроэндокринная и микробное сообщество дигестивного тракта, функционируют по принципу внутри- и межсистемного сетевого взаимодействия, демонстрируя высокий уровень пластичности, обеспечивающей коллегиальную адаптацию в условиях стресса [1; 2].
Иммунная и нейроэндокринная системы имеют ряд общих лигандов и рецепторов, таких как рецепторы для нейротрансмиттеров и нейропептидов, цитокинов, хемокинов, факторов роста и др. [1]. Нейроэндокринная регуляция иммунных ответов осуществляется системно через гормональные каскады (гипоталамо-гипофизарно-надпочечниковую ось, ГГН-ось), регионально через нервные пути в лимфоидные органы и локально через нейротрансмиттеры. Иммунорегуляторное действие на центральную нервную систему (ЦНС) опосредовано резидентными иммунокомпетентными клеткам мозга, Т-лимфоцитами, аутореактивными к антигенам мозга, вегетативной нервной системой через иннервацию симпатического и блуждающего нервов, а также периферическими цитокинами, которые в норме попадают в мозг через области со специализированной пропускной способностью гематоэнцефалического барьера [3]. Недавно показано, что кишечная микробиота, наряду с иммунной системой, способна влиять практически на все функции организма, в том числе выступать в качестве модулятора пластичности мозга, его когнитивных функций и в целом поведения персоны в норме и при патологии [4; 5].
Изменения в молекулярных информационных сигналах и путях коммуникации между иммунной, нейроэндокринной и бактериальной системами могут быть причиной многих патологических состояний, в частности психических расстройств, а эффективная терапия таких заболеваний должна быть направлена на восстановление гомеостаза организма [6; 7]. Обнаружено, что развивающийся мозг особенно чувствителен к изменениям окружающей среды (эндогенным и экзогенным), которые могут значительно нарушить траекторию развития клеток, нейронных сетей и связанное с ними поведение. Дезорганизация работы основных регуляторных систем в до- или постнатальный период, включая материнский стресс, травмы или инфекции, может глубоко модулировать или программировать развивающиеся нейронные сети и в результате приводить к развитию невропатологий, таких как расстройства аутистического спектра (РАС) и шизофренического (РШС) [8].
В меняющейся социальной и физической среде мозг и организм в целом реагируют физиологически и поведенчески для оптимальной адаптации. Физиологически – симпатическая и парасимпатическая системы, ГГН-ось, иммунная система, кишечная микробиота, метаболические гормоны и молекулярные процессы во всех органах, включая мозг, работают нелинейно и способствуют адаптации через «аллостаз» (достижение стабильности через активацию) этих систем. Но одни и те же медиаторы обладают двухфазным действием и могут также способствовать патофизиологии при чрезмерном использовании или когда их активность не сбалансирована друг с другом (аллостатическая нагрузка или перегрузка) [2]. Для комплексной оценки аллостаза организма в норме и при патологии группой ученых был предложен метод корреляционной адаптометрии (КА), в основе которого лежит открытый авторами «эффект группового стресса», проявляющийся увеличением силы связей физиологических показателей организма в ответ на действие стрессоров и, наоборот, снижением силы и числа связей при успешной адаптации системы [9].
Цель исследования: оценить адаптационный потенциал основных регуляторных систем, участвующих в поддержании гомеостаза организма, у детей с расстройствами аутистического спектра и расстройствами шизофренического спектра с использованием метода корреляционной адаптометрии.
Материалы и методы исследования
В исследование были включены 82 ребенка с диагнозом РАС, проходивших немедикаментозную реабилитацию в социально-реабилитационном центре «Здоровье» г. Челябинска; и 9 детей с сенестопатической шизофренией (F20.8, группа РШС), находящихся на диспансерном учете в Областной клинической специализированной психоневрологической больнице № 1 г. Челябинска. В зависимости от сходства/различий значений исследуемых биологических параметров с детьми с шизофренией, дети с РАС были разделены на 2 группы, условно названные нами РАС-тип (52 ребенка, отличающихся по биологическому фенотипу от РШС) и РАС-шизотип (30 детей, схожих по биологическому фенотипу с РШС). В качестве условно здорового контроля в исследование включено 45 типично развивающихся детей (ТРД). У всех родителей или законных представителей детей, включенных в исследование, получено информированное согласие. Работа одобрена этическим комитетом Челябинского государственного университета (протокол № 1 от 16.05.2016 г.) [10].
Материалом для исследования служила венозная кровь. Концентрацию цитокинов: IL-6, IL-1β, IFN-γ, TNF-α, IL-10, IL-4 (ЗАО «Вектор-Бест», Новосибирск); нейрогормонов: окситоцина (Peninsula Laboratories International, США), дофамина, адреналина, норадреналина (IBL International, Германия), кортизола (ООО «Хема», Россия), адренокортикотропного гормона – АКТГ (Biomerica, Германия), серотонина (IBL International, Германия), и метаболитов: триптофана и кинуренина (Immundiagnostik AG, Германия), определяли в плазме крови методом твердофазного иммуноферментного анализа на анализаторе Multiscan EX (Labsystems, Финляндия) [10].
Определение абсолютного числа представителей основных 5 типов микробиоты тонкого кишечника ( Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria и Fusobacteria ) проводили методом газовой хроматографии - масс-спектрометрии микробных маркеров (ГХМС ММ) в цельной периферической крови с помощью газового хромато-масс-спектрометра «Маэстро» (ООО «Интерлаб», Россия), как было описано ранее [11].
В ходе статистической обработки применяли метод КА, который позволяет оценить адаптационный потенциал организма (количество и силу связей между физиологическими показателями основных регуляторных систем) с помощью интегрального показателя – веса корреляционного графа (G). Для этого вычисляли парные коэффициенты корреляции Спирмена, интервальную оценку G проводили методом складного ножа. В ходе выборочных сравнений использовали однофакторный дисперсионный анализ, проведенный на псевдозначениях складного ножа с апостериорными попарными сравнениями методом Тьюки. Для расчетов использованы базовые средства программно-статистической среды R (version 3.6.1, пакет Stats). Графические построения выполнены в пакете Corrplot для R.
Результаты исследования и их обсуждение
В работе проведена оценка периферических уровней некоторых показателей основных регуляторных систем организма: иммунной (цитокины – IL-6, IL-1β, IFN-γ, TNF-α, IL-10, IL-4), нейроэндокринной (гормоны – окситоцин, дофамин, адреналин, норадреналин, кортизол, АКТГ, серотонин, и метаболиты – триптофан, кинуренин) и микробного сообщества кишечника (типы – Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria и Fusobacteria) у ТРД, детей с РАС и РШС с помощью метода КА.
В результате анализа для каждой обследованной группы детей: ТРД, РАС-тип, РАС-шизотип и РШС, был получен интегральный показатель адаптационного потенциала организма – вес корреляционного графа (G) , который включал в себя суммарное количество и силу связей между показателями цитокинов, нейрогормонов и микроорганизмов. Результаты представлены в таблице.
Интервальная оценка величины веса корреляционного графа G в группах ТРД, детей с РАС и РШС (М[95%ДИ])
|
Показатели |
ТРД |
РАС-тип |
РАС-шизотип |
РШС |
|
|
1 |
2 |
3 |
4 |
|
Объем выборки n |
45 |
52 |
30 |
9 |
|
G lg, скл. нож, выбросы |
18,11 |
18,57 |
17,47 |
43,24 |
|
95% ДИ lg, скл. нож, выбросы |
[15,35; 21,36] |
[15,83; 21,77] |
[15,23; 20,05] |
[31,27; 59,79] |
|
Однофакторный дисперсионный анализ |
||||
|
Источник изменчивости |
Сумма квадратов SS |
Степени свободы df |
F- критерий |
Оценка значимости Р |
|
Между группами |
8193,0 |
4 |
8,87 |
<0,001 |
|
Внутри групп |
31601,8 |
133 |
– |
– |
|
Общая |
39794,8 |
136 |
– |
– |
|
Апостериорные сравнения методом Тьюки |
||||
|
|
|
P2-1>0,999 |
P3-1=0,979 P3-2=0,975 |
P4-1 < 0,001 P4-2<0,001 P4-3<0,001 |
Примечание: P2-1 – различия между группами ТРД и РАС-тип; P3-1 – различия между группами ТРД и РАС-шизотип; P3-2 – различия между группами РАС-тип и РАС-шизотип; P4-1 – различия между группами ТРД и РШС; P4-2 – различия между группами РАС-тип и РШС; P4-3 – различия между группами РАС-шизотип и РШС. Статистически значимые различия выделены полужирным шрифтом.
Как видно из таблицы, величина G у детей с РАС (независимо от типа) не отличалась от аналогичного показателя группы ТРД. Напротив, у детей с РШС величина показателя G была в 2,5 раза выше, чем в группах детей ТРД, РАС-тип и РАС-шизотип, причем различия были высоко статистически значимыми (P<0,001). Такое значение интегрального показателя (G) говорит о высокой насыщенности связями (по количеству и силе) внутри и между основными регуляторными системами у детей с РШС.
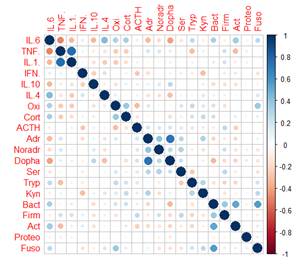
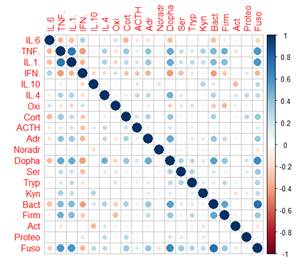
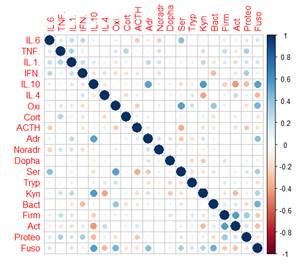
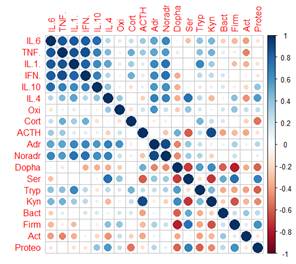
Для определения, какие показатели/связи вносят наибольший вклад в величину веса корреляционного графа и могут влиять на развитие невропатологии, для каждой из групп детей была построена тепловая карта корреляций (рисунок А-Г).
Как видно из рисунка, между исследуемыми показателями в группах ТРД и детей с РАС (групп РАС-тип и РАС-шизотип) возможно образование 190 корреляционных взаимодействий, а в группе РШС – 171 корреляции, т.к. численность типа Fusobacteria у всех детей с РШС была ниже чувствительности обнаружения метода ГХ-МС ММ (<105 КОЕ/мл) и не имела дисперсии, поэтому данный показатель был исключен из анализа.
|
А) ТРД |
Б) РАС-тип |
|
|
|
|
В) РАС-шизотип |
Г) РШС |
|
|
|
|
Тепловая карта корреляций между показателями основных регуляторных систем организма в группах ТРД (А), РАС-тип (Б), РАС-шизотип (В), РШС (Г) Примечание: Oxi – окситоцин, Cort – кортизол, ACTH –АКТГ, Adr – адреналин, Noradr – норадреналин, Dopha – дофамин, Ser – серотонин, Tryp – триптофан, Kyn – кинуренин, Bact – Bacteroidetes, Firm – Firmicutes, Act – Actinobacteria, Proteo – Proteobacteria, Fuso – Fusobacteria. В группе РШС показатель Fusobacteria не имел дисперсии, поэтому не был включен в анализ. |
|
Интересно отметить, что в группах ТРД и детей с РАС практически отсутствуют связи средней и высокой силы (больше 0,4): 10/ 8/ 14 из 190 для ТРД/ РАС-тип/ РАС-шизотип соответственно, тогда как у детей группы РШС половина корреляций (80 из 171) имеют среднюю или высокую силу (рисунок).
У ТРД можно выделить 4 кластера связей средней силы, которые необходимы для физиологического стресс-ответа: 1 кластер – корреляции между провоспалительными цитокинами (положительная – между «цитокинами тревоги» - TNF-α и IL-1β и отрицательная – между IL -6, который может выступать как противовоспалительный агент, и TNF -α); 2 кластер – положительные корреляции между моноаминами – адреналином, норадреналином и дофамином, как показатель их конверсии; 3 кластер – положительные связи внутри сообщества микроорганизмов – между типом Bacteroidetes и типами Actinobacteria и Fusobacteria, что обеспечивает полное использование пищевых ресурсов, перерабатываемых для них типом Firmicutes. Связи средней силы между системами слабо выражены и представлены отрицательным взаимодействием IL-6 c дофамином и положительными корреляциями IL-6 с бактериями типов Bacteroidetes, Actinobacteria и Fusobacteria (рис. А).
В целом можно отметить, что в группе ТРД преобладают отрицательные взаимодействия слабой силы (рис. А). Авторами показано, что сложное взаимодействие и избыточность систем отрицательной обратной связи приводят к более тонкому уровню контроля и большей гибкости, что позволяет организму адаптироваться к изменяющимся условиям окружающей среды [7].
Для детей группы РАС-тип (рис. Б) характерно наименьшее, по сравнению с остальными группами, число средних и сильных связей (8 из 190), представленных в основном межсистемными взаимодействиями. У детей группы РАС-тип, так же как у ТРД, сохранена корреляция между «цитокинами тревоги» - TNF-α и IL-1β, но без их балансировки IL-6, а также положительная корреляция между бактериями типов Bacteroidetes и Fusobacteria. Эти связи поддержаны положительным взаимодействием внутри нейрогормональной системы между окситоцином и серотонином, а также положительными корреляциями IL-4/дофамин, дофамин/Proteobacteria, кортизол/Proteobacteria и отрицательной – IL-6/кортизол (рис. Б). Низкое число средних и сильных корреляционных связей у детей группы РАС-тип может свидетельствовать о функциональной инертности основных регуляторных систем. Однако, как показано авторами [12], взаимодействие между окситоцином и серотонином через серотониновые рецепторы играет критическую роль в нормальном развитии социального поведения у детей, что может найти отражение в ранее показанной нами схожести биологических фенотипов ТРД и детей РАС-тип [10].
В группе детей РАС-шизотип можно отметить отсутствие сильных взаимодействий внутри цитокиновой системы и кластер связей адреналина: положительные - с норадреналином и дофамином и отрицательную – с триптофаном (рис. В). И это неудивительно, т.к. известно, что моноамины обеспечивают защитную реакцию «бой/бегство» при действии стрессоров, при этом влияя на снижение уровней молекул социальной коммуникации - окситоцина, и серотонина (метаболита триптофана) [13]. Кроме того, наибольшее количество корреляций (5) средней силы у детей группы РАС-шизотип обнаружено у IL-10, который важен для поддержания гомеостаза организма с помощью тонкой настройки иммунного ответа на микроорганизмы (толерантность для нормобиоты и элиминация патогенов) [14]: положительные – с кинуренином и микроорганизмами типа Fusobacteria и отрицательные – с бактериями типов Firmicutes, Actinobacteria и Proteobacteria (рис. В).
Для детей группы РШС характерно большое число (80 из 171) корреляций средней и высокой силы. Внутри иммунной системы обнаружены только положительные связи между всеми изученными цитокинами (как про-, так и противовоспалительными), которые поддержаны положительными корреляциями цитокинов с адреналином и норадреналином (рис. Г). Отсутствие отрицательных обратных связей внутри цитокиновой системы может быть связано с наличием воспаления и гиперреактивностью иммунной системы, часто наблюдаемой у детей с РШС [15]. В системе моноаминов серотонин практически полностью противопоставлен дофамину (по направленности связей) и образует отрицательную корреляцию с триптофаном (метаболитом, из которых он образуется) и положительные – со всеми типами микроорганизмов кишечника. Обращает на себя внимание практически полное отсутствие связей средней и высокой силы внутри сообщества микроорганизмов кишечника (кроме положительных корреляций между типами Firmicutes и Actinobacteria, а также между Bacteroidetes и Firmicutes) (рис. Г).
Заключение
Таким образом, наличие слабых, преимущественно отрицательных взаимодействий между иммунной, нейроэндокринной системами и микробным сообществом кишечника у ТРД и детей с РАС способствует поддержанию гомеостаза организма в пределах нормы. Тогда как высокая насыщенность сильными корреляционными связями у детей с РШС отражает низкий адаптационный потенциал и потерю пластичности основных регуляторных систем.
Библиографическая ссылка
Филиппова Ю.Ю., Полякова Е.А., Бурмистрова А.Л. АДАПТАЦИОННЫЙ ПОТЕНЦИАЛ ИММУННОЙ НЕЙРОЭНДОКРИННОЙ СИСТЕМ И МИКРОБНОГО СООБЩЕСТВА КИШЕЧНИКА У ДЕТЕЙ С АУТИЗМОМ И ШИЗОФРЕНИЕЙ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30680 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30680