В нозологической структуре заболеваний системы глазной поверхности второе место после воспалительных процессов занимает птеригиум – конъюнктивальная дегенерация, распространяющаяся на роговицу и при прогрессировании характеризующаяся развитием различных осложнений, которые приводят к стойкому снижению зрения и ухудшению качества жизни пациентов [1–3].
Для птеригиума характерны: неравномерное увлажнение глаза с развитием синдрома «сухого глаза», неуклонно прогрессирующее течение, хроническое воспаление системы глазной поверхности. Частота распространения птеригиума составляет от 0,7% до 31% среди населения в различных регионах мира [1, 4].
Этиология и патогенез данного заболевания до конца не изучены. По данным литературы, птеригиум является аутоиммунным поражением соединительной ткани, усиливающимся под воздействием солнечных лучей. В его развитии имеют место вирусная и наследственная теория, мутации различных генов, приводящие к сверхпродукции коллагена и микроциркуляторным расстройствам, но ведущую роль в настоящее время все-таки отводят нарушению лимбально-роговично-конъюнктивального барьера, хроническому воспалению системы глазной поверхности на фоне дисфункции слезной жидкости (СЖ), что сопровождается активной клеточной пролиферацией, васкуляризацией, миграцией измененных стволовых клеток лимба к центру роговицы [5, 6]. Не секрет, что при изменении кислотно-щелочного равновесия и гомеостаза СЖ активируется поток воспалительных реакций, приводящих к дегенеративным изменениям конъюнктивы и повреждению эпителиальных клеток роговицы [2, 7].
На сегодняшний день основным методом лечения птеригиума является хирургический. Существует множество модификаций удаления птеригиума, тем не менее частота его рецидивов колеблется от 40% до 70% [8, 9]. Исходя из патогенетических механизмов роста птеригиума на современном этапе многие офтальмохирурги стали отдавать предпочтение его хирургической резекции с использованием лимбальной аллотрансплантации либо аутопластики у лимба различными биоматериалами (слизистой с губы, капсулой почек, твердой мозговой оболочкой и т.д.), уменьшая тем самым риск рецидива заболевания в среднем до 10%, но не устраняя его полностью [1, 9, 10].
Золотым стандартом в хирургии птеригиума является способ трансплантации амниотической мембраны (АМ) – самой внутренней из всех трех плодных оболочек, так как она имеет высокую способность к биоинтеграции в ткани глаза. В научных исследованиях при изучении механизма действия АМ на поверхность глаза установлено, что она ускоряет пролиферацию и цитодифференцировку эпителиоцитов конъюнктивы, уменьшает иммунный ответ и риск отторжения, замедляет процессы избыточного фиброзирования и ангиогенеза [1, 10]. В то же время выявлены и негативные аспекты расположения АМ в области лимба, которые обусловлены его механическим воздействием и антигенной стимуляцией и могут сопровождаться неадекватной воспалительной реакцией на хирургическое вмешательство, замедляя тем самым репаративные процессы в конъюнктиве и роговице, приводя к грубому рубцеванию с эстетическим несоответствием здоровой конъюнктиве и помутнением роговицы, снижающим остроту зрения [9].
При использовании в клинической практике большинства современных методик хирургии птеригиума полученные нами результаты оставались неудовлетворительными. После амниопластики в зоне лимба рубцово-измененная ткань распространялась на роговицу, прорастая через создаваемый трансплантатом барьер, и птеригиум вновь рецидивировал. Именно это обстоятельство стало первопричиной поиска нового, более эффективного анатомо-топографического подхода к амниопластике на удалении от лимба в хирургическом лечении прогрессирующего птеригиума [11]. Главными особенностями предложенной методики являлись перемещение барьерной пластики в область изначального роста новообразованных сосудов (полулунная складка) с целью механического препятствия их росту, а также покрытие лимба собственной конъюнктивой со стволовыми клетками для улучшения репаративных процессов и устранения антигенной стимуляции иммунокомпетентной зоны глаза [12, 13].
Цель исследования – оценить послеоперационную динамику воспалительных и репаративных процессов, а также частоту рецидивирования птеригиума после его хирургического лечения в зависимости от различных анатомо-топографических подходов к амниопластике.
Материал и методы исследования
Были обследованы 64 пациента (64 глаза) в возрасте от 48 до 65 лет, оперированных в Хабаровском филиале ФГАУ «НМИЦ МНТК “Микрохирургия глаза” им. акад. С.Н.Федорова» Минздрава России по поводу прогрессирующего птеригиума. Процентное соотношение мужчин и женщин составило 69% и 31% соответственно. Все пациенты предъявляли жалобы на покраснение глаза, зрительный дискомфорт, ощущение инородного тела. Хирургическое лечение птеригиума, а именно удаление головки и резекция фиброваскулярной ткани, у всех пациентов выполнялось одинаково.
Все пациенты были разделены на 2 равные группы, сопоставимые по полу, возрасту, степени птеригиума, в зависимости от варианта анатомо-топографического подхода к барьерной амниопластике.
В 1-ю группу вошли 32 пациента (32 глаза), которым амниопластику выполняли по разработанной нами методике в зоне изначального роста птеригиума. Сформировавшуюся раневую поверхность склеры у лимба закрывали отсепарованной конъюнктивой, смещая ее в сторону конъюнктивальных сводов (верхний либо нижний), тем самым изменяя векторность сосудов и замещая зону лимба здоровой конъюнктивой [10].
Во 2-ю группу были включены 32 пациента (32 глаза), которым амниопластику выполняли в зоне лимба путем закрытия обнаженной склеры лоскутом амниона и его фиксации к эписклере.
После операции всем пациентам назначали инстилляции антибиотика и корнеопротектора в течение 10 дней. После наступления эпителизации роговицы c целью купирования пролиферативной активности назначали трехкратную инстилляцию 0,1%-ного раствора дексаметазона в течение 10 дней.
Конъюнктивальные швы удаляли через 10 дней после хирургического лечения.
Для оценки эффективности хирургического лечения птеригиума и частоты возникновения рецидивов заболевания, помимо офтальмологических методов исследования, в работу были включены специальные: определение осмолярности СЖ (ОСЖ), кислотно-щелочного равновесия (pH слезы) СЖ, цитологическая оценка раневого процесса в зоне операции, а также оценка индекса заболевания поверхности глаза (Ocular Surface Disease Index – OSDI).
Для определения ОСЖ использовали прибор TearLab (Osmolarity System, США), с инновационным подходом к диагностике «лаборатория на микросхеме». Исследование проводили с помощью тест-ручки, забирая менее 50 нл слезной жидкости из конъюнктивальной полости, полученный результат оценивали через 30 секунд. За вариант нормы была принята ОСЖ, представленная в офтальмологической литературе, равная в среднем 317,4±1,2 мОсм/л [4]. Известно, что при гиперосмолярности слезы (свыше 317,4±1,2 мОсм/л) начинают синтезироваться провоспалительные цитокины, активируя каскад воспалительных реакций на глазной поверхности, приводя к нестабильности СЖ и апоптозу клеток эпителия роговицы и конъюнктивы, в результате чего страдают качество и скорость медицинской реабилитации пациентов после хирургического лечения [4, 7].
Кислотно-щелочное равновесие СЖ (pH слезы) оценивали с помощью тест-полосок (Lachner, Чехия) для определения активности воспалительного процесса по степени выраженности ацидоза. Исследование проводили путем однократного касания тест-полоской конъюнктивы в средней трети нижнего свода, затем через 2–4 минуты оценивали полученный результат. Вариантом нормы pH слезы был взят диапазон 6,6–7,4 ед. (в среднем 7,1±0,3 ед.) [7, 8].
Для исследования продолжительности сроков эпителизации роговичного ложа и витализации амниона, а также для верификации фаз раневого процесса выполняли цитологическое исследование соскоба с раневого края оперированной зоны. Для этого анализа материал получали путем соскоба с поверхности раны, фиксировали в метиловом спирте и после окрашивания по методу Романовского–Гимзы, затем под иммерсионным микроскопом Leica DM LS2 в 10 полях зрения подсчитывали и выражали в процентах его клеточный состав (нейтрофильные лейкоциты, макрофаги, лимфоциты, фибробласты). Цитологический анализ клеточного состава проводили в соответствии с фазами воспалительного процесса: I фаза – воспаление (1–3-й день); II – регенерация (5–9-й день); III фаза – пролиферация (10–22-й день) [4, 8, 14].
Индекс заболевания поверхности глаза OSDI (Ocular Surface Disease Index) оценивали по результатам анкетирования, характеризуя степень тяжести заболевания системы глазной поверхности у пациентов до операции и через 1,5 месяца после операции, и выражали его в баллах от 0 до 100. Опросник «Индекс заболевания поверхности глаза» представляет собой стандартизированную анкету для оценки симптомов и тяжести заболевания болезни «сухого глаза». За вариант нормы брали оценку от 0 до 13 баллов, диапазон 14–22 балла считали легкой степенью заболевания, а более 22 баллов – тяжелой степенью заболевания поверхности глаза [7].
Биомикроскопический мониторинг состояния глазной поверхности проводили ежедневно до полной эпителизации роговицы и затем еженедельно до завершения витализации амниона.
Основным критерием клинической эффективности хирургического лечения прогрессирующего птеригиума после операции являлась частота рецидивирования, которую оценивали через 1 год.
Полученные в ходе исследований числовые значения были статистически обработаны с помощью программного обеспечения Microsoft Office Exсel 2007. Проверка нормальности распределений осуществлялась с использованием критерия Шапиро–Уилка. Данные представлены в виде M±m, где M – среднее значение, m – стандартная ошибка. Количественные показатели сравнивались с использованием t-критерия Стьюдента. Отличия считались значимыми на уровне 0,05.
Результаты исследования и их обсуждение
Ранний послеоперационный период у всех исследуемых пациентов протекал без осложнений. Признаки послеоперационного инфицирования в оперированных глазах отсутствовали. Клиническое течение раневого процесса в сравниваемых группах приведено на рисунке.
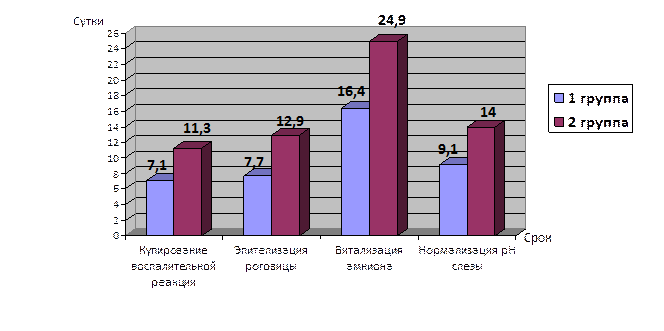
Динамика сроков купирования воспалительной и репаративной реакции глаза при различных вариантах барьерной амниопластики
Как видно на рисунке, купирование воспалительной реакции конъюнктивы (отека и гиперемии) в 1-й группе наблюдения произошло к 7-м суткам, в то время как во 2-й группе – к 11-м суткам (7,1±0,3 против 11,3±0,3; p<0,05). Также можно отметить явную положительную динамику в сроках эпителизации роговицы и витализации амниона в 1-й группе по сравнению со 2-й группой: в среднем 8 (7,7±0,2) против 13 суток (12,9±0,1) и 16 (16,4±0,1) против 25 суток (24,9±0,2) соответственно, в результате исключения у пациентов 1-й группы раздражающего фактора иммунокомпетентную зону глаза и способности к органотипической эпителизации роговицы. Нормализация показателей кислотно-щелочного равновесия СЖ также произошла статистически быстрее в 1-й группе, чем во 2-й (9,1±0,2 против 14,0±0,5 суток; p<0,05), что свидетельствовало о длительном сохранении дисбаланса буферных систем, а также визуальном сохранении признаков воспалительной реакции конъюнктивы и роговицы у пациентов 2-й группы.
Характеристика раневого секрета в послеоперационном периоде в группах сравнения представлена в таблице 1.
Таблица 1
Состояние клеточного состава мазков-соскобов раневой зоны в соответствии с фазами воспалительного процесса в группах сравнения
|
Клеточный состав (%) |
Фаза воспалительного процесса |
|||||
|
I – воспаление (1–3-и сутки) |
II – регенерация (5–9-е сутки) |
III – пролиферация (10–22-е сутки) |
||||
|
Группа |
||||||
|
1-я |
2-я |
1-я |
2-я |
1-я |
2-я |
|
|
Нейтрофильные лейкоциты |
23,0±0,5 |
40,4±0,6* |
9,9±0,2 |
11,9±0,2* |
00,0±0,0 |
4,2±0,2* |
|
Макрофаги |
32,1±0,6 |
45,5±0,4* |
12,2±0,5 |
25,4±0,6* |
2,0±0,0 |
2,1±0,4* |
|
Лимфоциты |
10,3±0,2 |
14,1±0,2* |
8,4±0,2 |
12,9±0,4* |
3,4±0,1 |
4,2±0,1* |
|
Фибробласты |
5,0±0,3 |
1,2±0,2* |
9,9±0,2 |
20,5±0,3* |
2,4±0,2 |
9,2±0,2* |
|
Примечание: * – значимые различия с 1-й группой (p<0,05). |
||||||
Результаты цитологического исследования в сравниваемых группах (табл. 1) показали более быстрое регрессирование воспаления и начало регенераторного процесса в 1-й группе, чем во 2-й группе наблюдения. Так, в III фазе воспалительного процесса у пациентов 1-й группы отмечается полное отсутствие воспалительных клеток, в то время как во 2-й группе эти клетки еще присутствуют (p<0,05).
Состояние системы глазной поверхности в зависимости от различного анатомо-топографического подхода к амниопластике при хирургическом лечении птеригиума представлено в таблице 2.
Таблица 2
Показатели индекса заболевания поверхности глаза (OSDI) и осмолярности слезной жидкости (ОСЖ) в группах сравнения исходно и в динамике послеоперационного наблюдения
|
Группа пациентов |
OSDI (баллы) |
ОСЖ (мОсм/л) |
||
|
Исходная |
1,5 месяца после операции |
Исходная |
1,5 месяца после операции |
|
|
1-я (n=32) |
14,3±0,2 |
11,9±0,3 |
326±1,4 |
312±1,3 |
|
2-я (n=32) |
14,0±0,3 |
16,5±0,3* |
327±1,6 |
321±1,0* |
|
Примечание: * – значимые различия с 1-й группой (p<0,05). |
||||
Из данных, представленных в таблице 2, видно, что показатели ОСЖ и OSDI в исследуемых группах до операции были выше нормальных среднестатистических значений, что характеризовало наличие хронической воспалительной реакции системы глазной поверхности, обусловленной прогрессированием птеригиума и нестабильностью СЖ.
В динамике послеоперационного наблюдения через 1,5 месяца в 1-й группе наблюдения произошло статистически значимое снижение ОСЖ и OSDI до нормальных значений 312±1,3 и 11,9±0,2 балла соответственно (p<0,05), что указывало на купирование воспалительных реакций, а также, вероятно, на отсутствие раздражающего фактора у лимба.
Тем временем у пациентов 2-й группы исследования через 1,5 месяца после операции сохранялись повышенные показатели ОСЖ и OSDI: 321±1,0 мОсм/л и 16,5±0,3 балла соответственно, что говорило о вялотекущем воспалительном процессе и высоком риске рецидивирования.
Спустя 1 год после операции у 4 пациентов 2-й группы диагностировано рецидивирование птеригиума, в 1-й группе наблюдения таких пациентов не было.
Принимая во внимание состояние локальной микроциркуляции внутреннего сегмента бульбарной конъюнктивы у пациентов с птеригиумом, а именно неоваскуляризацию, берущую начало в зоне полулунной складки и распространяющуюся по направлению к роговице, представляющую собой своеобразный треугольный клин, мы разработали и внедрили в клиническую практику новую методику амниопластики во внутреннем углу глаза, препятствующую продвижению сосудистой сети по глазной поверхности.
Еще одним положительным нюансом предложенной методики, восстанавливающей барьерные функции лимба и улучшающей эпителизацию роговицы, является закрытие склерального дефекта у лимба конъюнктивой с сохраненными стволовыми клетками, что исключает рецидивирование заболевания [11].
Заключение
Разработанный метод хирургического лечения прогрессирующего птеригиума, заключающийся в создании трансплантационного барьера из амниотической мембраны в зоне изначального роста сосудов и покрытии лимба собственной конъюнктивой со стволовыми клетками, предотвращает рецидивирование заболевания и позитивно влияет на динамику репаративных и воспалительных процессов в послеоперационном периоде.
Библиографическая ссылка
Бочкарева А.Н., Егоров В.В., Смолякова Г.П., Коленко О.В., Банщиков П.А. КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА ПОСЛЕОПЕРАЦИОННОГО ПЕРИОДА ПРИ РАЗЛИЧНОМ АНАТОМО-ТОПОГРАФИЧЕСКОМ ПОДХОДЕ АМНИОПЛАСТИКИ В ХИРУРГИЧЕСКОМ ЛЕЧЕНИИ ПТЕРИГИУМА // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30655 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30655



