Диагностика и лечение низкодифференцированных глиальных опухолей (HGG) остается актуальной проблемой в нейроонкологии. Среди HGG наиболее часто встречаются анапластическая астроцитома (АА) и глиобластома (ГБ), составляя до 85% всех глиальных опухолей и около 65% злокачественных опухолей ЦНС (CBTRUS 2012–2016 г.). Пациенты с ГБ, несмотря на современный комплексный подход к лечению, имеют общую медиану выживаемости 14–16 месяцев, а пятилетний порог преодолевают не более 5% [1]. В последней классификации опухолей ЦНС ВОЗ от 2016 г., помимо гистологических критериев, также отражены и молекулярно-генетические аберрации, наиболее значимыми из которых являются статус мутации в генах IDH1/2, ко-делеция 1p/19q, уровень метилирования промотора MGMT [2].
Так, по результатам ряда исследований, общая медиана выживаемости пациентов с ГБ при стандартизированном подходе к лечению при метилировании промотора MGMT составляет 21 месяц, при отсутствии – 14 месяцев [3], а при его уровне более 10% отмечена большая восприимчивость к темозоломиду [4].
Не менее прогностически значимым является и наличие мутации в генах IDH1/2, которые встречаются в 10% ГБ [4] и независимо от степени злокачественности являются предиктором лучшего ответа на комплексную терапию. Так, в ряде работ отмечено, что пациенты с ГБ при комплексном подходе к лечению и наличии мутации IDH имеют медиану выживаемости 27,1–45,6 месяца, а без мутации – 11,3–15 месяцев [5]. Примечательно, что пациенты с ГБ IDH mt имеют лучший прогноз в сравнении с пациентами с высокодифференцированными глиальными опухолями – LGG IDH wt [5]. На основании наличия данной мутации сформулирована концепция «вторичной глиобластомы», произошедшая от опухолей Gr II–III [4], что подтверждается и их общим транскрипционным профилем [6]. Сочетание мутации в генах IDH1 или IDH2 и метилирования MGMT отмечается в 73% случаев, а при отсутствии мутации метилирование MGMT выявляется в 43% случаев [7, 8].
Агрессивное диффузное распространение опухоли стимулируется и поддерживается формированием микроокружения, способствующего пролиферации опухоли, разрушению внеклеточного матрикса, развитию неоангиогенеза и иммуносупрессии. Возможно, оценка локального содержания цитокинов наряду с гистологическими и молекулярно-генетическими предикторами может оказаться одним из прогностически значимых факторов.
Цель исследования: изучение изменений цитокинового состава в ткани различных гистологических и молекулярно-генетических подтипов глиальных опухолей.
Материалы и методы исследования. В исследовании приняли участие 49 пациентов. В основную группу вошли 34 пациента с впервые выявленной супратенториальной глиальной опухолью: 20 мужчин (средний возраст 52 года) и 14 женщин (средний возраст 54 года). Контрольную группу составили 15 пациентов с впервые выявленной супратенториальной менингиомой, из них 5 мужчин (средний возраст 67 лет) и 10 женщин (средний возраст 59 лет). Критерии включения в исследование: возраст старше 18 лет, впервые выявленная опухоль ЦНС, отсутствие курсов лучевой терапии и химиотерапии в предоперационном периоде. От всех пациентов получено добровольное согласие на участие в исследовании. На проведение исследования получено разрешение этического комитета института.
Всем пациентам выполнена операция – субтотальное удаление опухоли с применением микронейрохирургической техники, флюоресцентной навигации. В зависимости от локализации опухоли и функционально значимых зон головного мозга применялся нейрофизиологический мониторинг. Во время операции у пациентов основной группы проводился забор опухолевой ткани, а у пациентов контрольной группы – прилежащего к менингиоме неизмененного мозгового вещества в функционально незначимой зоне. В послеоперационном периоде у пациентов с менингиомами нарастания неврологического дефицита не отмечено.
Образцы опухолевой ткани и мозгового вещества подвергали механическому дроблению с последующим помещением полученного материала в одноразовый механический дезагрегатор (Medicon, USA) с разделенными экранами на 35 мкм, 50 мкм. Далее добавляли 2 мл промывочного раствора для клеток (Cellwash) с последующим помещением в дезинтегратор ткани BD Medimachine (США) и гомогенизацией в течение 30–60 с. Полученные гомогенизированные ткани центрифугировали на скорости 1500 об/мин в течение 4 мин. В супернатанте с помощью ИФА с применением тест-систем «Вектор-Бест» (Новосибирск, Россия) рассчитывали концентрацию следующих цитокинов: ФНО-α, ИЛ-1ß, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИФН-α, ИФН-γ. Количественную оценку полученных результатов проводили на анализаторе иммуноферментных реакций АИФР-01 (УНИПЛАН, Россия). Результаты выражали в виде удельного содержания – в пересчете на 1 г белка гомогената, оцениваемого биуретовым методом (пг/мл/г белка), с использованием наборов «Общий белок Ольвекс» («Ольвекс-диагностикум», Россия) в соответствии с инструкцией фирмы-производителя. Результаты реакции оценивали на полуавтоматическом биохимическом анализаторе BS-3000Р (Sinnowa Medical Science & Technology Co., КНР).
Гистологическое подтверждение опухоли осуществляли методом микроскопии в соответствии с патоморфологической классификацией опухолей ЦНС ВОЗ 2016 [2]. Иммуногистохимическое (ИГХ) исследование проводили с использованием стейнера BenchMark ULTRA Ventana с применением соответствующих антител.
Для выявления молекулярно-генетических аберраций тотальную ДНК из ткани глиальной опухоли выделяли методом фенол-хлороформной экстракции. Для определения уровня метилирования промотора MGMT проводили бисульфитную конверсию ДНК. Количественное метилирование CpG сайтов промотора оценивали методом пиросеквенирования с применением системы генетического анализа PyroMark Q24 (Qiagen, Germany) в соответствии с рекомендациями производителя. Мутантный статус генов IDH1/2 определяли методом RT-PCR с использованием набора IDH1/2 RGQ PCR Kit (Qiagen, германия) и прибора Rotor-Gene Q (Qiagen, Германия).
Статистическую обработку полученных результатов осуществляли с помощью программы STATISTICA 13 (StatSoftInc., США). Учитывая ненормальное распределение полученных данных, результаты представили в виде медианы (Me) и интерквартильного размаха – 25-го и 75-го процентилей (Ме [LQ; UQ]). Достоверность отличий между выборками определяли с использованием непараметрического критерия Манна–Уитни и считали значимой при p<0,05.
Результаты исследования и их обсуждение. Среди 34 пациентов с глиальными опухолями у 4 при гистологическом и ИГХ анализах верифицирована диффузная астроцитома Gr II (11,8%), у 4 – АА Gr III (11,8%) и у 26 – ГБ Gr IV (76,4%). У 15 пациентов с менингиомой верифицированы различные гистологические варианты Gr I.
При анализе содержания цитокинов в супернатанте высокодифференцированных глиальных опухолей и неизмененного мозгового вещества статистически значимых отличий не выявлено. Отсутствие изменений в локальном цитокиновом микроокружении, по всей вероятности, может свидетельствовать о «невидимости» опухоли для иммунной системы, посредством чего создаются благоприятные условия для дальнейшего роста и малигнизации. В то же время при формировании HGG имеются статистически достоверные отличия в содержании ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ФНО-α в сравнении с неизмененным мозговым веществом, указывающие на разнонаправленное изменение секреции провоспалительных цитокинов и пониженную секрецию противовоспалительных в ткани HGG (табл.). Изменения содержания ИЛ-1β, ИФН-α, ИФН-γ статистически недостоверны.
Цитокиновый состав супернатанта низкодифференцированных глиальных опухолей и неизмененного мозгового вещества, Ме [LQ; UQ]
|
Образцы тканей |
Ил-2 (пг/мл/г белка) |
Ил-4 (пг/мл/г белка) |
Ил-6 (пг/мл/г белка) |
Ил-8 (пг/мл/г белка) |
Ил-10 (пг/мл/г белка) |
ФНО-α (пг/мл/г белка) |
|
HGG n=30 |
8,1 (6,1; 12,4) |
0,8 (0,4; 1,5) |
27,6 (2,5; 51,6) |
71,1 (31,7; 122,8) |
2,7 (1,8; 3,9) |
2,9 (2,2; 5,0) |
|
Неизмененное мозговое вещество n=15 |
30,2 (20,4; 49,5) |
3,0 (2,1; 7,4) |
0 (0; 1,5) |
1,6 (0,7; 3,7) |
7,6 (3,9; 8,7) |
6,3 (4,9; 9) |
|
P |
0,0005 |
0,004 |
0,0003 |
0,00005 |
0,018 |
0,0035 |
Статистически достоверных отличий в содержании цитокинов у пациентов с АА и ГБ независимо от молекулярно-генетических особенностей не выявлено.
При изучении статуса мутации в генах IDH1/2 у пациентов с HGG (n=30) выявлено 3 (10%) с мутацией в гене IDH1 и 27 (90%) без мутации. При изучении цитокинового состава супернатанта данных двух групп, несмотря на малочисленность пациентов с мутацией, выявлены статистически достоверные отличия в содержании ИЛ-4, ИЛ-6, ИЛ-8. У больных с наличием мутации в гене IDH1 тканевой уровень ИЛ-4 был в 32 раза выше, чем у больных без мутации: 25,3 (13,1; 28,2) против 0,8 (0,4; 1,3). При этом уровни ИЛ-6 и ИЛ-8, напротив, были ниже: ИЛ-6 в 33 раз: 0 (0; 8,2) против 33,0 (4,4; 54,1); ИЛ-8 в 249 раз: 0,35 (0,3; 19,6) против 87,3 (37,3; 125,2) (рис. 1). В литературе имеются лишь сообщения о повышении содержания ИЛ-6 в ГБ IDH wt. [9]. Таким образом, комплексная оценка содержания ИЛ-4; ИЛ-6; ИЛ-8 в опухолевой ткани HGG может являться важным прогностическим критерием чувствительности к комплексному лечению.
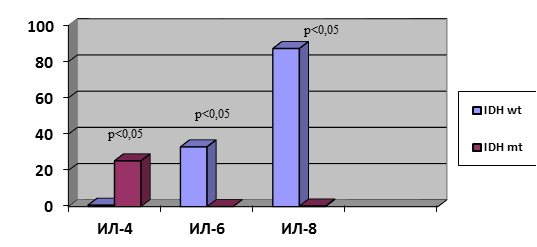
Рис. 1. Содержание ИЛ-4, ИЛ-6, ИЛ-8 в HGG в зависимости от статуса мутации гена IDH. Ось Y – пг/мл/г
Наряду с определением статуса мутации генов IDH1/2 не менее важным является определение уровня метилирования промотора MGMT. При анализе литературы остается дискутабельным вопрос определения порога чувствительности к терапии алкилирующими препаратами, который варьирует в интервале 9–12,5%. Большинство авторов порогом чувствительности считают уровень в 10% [10], который нами и был использован. В группе пациентов с HGG метилирование промотора MGMT выполнено 30 пациентам, при этом у 9 пациентов (30%) выявлен уровень метилирования ≤10% и у 21 пациента (70%) более 10%.
При анализе содержания цитокинов нами обнаружено статистически достоверное отличие в содержании ИЛ-1β. Так, в опухолях с низким уровнем метилирования MGMT медиана значений ИЛ-1β составила 2,8 (2,0; 5,0) против 5,1 (3,9; 12,1) при высоком уровне данного показателя (рис. 2).
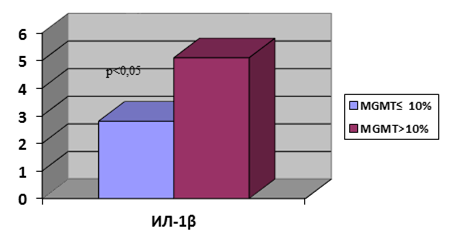
Рис. 2. Содержание ИЛ-1β в зависимости от уровня метилирования промотора MGMT. Ось Y – пг/мл/г
Таким образом, оценка содержания уровня ИЛ-1β в ткани HGG наряду с уровнем метелирования промотора MGMT также может служить критерием чувствительности к химиотерапии алкилирующими препаратами.
Несмотря на многочисленные исследования генетических, метаболических, иммунологических особенностей HGG в зависимости от статуса мутации генов IDH1/2 и метилирования MGMT, ведущий фактор таких отличий остается неясным. Опубликованные данные об иммунологическом микроокружении IDH mt и IDH wt свидетельствуют о том, что оно модулируется 2-гидроксиглутаратом (2-HG), присутствующим внеклеточно в IDH mt глиомах, по-видимому, с помощью прямых (проникновение 2-HG в Т-клетки с нарушением их функции) и непрямых (снижение экспрессии хемокинов, привлекающих Т-клетки) механизмов [11]. В HGG без мутации в генах IDH1/2 содержится больше TILs и наблюдается более высокая экспрессия PD-L1, что, казалось бы, противоречит их менее благоприятному клиническому течению [12].
Высказываются предположения о возможной роли других иммунокомпетентных клеток (миелоидного и макрофагального ряда), которые являются продуцентами различных биологически активных веществ, таких как цитокины, хотя и сами глиальные клетки, являясь аналогами макрофагов, способны к их продукции.
В последнее время большое внимание уделяется регуляторной функции ИЛ-4, содержащегося в ткани мозга, где он, взаимодействуя с рецепторами и изменяя активность различных сигнальных путей, модулирует активность других цитокинов, играет значительную роль при различной патологии ЦНС, в том числе при глиомах. В литературе упоминаются такие проявления его активности, как угнетение неоангиогенеза и поляризации макрофагов из М1 в М2, стимуляция экспрессии на клетках микроглии рецептора дендритных клеток CD11c и МНС II, ингибирование роста ксенографта глиомы, и, хотя эти эффекты показаны на клеточных и экспериментальных моделях, они свидетельствуют о его противоопухолевых свойствах [13]. Значительно более высокие тканевые уровни ИЛ-4 при глиомах IDH mt по сравнению с IDH wt, видимо, говорят о более высокой сохранности опосредуемых этим цитокином иммунных и неиммунных функций микроокружения.
Научный и клинический интерес к гену MGMT возник в связи с развитием химиотерапии препаратами алкилирующей группы. Темозоломид способствует соединению алкилирующей группы с тимином и гуанином, тем самым вызывая повреждение ДНК опухолевой клетки, инициируя апоптоз [14]. Ген MGMT кодирует фермент MGMT (О6-метилгуанин-ДНК-метилтрансфераза), основная функция которого сводится к репарации поврежденной ДНК. Таким образом, наличие метилирования гена MGMT (или низкий уровень его экспрессии в опухолевых клетках) приводит к снижению активности фермента и закономерному снижению репарационных процессов, что и является основой эффективности терапии алкилирующими агентами и увеличивает медиану выживаемости пациентов [3, 4].
Полученные нами данные о цитокиновом составе HGG в зависимости от уровня метилирования промотора MGMT свидетельствуют о роли ИЛ-1β. Поскольку высокая экспрессия MGMT связана с резистентностью клеток глиомы к темозоломиду, а ее снижение способствует повышению чувствительности к нему, как показано в опытах in vitro и in vivo [15], описанный нами локальный состав цитокинов может рассматриваться как один из механизмов формирования химиорезистентности HGG.
Заключение. Итак, несмотря на относительно небольшие когорты обследованных нами пациентов, были получены убедительные различия локального цитокинового состава неизмененного мозгового вещества и ткани HGG, а также различных молекулярно-генетических подтипов последних. При отсутствии возможности определения молекулярно-генетических особенностей опухоли определение локального цитокинового состава может являться предиктором течения низкодифференцированных глиальных опухолей и чувствительности к химиотерапии темозоломидом. HGG с наличием мутации в гене IDH1 и обладающие лучшим клиническим ответом на комплексное лечение характеризуются повышенным содержанием ИЛ-4 и пониженным – ИЛ-6, ИЛ-8, а определение уровня ИЛ-1β в ткани опухоли может служить критерием определения схемы химиотерапии в послеоперационном периоде. Так, повышение данного интерлейкина сочетается с уровнем метилирования промотора MGMT >10% и предполагает лучшую чувствительность к темозоломиду.
Перечень сокращений
CBTRUS – Central Brain Tumor Register of the United States of America
HGG – high grade glioma
IDH – isocitrate dehydrogenase
mt – mutant type
TIL – tumor-infiltraining lymphocytes
wt – wild type
АА – анапластическая астроцитома
ГБ – глиобластома
ИЛ (IL) – интерлейкин
ИНФ – интерферон
ФНО – фактор некроза опухоли
Библиографическая ссылка
Златник Е.Ю., Игнатов С.Н., Сагакянц А.Б., Солдаткина Н.В., Росторгуев Э.Е., Енгибарян М.А., Шульгина О.Г., Пушкин А.А., Пандова О.В. ПРЕДИКТОРНАЯ РОЛЬ ЛОКАЛЬНОГО УРОВНЯ ЦИТОКИНОВ В ТЕЧЕНИИ НИЗКОДИФФЕРЕНЦИРОВАННЫХ ГЛИАЛЬНЫХ ОПУХОЛЕЙ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30645 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30645



