Высокая аффинность свинца ко многим процессам в нашем организме известна уже давно. Так, выраженное влияние в связи с высокой степенью аккумуляции свинец оказывает на почки и костную ткань [1–3], как нарушая нормальный метаболизм кальция и других микро- и макроэлементов посредством изменения регуляторных гормонов (1,25-dihydroxyvitamin D3) и чувствительности костных клеток к ним, а, следовательно, нарушения образования кальций-связывающих протеинов (остеокальцина), так и вызывая активацию перекисного окисления липидов с последующим повреждающим действием [4]. Также свинец способен нарушать синтез компонентов костного матрикса, коллагена и сиалопротеинов (остеопонтина), необходимых для нормального развития не только костной ткани, но и структур головного мозга [5]. И, наконец, этот тяжелый металл может замещать или смещать кальций из активных зон как кальциевых, так и кальций-зависимых транспортных систем, что приводит к нарушению и многих других функций и механизмов физиологической регуляции [6].
Цинк известен как фактор, участвующий в регуляции роста и развитии тканей организма, и регулятор иммунного ответа, что было доказано повышением при его участии концентрации белка остеокальцина, экспрессии гена COL1A1 и активности щелочной фосфатазы. Остеопротективная роль цинка складывается из ряда факторов. Так, цинк активирует остеобласты и стимулирует синтез коллагена, однако цинк подавляет активность остеокластов [7]. Доказана способность цинка снижать негативные эффекты ряда токсичных элементов, таких как кадмий, свинец и другие тяжелые металлы [8, 9], выполнять протективную роль при воспалении [10], стабилизируя мембраны тучных клеток. В то же время ряд работ указывает и на негативную роль высоких концентраций цинка в метаболизме ряда катионов, в частности кальция [11], что способствует формированию камней в почках [12].
Несмотря на тесную взаимосвязь токсических эффектов свинца и обмена кальция, а также неоднозначную роль цинка в кальциевом метаболизме, в литературе нет достаточного количества данных о влиянии этих металлов на распределение фракций кальция в плазме крови. В связи с этим целью данной работы было исследование влияния физиологической дозировки хлорида цинка изолированно и в сочетании с введением ацетата свинца на водовыделительную функцию почек и показатели метаболизма кальция.
Материалы и методы исследования
Исследования проводились на 60 крысах-самцах линии Вистар массой 200–300 г, разделенных на 4 группы: 1-я группа – интактные животные (фон, n=15); 2-я группа – контрольные животные с внутрижелудочным введением хлорида цинка (Zn, n=15) в дозировке 1 мг/кг массы тела (в пересчете на металл) в течение 30 дней ежедневно 1 раз в сутки (принимая во внимание нормальное суточное потребление человеком от 7,2 до 15 мг цинка, эту дозировку мы считали физиологической); 3-я группа – контрольные животные с внутрижелудочным введением ацетата свинца (Pb, n=15) в дозировке 40 мг/кг массы тела (в пересчете на металл) в течение 30 дней ежедневно 1 раз в сутки; 4-я группа – опытные животные с сочетанным внутрижелудочным введением последовательно сначала хлорида цинка, а затем ацетата свинца (Zn+Pb, n=15) в тех же дозировках в течение 30 дней 1 раз в сутки.
Для исследования функций почек животных помещали в обменные клетки на 6 ч. В условиях спонтанного диуреза определяли объем диуреза, скорость клубочковой фильтрации по клиренсу эндогенного креатинина, рассчитывали относительную канальцевую реабсорбцию воды. Определяли: концентрацию белка (по методу Лоури), креатинина и общего кальция (Ca) в биологических жидкостях (моче и плазме крови) с помощью спектрофотометра (Apel PD-303); концентрацию натрия и калия – методом пламенной фотометрии (ФПА-2); концентрацию ионизированного кальция (Ca2+) на анализаторе АЭК-01 (Кверти-Мед) с последующим расчетом его процента от общего кальция плазмы крови и доли белоксвязанной фракции (абсолютные значения и %). Статистическую обработку результатов исследования, учитывая нормальное распределение рядов сравнения, проводили с применением t-критерия Стьюдента с использованием программы GraphPad Prizm 6.1. О наличии значимых различий и факторных влияний судили при критическом уровне значимости p, меньшем 0,05. Также проводили расчет ранговой корреляции Пирсона (r). В проведении экспериментов руководствовались статьей 11 Хельсинской декларации Всемирной медицинской ассоциации (1964), «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1985) и Правилами лабораторной практики в Российской Федерации (приказ МЗ РФ от 19.06.2003 г. № 267).
Результаты исследования и их обсуждение
Введение хлорида цинка через зонд в желудок в течение 1 месяца привело (рис. 1) к незначительным изменениям в водовыделительной функции почек. Введение же ацетата свинца вызвало изменение всех показателей водовыделительной функции (рис. 1): практически двукратное увеличение диуреза относительно интактных животных (на 92%; р<0,001) вследствие значительного снижения канальцевой реабсорбции воды (р<0,001), несмотря на статистически значимое снижение скорости клубочковой фильтрации (р<0,001). Такое действие связывают с прямым повреждающим воздействием тяжелого металла на эпителий, преимущественно проксимальных канальцев, путем активации процессов перекисного окисления липидов и конкурентного нарушения работы кальциевых транспортных механизмов [2].
Экспозиция ацетата свинца на фоне хлорида цинка привела к менее выраженным изменениям водовыделительной функции почек (рис. 1): увеличению диуреза относительно интактных животных на 50% (р<0,001); снижению канальцевой реабсорбции на 0,37% (р<0,01); при этом скорость клубочковой фильтрации также была снижена относительно фона (р<0,001) и не отличалась статистически значимо от таковой у животных с изолированным введением ацетата свинца. Можно отметить некоторое протекторное действие соли цинка на токсическое поражение канальцев нефронов, что проявляется в меньшем (на 0,33%) снижении канальцевой реабсорбции воды, существенно отличающемся от такового у животных с изолированным введением свинца (р<0,001).
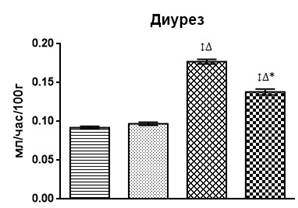
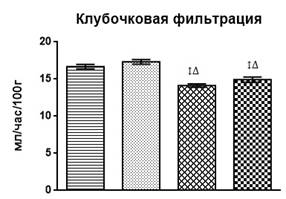
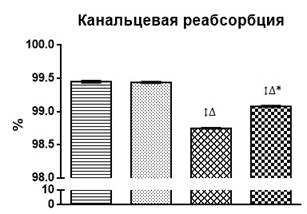

Рис. 1. Изменение водовыделительной функции почек и протеинурии на фоне изолированного и комбинированного введения хлорида цинка и ацетата свинца
↕ – статистически значимое отличие от фона; ∆ – статистически значимое отличие от опыта с введением хлорида цинка; * – статистически значимое отличие от опыта с введением ацетата свинца.
Протеинурия (рис. 1) как показатель повреждения нефронов на уровне и гломерулярного фильтра, и канальцевого аппарата была отмечена у групп животных с введением ацетата свинца. При изолированном введении соединения свинца экскреция белка увеличилась более чем в 11 раз (р<0,001), а при введении свинца на фоне хлорида цинка – в 7 раз (р<0,001) относительно фоновых значений. Протеинурия при сочетанном введении металлов достоверно отличается от значений в группе с изолированным введением свинца (р<0,001). Таким образом, здесь также можно отметить нефропротекторный эффект физиологической дозировки цинка.
В почечной обработке кальция также отмечались изменения, связанные с воздействием тяжелых металлов. Так, введение хлорида цинка (рис. 2) привело лишь к небольшому увеличению экскреции кальция (р<0,05) за счет незначительного снижения его канальцевой реабсорбции (р<0,01). Изолированное введение ацетата свинца вызвало повышение экскреции кальция на 51% (р<0,001) за счет значительного снижения канальцевой реабсорбции катиона (на 0,67%, р<0,001) на фоне выраженного снижения его фильтрационного заряда (р<0,001). Сочетанное введение солей металлов привело к аналогичным изменениям почечной обработки кальция – повышению его экскреции (р<0,05), снижению фильтрационного заряда (р<0,01) и канальцевой реабсорбции (р<0,01), однако эти сдвиги были значительно менее выраженными по сравнению с показателями при изолированной свинцовой интоксикации.
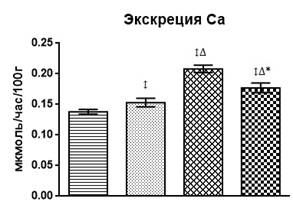
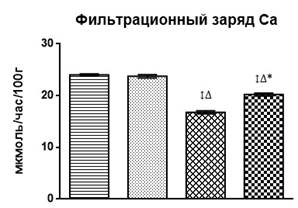
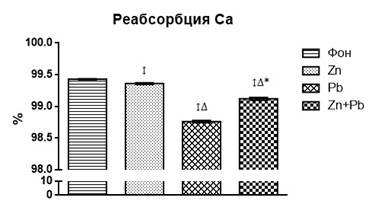
Рис. 2. Изменение метаболизма кальция на фоне изолированного и комбинированного введения хлорида цинка и ацетата свинца
↕ – статистически значимое отличие от фона; ∆ – статистически значимое отличие от опыта с введением хлорида цинка; * – статистически значимое отличие от опыта с введением ацетата свинца.
Введение цинка и свинца отразилось на содержании кальция и его различных фракций в плазме крови (табл.). Концентрации общего Ca (1,826±0,017; р<0,001) и ионизированного (Ca2+; р<0,001) оказались самыми минимальными у крыс с изолированным введением ацетата свинца. У животных с изолированным введением цинка и в сочетании со свинцовой интоксикацией снижение общего Ca в плазме крови было ниже фоновых значений (2,108±0,021; 2,082±0,019 соответственно; р<0,02). В группе животных Zn+Pb уровни общего Са (р<0,01) и ионизированного Ca2+ (р<0,01) были выше такового у крыс с изолированным введением свинца. Таким образом, в группе с сочетанным введением цинка со свинцом было выявлено сниженное содержание общего и ионизированного кальция, однако значения этих показателей все же были выше, чем у животных с введением только свинца, что позволяет предположить определенный протекторный эффект цинка.
Влияние изолированного и сочетанного введения хлорида цинка и ацетата свинца на содержание и процентное соотношение фракций кальция и общего белка в плазме крови
|
Показатель |
Статистические показатели |
Группы животных |
|||
|
Фон |
Zn |
Pb |
Zn+Pb |
||
|
Общий Ca в плазме крови, ммоль/л |
М±m |
2,214±0,013 |
2,108±0,021 |
1,826±0,017 |
2,082±0,019 |
|
р |
↕ |
↕∆ |
↕* |
||
|
Ca2+ плазмы, ммоль/л, % |
М±m |
0,924±0,008 41,7% |
0,902±0,004 42,7% |
0,812±0,011 44,4% |
0,889±0,009 42,4% |
|
р |
↕ |
↕∆ |
↕∆* |
||
|
Белоксвязанный Ca, ммоль/л, % |
М±m |
1,29±0,017 58,2% |
1,206±0,012 57,2% |
1,014±0,005 55,5% |
1,193±0,007 57,3% |
|
р |
↕ |
↕∆ |
↕* |
||
|
Общий белок, г/л |
М±m |
65,54±0,53 |
69,63±1,15 |
60,9±1,09 |
63,93±0,84 |
|
р |
↕ |
↕∆ |
↕* |
||
↕ – статистически значимое отличие от фона; ∆ – статистически значимое отличие от опыта с введением хлорида цинка; * – статистически значимое отличие от опыта с введением ацетата свинца.
Исследование концентрации общего белка плазмы крови (табл.) позволило отметить небольшое увеличение его у животных с введением хлорида цинка (р<0,001), что, возможно, связано с компенсаторным увеличением цинк-транспортирующих белков – металлотионеинов [10], синтез которых стимулируется в ответ на увеличение всасывания металла в кишечнике, либо со стимулирующим эффектом цинка на процессы синтеза белка. Напротив, у животных с введением ацетата свинца концентрация общего белка плазмы крови была снижена (р<0,001), что согласуется с данными литературы [13]. Возможно, этот эффект обусловлен гепатотоксическим эффектом тяжелого металла, а также отмеченной ранее потерей белка с мочой. Введение цинка одновременно со свинцом привело к практическому нивелированию снижения белка в крови (р<0,2).
Заключение
В работе была подтверждена способность свинца изменять метаболизм кальция, что связано как с нарушением работы почек, так и с резорбцией костной ткани. Анализ изменения плазменных фракций кальция позволяет связать их с этими эффектами. Так, снижение через 1 месяц после начала введения металлов уровня общего кальция в плазме крови на фоне свинцовой интоксикации имеет корреляционные связи как с увеличением диуреза (r=0,63), так и со снижением канальцевой реабсорбции воды (r=0,74). Также прослеживается тесная корреляционная связь сниженных уровней общего кальция и его белоксвязанной фракции с выраженной протеинурией (r=0,68 и r=0,73 соответственно) и пониженной концентрацией общего белка плазмы (r=0,63 и r=0,65 соответственно). Эти данные указывают на возможный почечный генез гипокальциемии при свинцовой интоксикации. Увеличение процентной доли ионизированного кальция (табл.) на фоне постоянных потерь катиона с мочой может свидетельствовать о пополнении этой фракции за счет выхода кальция из резорбируемой костной ткани и конкурентного вытеснения катиона из сайтов связывания в клетках ионами тяжелого металла [4].
Причины незначительного снижения уровня общего кальция у крыс с изолированным введением цинка несколько иные. Так, не отмечается корреляционных связей с повышением диуреза и протеинурией. Отмечена связь с небольшим повышением экскреции катиона с мочой (r=0,59) за счет такого же незначительного снижения его реабсорбции, возможно, связанного с конкурирующим транспортом цинка на уровне эпителия канальцев. При этом процентное соотношение фракций ионизированного и белоксвязанного кальция (табл.) едва отличается от фоновых значений, что может говорить о сохранности механизмов регуляции гомеостазиса этого элемента на фоне физиологической нагрузки цинком.
Активное участие цинка в кальциевом метаболизме проявилось в относительной нормализации уровня общего кальция плазмы крови и выравнивании соотношения фракций ионизированного и белоксвязанного кальция с показателями интактных животных (табл.). Нормализующий эффект цинка в большей степени затрагивает ионизированную форму кальция (Pb=44,4%; Zn+Pb=42,4%), что, возможно, является следствием способности цинка конкурировать со свинцом за транспортные механизмы и снижать накопление свинца и вытеснение кальция из сайтов связывания катиона в костной ткани и в других клетках организма [14]. Протекторные эффекты цинка при отравлении соединениями свинца требуют дальнейшего изучения их взаимодействий на уровне клеток различных тканей, а также механизмов регулирования кальциевого гомеостазиса.
Библиографическая ссылка
Кокаев Р.И., Брин В.Б. ЭФФЕКТЫ ФИЗИОЛОГИЧЕСКОЙ ДОЗИРОВКИ ЦИНКА НА ФУНКЦИИ ПОЧЕК И МЕТАБОЛИЗМ КАЛЬЦИЯ В УСЛОВИЯХ СВИНЦОВОЙ ИНТОКСИКАЦИИ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30633 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30633



