Кросслинкинг роговичного коллагена является одной из эффективных методик стабилизации кератэктатического процесса при кератоконусе [1, 2]. Безопасное проведение ультрафиолетового (УФ) кросслинкинга по стандартному протоколу возможно только на роговицах, пахиметрия которых превышает 400 мкм [3–5].
В 2019 г. в Калужском филиале МНТК «Микрохирургия глаза» была предложена новая методика акселерированного кросслинкинга с применением защитного лоскута донорской роговицы, которая позволяет осуществлять УФ-облучение роговицы с толщиной менее 400 мкм. Эффективность и безопасность данной методики сопоставимы со стандартным протоколом акселерированного кросслинкинга [6]. Предложенная методика базируется на использовании передних слоев донорской роговицы, которые остаются после проведения эндотелиальной кератоплатики (Fs DSEK, DMEK). Рациональный подход к использованию донорской роговицы позволяет найти применение тканям, ранее подлежащим утилизации. Защитный лоскут донорской роговицы необходимой толщины формируется для восполнения дефицита толщины роговичной ткани пациента при помощи фемтосекундного лазера.
Для обеспечения безопасности кросслинкинга проведение пахиметрии с определением наитончайшей зоны роговицы пациента играет важную роль. Как правило, в ходе кросслинкинга толщину роговицы пациента до УФ-облучения измеряют при помощи ультразвуковых (УЗ) биометров [6, 7]. Однако, поскольку при кератоконусе толщина роговицы в области эктазии может иметь значительные перепады, определение тончайшей зоны при помощи УЗ-биометрии представляется затруднительным и может быть сопряжено с высокой вероятностью получения ошибочных данных.
Поскольку полученные данные толщины роговицы используются для расчета толщины защитного лоскута донорской роговицы, корректность данных пахиметрии будет определять эффективность и безопасность предлагаемой методики акселерированного кросслинкинга с применением защитного лоскута донорской роговицы. Завышение показателей тончайшей зоны роговицы приведет к выкраиванию защитного лоскута меньшей толщины, что может способствовать повреждению эндотелия роговицы пациента в ходе УФ-облучения. Занижение показателей пахиметрии в тончайшей зоне приведет к выкраиванию защитного лоскута большей толщины, что, в свою очередь, может вызвать снижение эффективности методики.
На сегодняшний день наиболее точным методом исследования для определения минимальной толщины роговицы при кератоконусе в рамках предоперационной диагностики является оптическая когерентная томография (ОКТ) переднего отрезка глаза [8, 9]. Благодаря появлению интраоперационной ОКТ в клинической практике стало возможно экстраполировать данные предоперационной диагностики в операционную и с высокой точностью отслеживать динамику изменений пахиметрии на этапе насыщения роговицы декстралинком и в ходе облучения при проведении УФ-кросслинкинга.
Применение интраоперационной ОКТ в офтальмохирургии – это инновационная технология, которая получает все большее распространение. Первые микроскопы с встроенным ОКТ-модулем появились в 2013 г. [10, 11]. Система интраоперационной ОКТ-визуализации помогает хирургу в режиме реального времени через окуляры микроскопа визуализировать проекцию топографической картины ультратонких структур глаза [12–15].
В нашей клинике используется операционный микроскоп Hi-R NEO 900A N/R (Haag-Streit Surgical, Германия) с интегрированным оптическим когерентным томографом iOCT 3-го поколения. Данный прибор обладает следующими характеристиками: 10 000 А-сканов в секунду, разрешение 10 мкм, оптика – апохроматическая (прозрачная для ИК), рабочее расстояние – 175 или 200 мм, угол наклона головки окуляров – 200°, стереобаза – 25 мм. Данная система позволяет визуализировать ОКТ-сканы как в окулярах микроскопа хирурга, так и на мониторе микроскопа, производить линейные измерения на мониторе микроскопа, а также осуществлять запись операции (рис. 1).

Рис. 1. Операционный микроскоп Hi-R NEO 900A N/R (Haag-Streit Surgical, Германия) с интегрированным оптическим когерентным томографом iOCT 3-го поколения
Цель данного исследования определило наличие возможности прецизионной интраоперационной оценки пахиметрических показателей роговицы пациента в ходе предложенной методики УФ-кросслинкинга.
Цель исследования – провести сравнительный анализ динамики пахиметрии роговицы пациента в ходе акселерированного кросслинкинга при исходной толщине роговицы менее 400 мкм с использованием операционного микроскопа с интегрированным оптическим когерентным томографом и УЗ-биометра TOMEY A 3000 (Tomey, Япония).
Материал и методы исследования
Исследование проведено на 20 глазах 20 пациентов с диагнозом «кератоконус» (13 мужчин, 7 женщин), из них со 2-й стадией заболевания – 16 пациентов, с 3-й стадией – 4 пациента, которым был проведен акселерированный кросслинкинг с использованием защитного лоскута донорской роговицы.
До и после операции в сроки 1, 3 и 6 месяцев проводились следующие исследования: визометрия, авторефрактометрия, тонометрия, кератотопография, кератопахиметрия, подсчет плотности эндотелиальных клеток (ПЭК), оптическая когерентная томография переднего отрезка глаза. Плотность эндотелиальных клеток измерялась на приборе TOMEY SP 3000 (Япония). Кератотопография проводилась на приборе Pentacam HR (Oculus, Германия), кератопахиметрия с определением локализации тончайшей зоны – на приборе ОКТ-RTVue XR Avanti (Optovue, США).
Интраоперационные измерения пахиметрии проводились с использованием операционного микроскопа с интегрированным оптическим когерентным томографом 3-го поколения и УЗ-биометра сразу после деэпителизации роговицы, через 5, 10, 15 и 30 мин после закапывания декстралинка. Также выполнялась оценка данных пахиметрии сразу после наложения защитного лоскута донорской роговицы на роговицу пациента и по окончании процедуры облучения УФ. Помимо этого, при помощи iОСТ модуля измерялась толщина самого защитного лоскута донорской роговицы сразу после аппланации его на роговицу пациента и после проведения УФ-облучения.
Акселерированный кросслинкинг выполнялся на приборе UV-X 2000 (IROC, Швейцария).
Защитный лоскут роговицы формировали при помощи фемтосекундного лазера Femto LDV Z8 (Ziemer, Швейцария) из остаточной стромы донорской роговицы после проведения различных видов эндотелиальной кератопластики (задней послойной фемтокератопластики, трансплантации десцеметовой мембраны).
Методика операции. Деэпителизация роговицы выполнялась одноразовым скарификатором в 7–9-миллиметровой зоне. Далее, с применением интраоперационной ОКТ, выявлялась зона роговицы с минимальной толщиной. Затем в течение 30 мин проводилось насыщение роговицы раствором рибофлавина на декстрановой основе (декстралинк) путем инстилляций с интервалом 1 мин. Через 5, 10, 15 и 30 мин после начала инстилляций декстралинка проводились повторные измерения толщины роговицы в тончайшей зоне. Измерения проводились двумя методами: с использованием интраоперационной ОКТ и с применением УЗ-биометра. После окончания насыщения роговицы раствором декстралинка рассчитывали необходимую толщину защитного лоскута донорской роговицы. Толщина формируемого защитного лоскута определялась как разница между толщиной роговицы пациента в тончайшей зоне после 30 мин насыщения декстралинком и толщиной в 450 мкм, требуемой для безопасного проведения УФ-облучения. Для расчета толщины защитного лоскута донорской роговицы использовали данные, полученные при помощи интраоперационной ОКТ. Диаметр защитного лоскута составлял 9,4 мм. Сформированный защитный лоскут позиционировали на поверхности роговицы пациента, после чего оценивали толщину комплекса «защитный лоскут + собственная роговица пациента». Измерения проводили при помощи интраоперационной ОКТ и УЗ-биометра. Кроме этого, интраоперационная ОКТ позволяла оценить степень адгезии защитного лоскута к роговице пациента. Во всех случаях отмечалась интимная адаптация защитного лоскута к роговице пациента на всей площади. УФ-облучение осуществляли в течение 10 мин световым пятном 9,0 мм. В ходе УФ-облучения на поверхность защитного лоскута роговицы инсталлировали раствор декстралинка каждые 2 мин. После окончания УФ-облучения проводили финальное измерение толщины роговицы пациента и защитного лоскута донорской роговицы при помощи интраоперационной ОКТ для верификации безопасности проведенной процедуры. Операция заканчивалась инстилляцией антисептика витабакт. На роговицу накладывали мягкую лечебную контактную линзу на 3–5 дней до наступления полной эпителизации.
Статистическая обработка результатов работы проводилась с использованием программы Statistica 13.3 («Tibco Software Inc.», США). Для характеристики количественных данных использовались среднее значение (М) и стандартное отклонение (STD).
Результаты исследования и их обсуждение
Предоперационная диагностика показала следующие результаты: некорригированная острота зрения (НКОЗ) определялась на уровне 0,14±0,15; корригированная острота зрения (КОЗ) – 0,45±0,15; ВГД – 14,5±2,8 мм рт. ст.; пахиметрия в центре – 401±20 мкм, на вершине конуса – 390±30 мкм; ПЭК – 2438±110 кл/мм². Кератотопография демонстрировала характерные изменения роговицы, соответствующие кератоконусу. Анализ элевационных карт показал, что элевация передней поверхности была на уровне 38±5 мкм, задней поверхности – 57±7 мкм, средняя кератометрия – 56±2,5 дптр.
Интраоперационная пахиметрия в ходе насыщения роговицы раствором декстралинка показала, что максимальное снижение толщины роговицы пациента отмечалось в течение первых 15 мин закапывания декстралинка и составило в среднем 55±23 мкм (17%) по данным интраоперационной ОКТ и 39±27 мкм по данным УЗ-биометра. После окончания насыщения роговицы раствором декстралинка (через 30 мин) толщина роговицы уменьшалась в среднем на 66±15 мкм (21%) по данным интраоперационной ОКТ и на 46±24 мкм по данным УЗ-биометра относительно исходной толщины роговицы после деэпителизации (до инстилляций декстралинка). Исходя из данных пахиметрии (iOCT) в тончайшей зоне по окончании насыщения декстралинком рассчитывали толщину защитного лоскута донорской роговицы таким образом, чтобы данные пахиметрии комплекса «роговица пациента + защитный лоскут донорской роговицы» составили 450 мкм.
После аппланации защитного лоскута донорской роговицы на поверхность роговицы пациента пахиметрия полученного комплекса «роговица пациента + защитный лоскут донорской роговицы» в тончайшей зоне составила в среднем 499±15 мм по данным iOCT и 484±37 мкм по данным УЗ-биометра. После проведения процедуры акселерированного кросслинкинга пахиметрия комплекса «роговица пациента + защитный лоскут донорской роговицы» в тончайшей зоне снизилась в среднем на 23±5 мкм, при этом снижение значений пахиметрии защитного лоскута донорской роговицы определялось на уровне 52±9 мкм (25%), в то время как пахиметрия роговицы пациента увеличивалась на 58±5 мкм (18%) относительно толщины до проведения УФ-облучения, что, на наш взгляд, связано с отсутствием контакта собственной роговицы пациента с воздухом внешней среды и, возможно, с частичным пропитыванием влагой из защитного лоскута (рис. 2, 3).
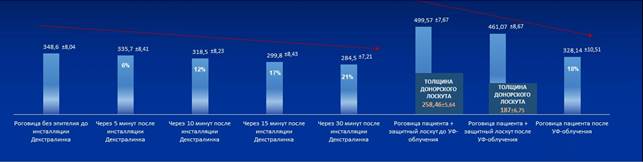
Рис. 2. Динамика изменения пахиметрии роговицы и защитного лоскута донорской роговицы, мкм и процентах


Рис. 3. Динамика изменения пахиметрии роговицы пациента и защитного лоскута донорской роговицы после проведения УФ-облучения и 10 мин закапывания декстралинка, показанная на мониторе микроскопа
Послеоперационные клинико-функциональные показатели в срок 1, 3, 6 и 12 месяцев соответствовали показателям, получаемым после выполнения акселерированного кросслинкинга по стандартному протоколу. По данным эндотелиальной микроскопии, проведенной до операции и через 12 месяцев после операции, значимых различий в показателях плотности эндотелиальных клеток не определялось, что свидетельствовало о безопасности проведенной процедуры. По данным оптической когерентной томографии роговицы в сроки 1 и 3 месяца определялось наличие демаркационной линии на глубине 235±20,5 мкм.
Внедрение в хирургическую практику интраоперационной ОКТ – новый шаг как в офтальмохирургии в целом, так и в роговичной хирургии в частности. Интраоперационная ОКТ обладает высоким научно-практическим потенциалом [10].
При проведении кросслинкинга роговицы при кератоконусе особое внимание уделяется исходной толщине роговицы для соблюдения требований безопасности. Наиболее точные данные пахиметрии роговицы в тончайшей зоне обеспечивает предоперационная ОКТ [8, 9].
На наш взгляд, интраоперационный контроль динамики изменения пахиметрии роговицы пациента с использованием УЗ-биометров сопряжен с высокой вероятностью ошибки, так как проведение измерений в одной и той же точке представляется затруднительным.
В данном исследовании в ходе акселерированного кроссслинкинга с использованием защитного лоскута донорской роговицы были проведены измерения пахиметрии сразу на 2 приборах: выполнены интраоперационная ОКТ переднего отрезка и измерения на УЗ-биометре. Следует отметить, что у пациентов со 2-й стадией кератоконуса различия в данных пахиметрии, полученных при помощи iOCT модуля и УЗ-биометра, в среднем составляли 22±7 мкм, в то время как у пациентов с 3-й стадией кератоконуса и наличием выраженной локальной зоны эктазии различия составили 54±12 мкм, при этом значения пахиметрии, полученные на УЗ-биометре, были выше, чем при измерении с помощью модуля iOCT, в среднем на 5% (рис. 4). В одном случае разница пахиметрических данных в тончайшей зоне роговицы пациента через 30 мин инстилляции декстралинка, полученных с помощью модуля iOCT и УЗ-биометра, составила 71 мкм.

Рис. 4. Сравнительное определение толщины роговицы посредством УЗ-биометра и интраоперационной ОКТ у пациентов со 2-й стадией кератоконуса
При проведении кросслинкинга на исходно тонкой роговице цена ошибки в оценке пахиметрии возрастает, так как эти данные используются для определения необходимой толщины защитного лоскута, а применение защитного лоскута недостаточной толщины приведет к повреждению эндотелия роговицы пациента. В связи с этим наличие максимально достоверных данных пахиметрии в ходе операции определяет актуальность применения интраоперационной ОКТ в рамках предложенной методики.
В результате проведенной работы выявлены изменения, происходящие с роговицей пациента и защитным лоскутом донорской роговицы при насыщении декстралинком и после облучения УФ. Было установлено, что после проведения УФ-облучения и инстилляций декстралинка в течение 10 мин с интервалом в 2 мин пахиметрия комплекса «роговица пациента + защитный лоскут донорской роговицы» уменьшалась в среднем на 7%, тогда как пахиметрия роговицы пациента увеличивалась в среднем на 18% относительно пахиметрии до операции.
Использование УЗ-биометра не позволяет получить детальную информацию о процессах, происходящих в роговице пациента и защитном лоскуте донорской роговицы, так как измерение пахиметрии возможно только для самого комплекса «роговица пациента + защитный лоскут донорской роговицы», в то время как посредством применения интраоперационной ОКТ при проведении кросслинкинга можно с высокой точностью в ходе операции определять пахиметрию тончайшей зоны роговицы пациента после насыщения раствором декстралинка, что позволяет точно рассчитать индивидуальные параметры защитного лоскута донорской роговицы.
Выводы
1. Применение УЗ-биометров сопряжено с высокой вероятностью получения ошибочных данных в сторону завышения показателей пахиметрии в среднем на 5% относительно данных, получаемых при помощи интраоперационной ОКТ.
2. Система интраоперационной ОКТ обеспечивает возможность персонализированного подхода при выборе индивидуальных параметров защитного лоскута донорской роговицы с высокой точностью для обеспечения безопасности и эффективности при проведении кросслинкинга по предложенной методике.
3. Использование интраоперационной ОКТ показало уменьшение пахиметрии комплекса «роговица пациента + защитный лоскут донорской роговицы» на 7% и уменьшение пахиметрии защитного лоскута донорской роговицы после облучения и закапывания в течение 10 мин декстралинка на 25%, в то время как пахиметрия роговицы пациента увеличилась на 18% относительно показателей пахиметрии до УФ-облучения.
4. Применение интраоперационной ОКТ позволяет детально оценить изменения пахиметрических параметров роговицы пациента и защитного лоскута донорской роговицы в ходе процедуры акселерированного кросслинкинга на исходно «тонкой» роговице и обеспечивает безопасность методики в целом.
Библиографическая ссылка
Терещенко А.В., Демьянченко С.К., Голубева Ю.Ю., Вишнякова Е.Н. ИСПОЛЬЗОВАНИЕ ИНТРАОПЕРАЦИОННОГО ОКТ ПЕРЕДНЕГО ОТРЕЗКА ГЛАЗА ПРИ ПРОВЕДЕНИИ АКСЕЛЕРИРОВАННОГО КРОССЛИНКИНГА НА «ТОНКОЙ» РОГОВИЦЕ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30602 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30602



