Первые успешные попытки нейрофизиологической идентификации прецентральной извилины у пациентов с эпилепсией, оперированных в сознании с целью сохранения двигательной функции, принадлежат W.G. Penfield (1950 г.). Для этого проводилась визуальная оценка реакции в виде двигательных ответов противоположных конечностей. В 1990-е гг. и 2000-е гг. в клиниках мира появилась и получила распространение методика картирования в наркозе, где не требуется наличия сознания пациента для интраоперационной идентификации пирамидного тракта. Преимущества и недостатки того или иного метода, а также параметры стимуляции для оптимальной идентификации функционально важных структур мозга до сих пор являются почвой для научных исследований в современной нейрохирургии [1].
На долю глиальных опухолей приходится более половины всех первичных новообразований головного мозга [2]. До сих пор проблемой современной нейрохирургии является проведение хирургического лечения новообразований, вовлекающих функционально важные структуры головного мозга. Опухоли, располагающиеся вблизи прецентральной извилины, пирамидного тракта, традиционно считались потенциально опасными для полноценного удаления и оперировались с неприемлемым процентом неврологических осложнений – до 30% [3, 4] – либо удалялись не полностью, что приводило к раннему продолженному росту опухоли и неэффективности проводимой химиолучевой терапии. Известно, что адъювантная терапия (лучевая, химиотерапия, иммунотерапия) более эффективна при небольших размерах опухоли или небольшом объеме остаточной ткани [5]. Доказано, что именно полнота удаления новообразования имеет решающее значение в прогнозе и значительно влияет на продолжительность безрецидивного периода и показатели выживаемости у пациентов с глиомами всех степеней злокачественности по WHO [6-8]. Поэтому задачей нейрохирургов при хирургическом лечении таких пациентов является стремление к соблюдению онкофункционального баланса: высокая полнота удаления опухоли без ухудшения функционального статуса [9, 10].
В статье мы приводим анализ результатов хирургического лечения пациентов с глиомами функционально важных зон головного мозга при использовании методики картирования для сохранения двигательной функции. Все пациенты были прооперированы на базе Свердловского областного онкологического диспансера за период 2007–2020 гг.
Материалы и методы исследования
Проведен анализ результатов хирургического лечения 49 пациентов с картированием моторной зоны коры и пирамидного тракта головного мозга. Критериями выбора пациентов для удаления с нейрофизиологическим мониторингом служили локализация опухоли вблизи функционально важных зон головного мозга (вблизи пирамидного тракта на протяжении от моторной коры до внутренней капсулы), отсутствие грубого неврологического дефицита (отсутствие плегий), ясный уровень сознания пациента, отсутствие грубых речевых нарушений.
Части пациентам (14), у которых опухоль располагалась вблизи прецентральной извилины или непосредственно в ней, картировали моторную кору (4-е цитоархитектоническое поле Бродмана) и пирамидный тракт. Остальным пациентам (35), у которых опухоль располагалась в белом веществе полушарий и прорастала до волокон пирамидного тракта, картировали только пирамидный тракт на протяжении прецентральная извилина – внутренняя капсула.
Для интраоперационного мониторинга использовались система нейродиагностическая модульная Nicolet Viking Quest, программа интраоперационного мониторинга (IOM). В исследовании применялись методики ЭМГ:
1) интерференционная электромиография;
2) стимуляционная электронейромиография.
Для стимуляции коры использовался электрод стимуляционный многоразовый прямой биполярный («кортикальная вилка») – диаметр контактов 2 мм, длина контактов 10 мм, расстояние между контактами 5 мм.
Для стимуляции пирамидных трактов применялись:
1) электрод стимуляционный многоразовый монополярный с изолированным корпусом, изгиб 30 градусов, диаметр контактов 1,5 мм, длина рабочей части 90 мм;
2) стимулятор-аспиратор Раабе (электрод стимуляционный монополярный с изолированным корпусом, с функцией аспирации, длина кольцевидного контакта 2 мм, длина рабочей части 120 мм).
Для регистрации моторных ответов использовались электроды игольчатые парные, прямые, игла 0,45х20 мм, кабель 2 м, разъем типа «touchprool». Проводилась регистрация ответов с тех мышц, которые имеют относительно большое представительство в моторной коре [11]. Для заземления и в качестве референтного электрода при монополярной стимуляции применялись электроды игольчатые одинарные прямые, 15 мм.
Пациенты были разделены на две группы. Первая группа (19 человек) представлена пациентами, прооперированными по протоколу «сон – пробуждение – сон» для картирования первичной моторной коры (картирование в сознании). Картирование проводили после трепанации черепа и вскрытия твердой мозговой оболочки после приведения пациента в ясное сознание. Наркоз проводили без релаксантов длительного действия (только на период интубации). Для стимуляции коры при пробуждении использовались следующие параметры тока: частота 60–100 Гц (методика Пенфилда – низкочастотная стимуляция), биполярная, бифазные импульсы длительность 0,2 мс, межстимульный интервал 0,2 мс, частота 60–100 Гц, сила тока 2–5 мА. Интраоперационное выведение на сознание пациентов позволило достоверно оценить эффекты стимуляции коры в виде остановки произвольных движений в соответствующей конечности и невозможности выполнить двигательные команды, исключая остаточное действие релаксантов и наркоза. Участок коры, где был получен такой ответ, маркировался. Картирование коры в среднем занимало 5–7 мин. После идентификации моторной коры пациенту был продолжен наркоз, и дальнейшее удаление опухоли проводилось без захода за маркированные границы моторной зоны коры. Мониторинг пирамидного тракта этой группе пациентов не проводился.
Во второй группе (30 человек) пирамидный тракт и кору картировали в наркозе, без пробуждения (общая анестезия без релаксантов). Критерием идентификации пирамидного тракта и коры в наркозе был ответ с мышц соответствующих конечностей и лица в условиях непрерывной записи интерференционной ЭМГ и непрерывной оценки моторных ответов.
Для стимуляции коры в наркозе использовали следующие параметры: биполярная стимуляция пачками импульсов по Taniguchi (высокочастотная стимуляция): серия (train) из 4 импульсов в серии частотой 500 Гц длительностью 0,2 мс каждый, сила тока от 2 до 10 мА. При стимуляции коры в наркозе начинали с методики по Taniguchi, при отсутствии результата применялась стимуляция по Пенфилду (аналогично вышеописанной).
При стимуляции пирамидных трактов в наркозе использовали только монополярную методику, в основном по Taniguchi (стимуляция пачками импульсов), сила тока от 3 до 33 мА. Вид стимулятора выбирали в зависимости от предполагаемой локализации трактов и общей операционной ситуации (либо обычный монополярный стимулятор, либо стимулятор-аспиратор Раабе).
Суть интраоперационного мониторирования пирамидного тракта заключалась в том, чтобы заранее обнаружить и сохранить его целостность в процессе всего этапа удаления опухоли, расположенной в непосредственной близости к волокнам тракта. Для определения близости к тракту в процессе удаления руководствовались условным правилом: 1 мА = 1 мм [11]. Такая методика «подстраховывает» хирурга, позволяя ему достоверно определять расстояния до опасной зоны, особенно в условиях удаления глиальных опухолей, не имеющих четких границ, в том числе при использовании флюороскопии для метаболической навигации с 5-аминолевулиновой кислотой (5-АЛК).
Для статистической обработки результатов использован пакет прикладных программ Microsoft Excel, MedCalc. Применялись метод с использованием U-критерия Манна–Уитни для количественных признаков, а также метод построения ROC-кривой. У всех пациентов было получено информированное добровольное согласие на медицинское вмешательство и на обработку персональных данных.
Результаты исследования и их обсуждение
Ведущим симптомом дебюта заболевания в нашей группе пациентов были эпилептические припадки, доля которых составляла 53% (26) от остальных симптомов. Процент дооперационного неврологического дефицита в виде пирамидной недостаточности составил 45% (22). Неврологический статус был в пределах нормы у 30% (15) исследуемых. По полу пациенты распределились следующим образом: мужчины – 37% (18); женщины – 63% (31) . Средний возраст пациентов составил 54 года (22–78 лет).
По локализации новообразования преобладала лобная доля – 49% (24). Теменная доля представлена 20,5% (10), лобно-теменная локализация – 12% (6), височная доля – 8% (4), островковая доля– 6% (3), подкорковая локализация и таламус – 4% (2). Морфологическая структура глиом распределилась следующим образом по Grade WHO: Grade I – 2 (4%), Grade II – 13 (27%), Grade III – 8 (16%), Grade IV – 22 (45%). Гистологические варианты опухолей представлены в таблице 1. Изучены размеры новообразований: средний размер составил 37,6 мм (минимальный – 15 мм, максимальный – 68 мм).
Таблица 1
Гистологические варианты глиальных опухолей
|
Вариант Variant |
Grade (WHO) |
Количество Quantity |
|
Глиобластома Glioblastoma |
IV |
21 |
|
Анапластическая астроцитома Anaplastic astrocytoma |
III |
8 |
|
Фибриллярная астроцитома Fibrillar astrocytoma |
II |
4 |
|
Фибриллярно–протоплазматическая астроцитома Fibrillar-protoplasmic astrocytoma |
II |
4 |
|
Олигодендроглиома Oligodendroglioma |
II |
2 |
|
Пиломиксоидная астроцитома Pilomyxoid astrocytoma |
I-II |
2 |
|
Протоплазматическая астроцитома Protoplasmic astrocytoma |
II |
3 |
|
Анапластическая олигодендроглиома Anaplastic oligodendroglioma |
III–IV |
1 |
|
Гемистоцитарная астроцитома Hemistocytic astrocytoma |
II |
1 |
|
Олигоастроцитома Oligoastrocytoma |
II |
3 |
Мы сравнили результаты идентификации пирамидного тракта и моторной коры у пациентов, картированных в сознании (с интраоперационным пробуждением) и в наркозе. Также сравнили эффективность обоих видов стимуляции (низко- и высокочастотной) для точности идентификации моторной коры и тракта. Минимальные и максимальные значения силы тока при разных видах стимуляции, при которых идентифицированы моторная кора или тракт, показаны в таблице 2. Минимальные значения тока отражают близость зоны манипуляций к пирамидному тракту в процессе удаления опухоли. Максимальные значения свидетельствуют об отдаленности моторной коры и пирамидного тракта от траектории доступа и зоны церебротомии.
Таблица 2
Результаты стимуляции коры и пирамидного тракта у пациентов в наркозе и с пробуждением
|
|
В наркозе Under general anesthesia |
В сознании awakkening |
|
|
Низкочастотная low-frequency |
Высокочастотная high-frequency |
Низкочастотная low-frequency |
|
|
Процент идентификации тракта Percent of the tract identification |
84% |
95% |
– |
|
Процент идентификации моторной коры Percent of the motor cortex identification |
75% |
67% |
52% |
|
Параметры тока при идентификации коры, мА, Ме (Q25; Q75) Current parameters when identifying the cortex, mA, Me (Q25; Q75) |
6,5 (5,0;8,0 ) |
4,0 (2,5;7,5) |
2(2,0;3,0) |
|
Параметры тока при идентификации тракта, мА, Ме (Q25; Q75) Current parameters when identifying the tract, mA, Me (Q25; Q75) |
10 (5,75;15,0) |
16,0 (5,0;26,75) |
– |
|
Интраоперационный припадок Intraoperative seizure |
2 |
– |
1 |
|
Процент углубления неврологического дефицита Percent of a neurological deficit deepening |
17% |
11% |
|
Верифицировать пирамидный тракт и моторную кору удалось в 74% случаев в целом. Пирамидный тракт в наркозе удалось идентифицировать у 93% пациентов, кору – лишь у 71%. Низкий процент идентификации коры обусловлен, скорее всего, отсутствием открытой прецентральной извилины в пространстве трепанационного окна. В сознании верифицировали только моторную кору (без трактов), которая была выявлена у 52% картированных. 3 пациента не вышли на ясное сознание после вскрытия твердой мозговой оболочки и не выполнили команды. У 5 пациентов не было получено моторных ответов с коры, находящейся в зоне трепанационного окна, в 1 случае картирование не удалось из-за кашля и резкого повышения ВЧД, что привело к необходимости продолжения наркоза и отказа от картирования. Мы не превышали параметры тока 10 мА при корковой стимуляции для снижения риска возникновения эпилептического припадка.
При использовании низкочастотной стимуляции пирамидный тракт идентифицирован у 84% пациентов, при высокочастотной – у 95% (рис. 1).
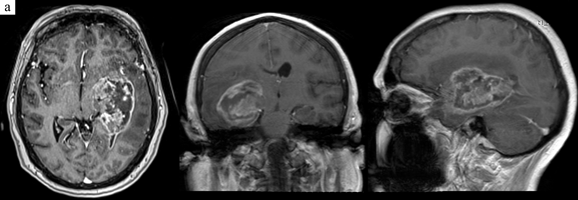
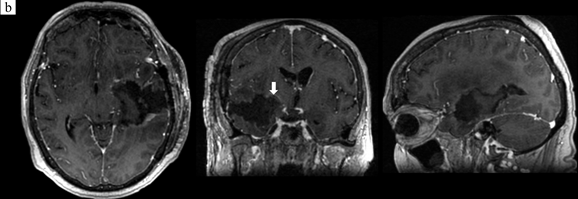
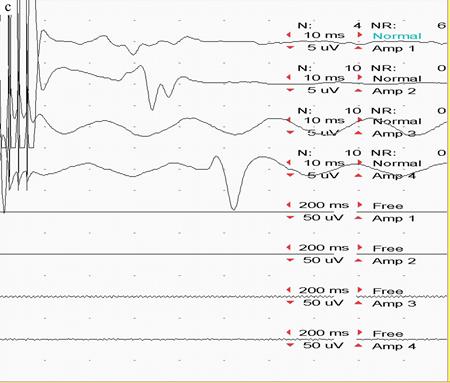
Рис. 1. Пациентка 68 лет с глиобластомой правой височной доли
a, b – МРТ до и после операции соответственно. Картирование пирамидного тракта проводилось в наркозе. В послеоперационном периоде нарастания пирамидной симптоматики не наблюдалось. c – фотография с монитора миографа. М – ответ получен с кисти, предплечья и стопы при высокочастотной стимуляции трейнами на минимальный параметр стимуляции силой тока 4,7 мА при удалении самых медиальных отделов опухоли. Зона стимуляции показана белой стрелкой. Регистрирующие электроды:
1-й канал – M extensor indicis sin
2-й канал – m abductor pollicis brevis sin
3-й канал – m tibialis anterior sin
4-й канал – m abductor hallucus sin
В нашем исследовании процент индуцированных судорог выше при картировании в наркозе, чем в сознании. Все припадки в наркозе были при использовании только низкочастотной стимуляции при стимуляции коры. При стимуляции же коры трейнами припадков не было. Мы не использовали высокочастотную стимуляцию для картирования моторной коры у пациентов в сознании ввиду отсутствия технической возможности.
Наибольший успех в идентификации тракта и коры был достигнут у больных с отсутствием исходных парезов и с высокодифференцированным медленно растущим типом опухоли (Grade I–II). У пациентов с локализацией образования вблизи прецентральной извилины наибольший ответ при стимуляции представлен проекцией зоны руки (рис. 2).
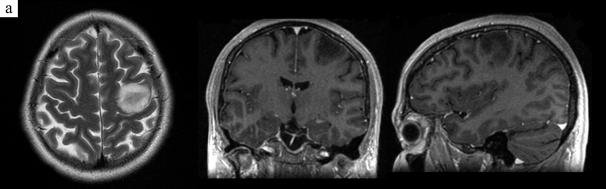
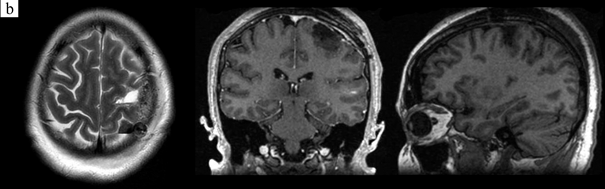
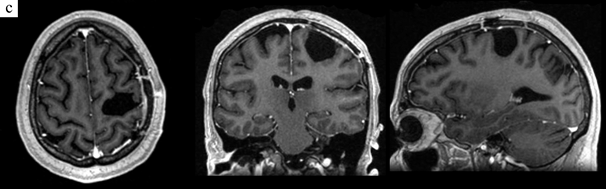
Рис. 2. МРТ пациентки 36 лет, оперированной по поводу пиломиксоидной астроцитомы левой прецентральной извилины с картированием моторной коры с пробуждением. Идентифицирована зона руки – предплечья. Тотальное удаление опухоли с последующей лучевой терапией в дозе 56 Гр
a – МРТ до операции, b, c – МРТ пациентки спустя 1 год и 2,5 года после операции соответственно. Данных за рецидив нет. В раннем послеоперационном периоде у пациентки нарос верхний дистальный монопарез, который полностью регрессировал через 3 месяца.
Полнота удаления опухоли оценивалась на послеоперационной МРТ, выполненной в течение 48 ч после операции. В нашем исследовании тотальное удаление опухоли достигнуто у 74% пациентов, субтотальное – у 26%. Динамика очаговых неврологических симптомов в раннем послеоперационном периоде представлена следующими данными: без динамики – 66,5%, углубление парезов – 14%, регресс парезов – 17,5%, что соответствует результатам, полученным другими авторами в подобной группе пациентов, оперированных с картированием [4, 10, 12, 13]. Поскольку неврологический статус не удалось оценить у всех пациентов в отдаленном периоде, то мы не приводим информацию о его динамике, в том числе о дальнейшем регрессе очаговой неврологической симптоматики.
Мы проанализировали результаты стимуляции пирамидного тракта при удалении опухолей. В 20 случаях при известных параметрах минимального тока при идентификации тракта не получено нарастания парезов в послеоперационном периоде. У 4 пациентов парез нарос в той или иной мере. Была выявлена зависимость между минимальной величиной тока и риском нарастания пареза на основании расчетов U-критерия Манна–Уитни при сравнении группы с нарастанием пареза и группы без его нарастания. U-критерий Манна–Уитни равен 4. Критическое значение U-критерия Манна–Уитни при заданной численности сравниваемых групп составляет 13. 4 ≤ 13, следовательно, различия уровня признака в сравниваемых группах статистически значимы, p=0,0052 (р<0,05) (табл. 3).
Таблица 3
Динамика пирамидной симптоматики и минимальные показатели силы тока при идентификации пирамидного тракта
|
Динамика Dynamic |
Параметры тока, мА,Ме (Q25; Q75) Current parameters, mA, Me (Q25; Q75) |
p |
|
Нарастание Increase n=4 |
3,5 (2,0;5,0) |
p=0,0052 |
|
Без нарастания No increase n=20 |
15,5 (8,5;29,0) |
Таким образом, в исследовании доказана прямая зависимость между близостью подхода к пирамидному тракту во время удаления опухоли и риском возникновения или усугубления неврологической симптоматики в виде пирамидной недостаточности в раннем послеоперационном периоде, что находит отражение в работах других исследователей [1, 3].
Для оценки прогностической значимости минимального значения величины тока в мА идентификации пирамидного тракта в возникновении или усугублении пирамидной симптоматики применен ROC-анализ. Определена точка статистически значимого разграничения между пациентами с усугублением пареза и без его нарастания 5 мА (AUC 0,950, 95% ДИ, p<0,001) cо значением чувствительности 100,0 и специфичности 85,0 (рис. 3). Таким образом, критической величиной силы тока, определяющей рискованную близость к волокнам пирамидного тракта, является величина 5 мА. Этот факт должен приниматься во внимание при стремлении хирурга к более полному удалению глиомы вблизи пирамидного тракта [14].
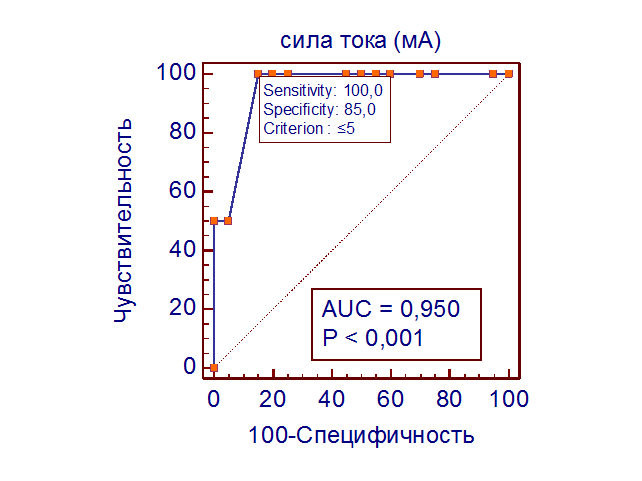
Рис. 3. ROC-кривая прогностической значимости величины силы тока (мА) при идентификации пирамидного тракта в риске возникновения парезов
Методика высокочастотной стимуляции (трейнами), по полученным нами данным, наиболее приемлема для идентификации пирамидного тракта в белом веществе в условиях наркоза при монополярной стимуляции. Методика же низкочастотной стимуляции (методика Пенфилда) наиболее эффективна для идентификации моторной коры в пределах прецентральной извилины в условиях наркоза, но она несет риск развития эпилептического припадка даже в наркозе. Отсутствие идентификации моторной коры при пробуждении в 5 случаях в нашем исследовании может быть связано с известным феноменом смещения моторной зоны коры растущей глиомой [15]. Этим смещением объясняется факт неполного совпадения данных анатомического планирования (МР-трактографии, функциональной МРТ) с данными нейрофизиологического картирования при идентификации моторной коры у таких пациентов.
Заключение
Функциональный мониторинг является желательной методикой для интраоперационного использования, особенно при высокодифференцированных глиальных опухолях, которые не имеют анатомических четких границ и не идентифицируются с помощью 5-АЛК. Методика является дополнительным, безопасным, надежным инструментом для идентификации тракта и моторной коры, которая может быть сложна у пациентов с искаженной анатомией.
Библиографическая ссылка
Гвоздев П.Б., Лаврова С.А., Яблонский Л.Н. ИНТРАОПЕРАЦИОННОЕ КАРТИРОВАНИЕ В УСЛОВИЯХ НАРКОЗА И В СОЗНАНИИ ПРИ УДАЛЕНИИ ГЛИАЛЬНЫХ ОПУХОЛЕЙ МОТОРНОЙ КОРЫ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30597 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30597



