Миелосупрессия является основной дозоограничивающей токсичностью в лечении рака, однако миелотоксические режимы остаются текущим стандартом лечения больных раком молочной железы [1]. Одним из проявлений миелотоксичности цитостатиков служит эритроцитопения с усилением анемии, часто обусловленной самим опухолевым процессом [2]. Причинами усиления цитостатиками анемии часто являются снижение или нарушение выработки эритроцитов и высокая скорость их разрушения или снижение выживаемости [1]. Применение липосомальных форм цитостатиков позволяет в некоторой степени снижать их токсическое действие на здоровые органы и ткани [3], но не решает проблему гематотоксичности. Имеющиеся опасения в отношении способности рекомбинантного человеческого эритропоэтина вызывать рост опухолей и повышать риск венозной тромбоэмболии привели к тому, что значительно меньше онкологических больных получают терапию препаратами эритропоэтина для лечения миелосупрессивной химиотерапии [4]. Известна важная роль окислительного стресса, индуцированного цитостатиками, в развитии гематологической токсичности, в том числе при повреждении эритроцитов. Реорганизация мембраны эритроцитов, индуцированная окислительным стрессом, ведет к нарушению их деформационных характеристик, снижает оксигенацию здоровых тканей и способствует прогрессированию опухоли [1]. Таким образом, остается актуальным поиск наиболее эффективных средств защиты эритропоэза, особенно среди средств, обладающих антиоксидантной активностью. В литературе имеются позитивные данные о применении липосомальных антиоксидантных средств при разных патологических состояниях [5, 6], но степень эффективности липосомальных форм дериватов пиримидина и 3-гидроксипиридина в минимизации эритропоэзсупрессивной активности цитостатиков ранее не оценивалась.
Цель исследования – изучить эффективность липосомальных дериватов пиримидина и 3-гидроксипиридина – ксимедона и мексидола – в минимизации эритропоэзсупрессивного действия липосомальной комбинации «доксорубицин + циклофосфамид» и сопоставить полученные результаты с таковой эффективностью свободной формы указанных дериватов у крыс с карциномой Walker-256.
Материал и методы исследования. Экспериментальную работу выполняли на 168 самках-крысах линии Вистар массой 160–270 г из питомника «Столбовая» ФГБУН НЦБМТ ФМБА. Условия содержания животных (в виварии Мордовского государственного университета) включали естественный режим света и кормления, свободный доступ к воде и пище. Все манипуляции с животными выполняли согласно правилам «Руководства по уходу и использованию лабораторных животных» (Guide for the care and use of laboratory animals) [7]. Моделирование неопластического процесса осуществляли введением взвеси клеток карциномы Walker-256 (W-256) (106 клеток) под кожу хвоста. Официнальную лекарственную форму (порошок во флаконах) доксорубицина («Pharmachemie», Нидерланды) применяли как 0,04%-ный раствор, а циклофосфамида («Baxter oncology», Германия) – как 0,45%-ный раствор на изотоническом растворе натрия хлорида. Субстанцию ксимедона («Кристалл», Россия) применяли 10%-ным раствором на изотоническом растворе натрия хлорида, а официнальную форму мексидола («Фармасофт», Россия) – в виде 5%-ного водного раствора. Липосомы получали методом обращения фаз из лецитина и холестерина. Препараты инкапсулировались пассивной загрузкой. Создание липосом осуществляли с применением роторного испарителя (Heidolph, Германия) и экструдера (LIPEX, Канада). Очистку липосом от свободных фракций выполняли с помощью диализа в атмосфере инертного газа. Характеристики липосомальных частиц оценивались на спектрофотометре Shimadzu (Япония) и анализаторе размеров наночастиц NANO-flex (США). Концентрация доксорубицина, циклофосфамида, ксимедона и мексидола в липосомах определялась методом УФ-спектрофотометрии с расчетом степени включения препаратов. Концентрация доксорубицина и циклофосфамида в липосомах соответствовала 1,86 мг/мл и 21 мг/мл соответственно, ксимедона – 50 мг/мл и 100 мг/мл, мексидола – 25 мг/мл и 50 мг/мл.
Животные были распределены на 13 групп по 12–14 крыс в каждой: в 1-ю группу входили интактные крысы, во 2-ю – крысы с перевитой карциномой Walker-256 (W-256), не получающие лекарственную терапию; в 3-ю – крысы с W-256, получающие доксорубицин (4 мг/кг) и циклофосфамид (45 мг/кг) в свободной форме однократно в боковую хвостовую вену на 11-е сутки после введения опухолевых клеток; в 4-ю – крысы с карциномой W-256, получающие липосомальную комбинацию доксорубицин (4 мг/кг) + циклофосфамид (45 мг/кг) однократно внутривенно на 11-е сутки после введения опухолевых клеток; в 5-ю – крысы с карциномой W-256, получающие липосомальные цитостатики (как в 4-й группе) и липосомальный ксимедон (50 мг/кг) внутривенно ежедневно с начала применения цитостатиков, в течение 5 суток; в 6-ю – крысы с карциномой W-256, получающие липосомальные цитостатики и липосомальный ксимедон (100 мг/кг) внутривенно ежедневно с начала применения цитостатиков в течение 5 суток; в 7-ю – крысы с карциномой W-256, получающие липосомальные цитостатики и липосомальный мексидол (25 мг/кг) внутривенно ежедневно с начала введения цитостатиков в течение 5 суток; в 8-ю – крысы с карциномой W-256, получающие липосомальные цитостатики и липосомальный мексидол (50 мг/кг) внутривенно ежедневно с начала применения цитостатиков в течение 5 суток; в 9-ю и 10-ю – крысы с карциномой W-256, получающие липосомальные цитостатики и «свободный» ксимедон в дозах 50 и 100 мг/кг соответственно внутривенно ежедневно с начала применения цитостатиков в течение 5 суток; в 11-ю и 12-ю – крысы с карциномой W-256, получающие липосомальные цитостатики и «свободный» мексидол в дозах 25 мг/мл и 50 мг/кг в соответствующих группах внутривенно ежедневно с начала введения цитостатиков в течение 5 суток; в 13-ю – крысы с карциномой W-256, получающие липосомальные цитостатики и липосомальные ксимедон (50 мг/кг) и мексидол (25 мг/кг) внутривенно ежедневно, с начала применения цитостатиков в течение 5 суток.
На 3-й и 7-й день после химиотерапии 6 животных из каждой группы усыпляли посредством тиопентала натрия (50 мг/кг). Количество эритроцитов в крови подсчитывали в камере Горяева. Содержание гемоглобина определяли гемиглобинцианидным методом. Исследование миелограммы по мазкам костного мозга из бедренной кости крыс с подсчетом числа пронормобластов, базофильных, полихроматофильных и оксифильных нормобластов проводилось методом световой микроскопии. Статистическую обработку проводили с расчетом средних арифметических значений (М) и их ошибок (m). Достоверность различий в группах рассчитывали с использованием критерия Манна–Уитни. Различия считали достоверными при p<0,05.
Результаты исследования и их обсуждение. Применение комбинации «доксорубицин + циклофосфамид» у крыс с карциномой W-256 (в 3-й группе) приводило на 3-й день после химиотерапии к усилению анемии: уровень эритроцитов и гемоглобина снижался на 30% и 23% соответственно относительно интактных крыс (р<0,05). Идентичные изменения были отмечены при использовании липосомальной комбинации «доксорубицин + циклофосфамид» (в 4-й группе) (рис. 1).
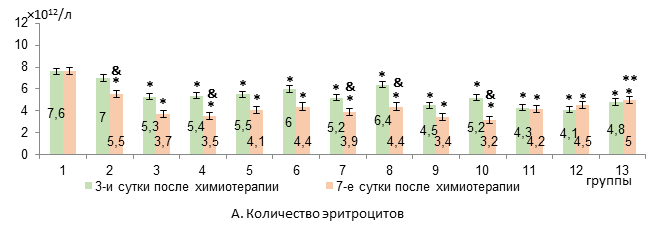
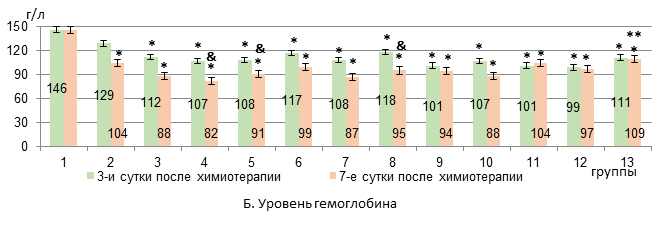
Рис. 1. Динамика изменений уровня эритроцитов и гемоглобина в крови крыс с карциномой Walker-256 на фоне воздействия липосомальными ксимедоном и мексидолом и липосомальной комбинацией «доксорубицин + циклофосфамид» (А-Б)
* – достоверные различия в сравнении с интактными крысами (р<0,05);
** – достоверные различия в сравнении с группой 4 (р<0,05);
& – достоверные различия в группе в сравнении с 3-ми сутками (р<0,05).
К 7-му дню в 3-й группе анемия сохранялась на прежнем уровне, а в 4-й группе эритроцитопения усиливалась на 35%, на 18% падал уровень гемоглобина по сравнению с 3-м днем эксперимента (р<0,05, рис. 1). В костном мозге на 3-й день после химиотерапии у животных 3-й группы появлялись пронормобласты, исчезали базофильные нормобласты, а уровень полихроматофильных нормобластов снижался на 82% относительно интактных крыс (р<0,05, рис. 2).
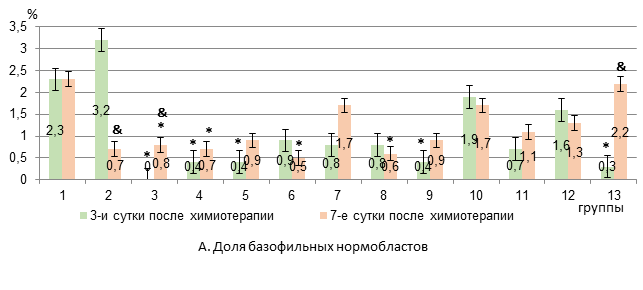
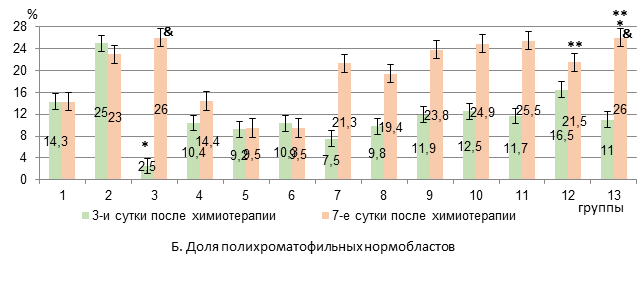
Рис. 2. Содержание базофильных и полихроматофильных нормобластов в костном мозге крыс с карциномой Walker-256 при применении липосомальных ксимедона и мексидола с липосомальной комбинацией «доксорубицин + циклофосфамид» (А-Б)
* – достоверные различия в сравнении с интактными крысами (р<0,05);
** – достоверные различия в сравнении с группой 4 (р<0,05);
& – достоверные различия в группе в сравнении с 3-ми сутками (р<0,05).
В 4-й группе на фоне появления пронормобластов отмечалось снижение только уровня базофильных нормобластов на 84% (р<0,05) относительно интактных крыс. При этом число базофильных и полихроматофильных нормобластов было в 4 раза достоверно больше, чем в 3-й группе крыс. К 7-м суткам после химиотерапии в обеих группах количество базофильных нормобластов было ниже, чем у интактных животных (на 71% и 75% в 3-й и 4-й группах соответственно, р<0,05), а другие анализируемые показатели эритропоэза уже не отличались от исходных значений (рис. 2). Следовательно, исходя из показателей миелограммы использование комбинации «доксорубицин + циклофосфамид» в составе липосом оказывается первоначально менее агрессивным в отношении эритропоэза, чем применение свободной формы цитостатиков. В то же время усиление эритроцитопении и снижение уровня гемоглобина на 7-е сутки после химиотерапии при использовании липосомальных «доксорубицин + циклофосфамид» в сравнении с 3-ми сутками, вероятно, все же является следствием подавления пролиферации незрелых предшественников эритроцитов. Вероятно, менее выраженное и плавное угнетение эритропоэза сопровождается замедлением развития соответствующих проявлений в периферическом звене эритрона.
Ксимедон в липосомальной и свободной форме в обеих исследуемых дозах не препятствовал развитию анемии на 3-й день после применения цитостатиков. К 7-му дню показатели гемоглобина и эритроцитов в группах с липосомальным и свободным ксимедоном также не отличались от таковых в 4-й группе животных (рис. 1). В костном мозге на 3-й день достоверный рост числа пронормобластов отмечался в группах с липосомальным и свободным ксимедоном в дозе 100 мг/кг, при этом уровень базофильных нормобластов в этих группах не отличался от исходного. На 7-й день лишь в группе с липосомальным ксимедоном в дозе 100 мг/кг уровень базофильных нормобластов был на 80% ниже исходного показателя (р<0,05), а в группе со свободной формой ксимедона в дозе 100 мг/кг был в 2,6 раза больше, чем в 4-й группе крыс (р<0,01) и не различался с изначальным показателем (рис. 2).
Мексидол в липосомальной и свободной форме в обеих исследуемых дозах не препятствовал развитию анемии на 3-й день после химиотерапии. Однако в группе с липосомальным мексидолом в дозе 50 мг/кг по сравнению со свободной формой количество эритроцитов было на 57% больше (р<0,05). К 7-му дню показатели гемоглобина и эритроцитов в группах с липосомальным и свободным мексидолом также не отличались от таковых в 4-й группе животных (рис. 1). В костном мозге на 3-й день после химиотерапии достоверный рост числа пронормобластов был в группах с липосомальным мексидолом в дозе 25 мг/кг и свободным мексидолом в дозе 50 мг/кг. При этом уровень базофильных нормобластов в группах с липосомальным и свободным мексидолом в обеих исследуемых дозах не отличался от исходного (рис. 2). На 7-й день достоверный рост числа пронормобластов был отмечен в группах с липосомальным и свободным мексидолом в дозах 25 мг/мл и 50 мг/кг на фоне исходных значений полихроматофильных и оксифильных нормобластов. Число базофильных нормобластов на фоне липосомального мексидола 25 мг/кг и его свободной формы в обеих исследуемых дозах не различалось с изначальным значением, а при введении липосомальной формы в дозе 50 мг/кг было на 78% ниже, чем у крыс интактной группы (р<0,05, рис. 2).
Таким образом, дозы липосомальных форм ксимедона 50 мг/мл и мексидола и 25 мг/кг соответственно более стабильно уменьшают эритропоэзсупрессивный эффект комбинации «доксорубицин + циклофосфамид» в липосомальной форме. Липосомальные ксимедон в дозе 100 мг/кг и мексидол в дозе 50 мг/кг кратковременно (на 3-и сутки после химиотерапии) способствуют росту числа базофильных нормобластов в костном мозге, однако уже к 7-м суткам их содержание снижается до уровня животных 4-й группы. При этом ксимедон и мексидол в свободной форме в исследуемых дозах снижают эритропоэзсупрессивное действие липосомальных цитостатиков на всем протяжении опыта. Однако в группах с липосомальными и свободными ксимедоном и мексидолом положительная динамика восстановления эритропоэза не сопровождается уменьшением выраженности анемии.
Сочетанное введение липосомальных ксимедона (50 мг/кг) и мексидола (25 мг/кг) не препятствовало развитию анемии на 3-й день после химиотерапии, однако уже к 7-му дню содержание эритроцитов и гемоглобина увеличивалось на 43% и 33,6% соответственно (р<0,05) по сравнению с показателями в 4-й группе животных (рис. 1). В костном мозге исследуемые показатели эритропоэза на 3-й день после химиотерапии не различались с таковыми интактных животных, за исключением базофильных нормобластов, содержание которых снижалось на 89% (р<0,05). К 7-му дню отмечались восстановление исходного количества базофильных нормобластов (3-кратный прирост в сравнении с 4-й группой, р<0,05), нарастание содержания полихроматофильных нормобластов на 85% (р<0,05) по сравнению со здоровыми крысами (прирост на 80% в сравнении с 4-й группой, рис. 2) и тенденция к росту числа оксифильных нормобластов.
Заключение. Таким образом, липосомальная комбинация «доксорубицин + циклофосфамид», в отличие от свободной формы цитостатиков, менее выраженно и более плавно угнетает эритропоэз. Липосомальные ксимедон и мексидол не имеют преимуществ перед свободной их формой в коррекции угнетения эритропоэза, вызванного липосомальными цитостатиками. При этом положительная динамика восстановления эритропоэза не сопровождается уменьшением выраженности анемии в исследуемые сроки. Комбинация липосомальных форм ксимедона и мексидола, в отличие от раздельного введения их липосомальных и свободных форм, снижает тяжесть анемии на 7-й день после химиотерапии с увеличением уровня гемоглобина (на 33,6%) и эритроцитов (на 43,4%) в периферической крови в сочетании с ростом доли базофильных (в 3 раза) и полихроматофильных нормобластов (на 80%) в костном мозге у крыс с карциномой Walker-256.
Библиографическая ссылка
Соловьева М.А., Сипров А.В., Агеев В.П., Шмырева Н.В., Макарова М.Ю., Вашуркина И.М., Шубин Д.Ю., Кечемайкина М.И. ВЛИЯНИЕ ПРОИЗВОДНЫХ ПИРИМИДИНА И 3-ГИДРОКСИПИРИДИНА В СОСТАВЕ ЛИПОСОМ НА ПОКАЗАТЕЛИ ЭРИТРОЦИТОПОЭЗА ПРИ ИСПОЛЬЗОВАНИИ ЛИПОСОМАЛЬНЫХ ДОКСОРУБИЦИНА И ЦИКЛОФОСФАМИДА У КРЫС СО ЗЛОКАЧЕСТВЕННЫМ ОПУХОЛЕВЫМ ПРОЦЕССОМ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30594 (дата обращения: 04.03.2026).
DOI: https://doi.org/10.17513/spno.30594



