В настоящее время остается актуальной проблемой поиск лекарственных веществ, сочетающих эффективное повреждающее действие на малигнизированные клетки с низкой токсичностью в отношении нормальных тканей. В связи с этим представляется перспективным изучение веществ, принадлежащих к алкалоидам трополонового ряда, наиболее известным представителем которых является колхицин. Имеются сведения об избирательной токсичности указанных факторов в отношении опухолевой ткани, продемонстрированной на линиях различных нормальных и малигнизированных клеток [1–3]. Это указывает на возможное преимущество рассматриваемых соединений по сравнению с препаратами платины, оказывающими, как известно, выраженное токсическое действие на здоровые ткани [4]. Представляется целесообразным проведение всестороннего изучения эффектов перспективных соединений трополонового ряда, одним из начальных этапов которого является определение их токсичности в экспериментах in vivo. В связи с этим интерес вызывает новое вещество в ряду 2-хинолин-2-ил-производных 1,3-трополона – 2-(6,8-диметил-5-нитро-4-хлорхинолин-2-ил)-5,6,7-трихлор-1,3-трополон. Ранее нами в экспериментах in vitro была продемонстрирована его противоопухолевая активность в отношении клеток линии рака легкого A549. При этом минимальная ингибирующая концентрация данного соединения оказалась в 18 раз ниже по сравнению с соответствующим показателем для цисплатина [5]. Дальнейшее изучение биологической активности нового фактора предусматривало оценку его эффектов в широком диапазоне доз, способных поддерживать рост ксенографтов злокачественных опухолей человека, для определения токсичности в экспериментах на иммунодефицитных животных.
Целью исследования явилось изучение влияния 2-(6,8-диметил-5-нитро-4-хлорхинолин-2-ил)-5,6,7-трихлор-1,3-трополона при однократном введении в трех разных дозах, отличающихся от наименьшей из них в 10 и 100 раз, на состояние иммунодефицитных мышей.
Материал и методы исследования
Исследуемое соединение 2-(6,8-диметил-5-нитро-4-хлорхинолин-2-ил)-5,6,7-трихлор-1,3-трополон (далее – трополон) было синтезировано в Научно-исследовательском институте физической и органической химии Федерального государственного автономного образовательного учреждения высшего профессионального образования «Южный федеральный университет» и представляло собой порошок светло-желтого цвета. Структурная формула вещества приведена на рисунке.
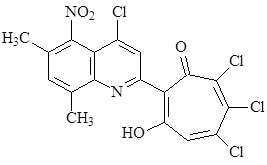
Структурная формула 2-(6,8-диметил-5-нитро-4-хлорхинолин-2-ил)-5,6,7-трихлор-1,3-трополона
Эксперимент проводили на 20 половозрелых самцах мышей линии Balb/c Nude весом 25,5–27,5 г. Животные были распределены на 4 группы по 5 самцов в каждой. Исследуемое соединение оказалось нерастворимым в воде. В связи с этим в качестве носителя использовали 1%-ный крахмальный гель. Таким образом, трополон вводили животным в форме суспензии. Суспензию готовили ex tempore и вводили каждому животному из основных групп с помощью зонда в объеме 0,3 мл. Мыши контрольной группы получали 1%-ный крахмальный гель в том же объеме. Три основные группы мышей различались дозой вещества, получаемого per os однократно: соответственно 0,0055 (1-я группа), 0,055 (2-я группа) и 0,55 мг/г (3-я группа). Изучение действия трополона в более высокой дозе – 5,5 мг/г – было затруднено в связи с невозможностью суспендирования необходимого количества вещества в регламентированном для введения лабораторным мышам объеме геля (0,3 мл). Наименьшая из указанных доз была выбрана на основе сведений о дозах хиноктиола (известного соединения трополонового ряд), эффективных в отношении подкожных ксенографтов аденокарциномы рака легкого человека Н1975 у мышей NOD-SCID [6].
Для оценки эффектов исследуемого соединения у мышей линии Balb/c Nude при его однократном приеме использовали такие показатели, как динамика веса, особенности поведения и дыхания, биохимические и цитологические показатели крови, макрокартина внутренних органов при некропсии. Так, после однократного введения исследуемого трополона в течение 14 последующих дней проводили ежедневный осмотр мышей с оценкой поведения, позы, частоты дыхания. Массу тела определяли на 7-е и 14-е сутки. По прошествии 14 суток животных подвергали эвтаназии путем дислокации шейных позвонков. Проводили забор крови и некропсию. При некропсии контролировали наличие выпота в брюшной полости, следов исследуемого вещества в желудке и кишечнике и состояние внутренних органов.
Для оценки гематологических и биохимических показателей использовали гемоанализатор «Exigo EOS vet» (Boule Medical A.B., Швеция) и биохимический анализатор VetScanVS2 (ABAXIS Inc., Германия). Как известно, базовые биохимические и цитологические показатели крови позволяют провести комплексную оценку функций различных органов и систем. При этом токсическое действие лекарственных и иных факторов, как правило, сопровождается снижением уровня общего белка и повышением уровня целого ряда других показателей – билирубина, печеночных трансаминаз, щелочной фосфатазы, мочевины и креатинина [7]. Умеренное снижение содержания креатинина и мочевины в сыворотке крови, как правило, не имеет диагностического значения.
При статистическом анализе результатов оценивали средние значения и вариабельность показателей (коэффициент вариации, cv), для определения межгрупповых различий использовали критерий Вилкоксона–Манна–Уитни и t-критерий Стьюдента.
Результаты исследования и их обсуждение
Изучение изменений в организме экспериментальных животных не выявило выраженных признаков токсического действия трополона на уровне исследованных показателей при его применении в указанных дозах. В ходе некропсии у большинства мышей не было отмечено патологических изменений цвета кожи и слизистых оболочек, выпота в брюшной полости и следов вещества в желудке и кишечнике. У двух мышей из группы 2 наблюдались одиночные очаговые кровоизлияния в средней доле печени до 1 мм в диаметре. В группе 3 была отмечена гиперемия печени у двух самцов и очаговое кровоизлияние в легких у одной особи. Возможно, выявленные изменения могут быть следствием проведения процедуры эвтаназии, поскольку у всех этих животных при дальнейшем анализе не было обнаружено заметных отклонений в значении биохимических и цитологических показателей крови по сравнению с другими животными тех же групп. При изучении динамики веса мышей незначительное снижение данного показателя к концу периода наблюдений было отмечено только у одной особи из группы 3. У остальных животных, напротив, наблюдалось увеличение веса к концу эксперимента на 0,5–2 г по сравнению с исходными значениями. При этом наиболее выраженным такое увеличение было в контрольной группе и группе 1, которые статистически значимо отличались по данному показателю от группы 3, включавшей мышей, получивших вещество в максимальной исследованной дозе 0,55 мг/г (табл. 1).
Таблица 1
Изменение веса и биохимических показателей крови мышей Balb/c Nude
на 14-е сутки после однократного приема
2-(6,8-диметил-5-нитро-4-хлорхинолин-2-ил)-5,6,7-трихлор-1,3-трополона
|
Группа |
Увеличение веса, г |
Белок, мг/дл, (cv) |
Мочевина, мг/дл, (cv) |
Креатинин мг/дл, (cv) |
Глюкоза, мг/дл, (cv) |
АЛТ, ед/л (cv) |
ЩФ, ед/л, (cv) |
|
Контроль |
1,7±0,14◘ |
5,2±0,1 (4%) |
23,0±1,8● (16%) |
0,36±0,08 (47%) |
249±17 (13%) |
275±86 (62%) |
0 |
|
1 |
1,6±0,11◘ |
4,7±0,5 (21%) |
18,0±1,1*◘ (12%) |
0,30±0,09 (58%) |
232±23 (20%) |
148±53 (71%) |
6,8±2,0*◘ (59%) |
|
2 |
1,3±0,29 |
6,1±0,1*●◘ (3%) |
19,6±0,3*◘ (3%) |
0,22±0,03* (22%) |
163±8*● ◘ (10%) |
62±27*◘ (88%) |
33,6±8,2*●◘ (48%) |
|
3 |
0,8±0,38*● |
5,2±0,1 (5%) |
23,0±1,8● (16%) |
0,31±0,09 (67%) |
245±19 (15%) |
278±85 (61%) |
менее 5● |
Примечание: * – отличается от значений в контрольной группе, p<0,01; ● – отличается от значений в группе 1, p<0,01, ◘ – отличается от значений в группе 3, p<0,01; критерий Вилкоксона–Манна–Уитни, t-критерий Стьюдента.
Биохимические показатели крови (табл. 1) имели ряд межгрупповых различий, свидетельствовавших о дозозависимом влиянии исследуемого соединения на организм мышей. При этом во всех трех основных группах не было отмечено повышения уровней мочевины, креатинина, аланинтрансферазы (АЛТ) и билирубина по сравнению с этими показателями в контрольной группе. Как уже было указано, данное обстоятельство могло отражать отсутствие значительного токсического влияния на организм экспериментальных животных трополона в исследованных дозах. Группа 1, включавшая мышей, получивших вещество в минимальной из исследованных доз (0,0055 мг/г), характеризовалась сниженным содержанием мочевины и наличием активности щелочной фосфатазы (ЩФ), отсутствовавшей у особей контрольной группы. Наиболее выраженные отличия биохимических показателей крови от контрольных значений наблюдались у мышей в группе 2, которые получали исследуемое соединение в промежуточной дозе 0,055 мг/г. У животных указанной группы были отмечены наиболее высокое содержание общего белка, сниженный уровень мочевины и креатинина, минимальное содержание АЛТ и глюкозы при максимальной активности ЩФ, кратно превышавшей активность данного фермента в группах 1 и 3. В группе 3, в отличие от группы 2, отличия биохимических показателей от контрольных значений были выражены в наименьшей степени и проявились только в наличии активности ЩФ, отсутствовавшей у мышей контрольной группы (табл. 1).
Перечисленные межгрупповые различия могли указывать на направленность метаболических и иных сдвигов в организме мышей Balb/c Nude под влиянием изучаемого трополона, использованного в разных дозах. Отсутствие заметных изменений биохимических показателей крови по сравнению с контрольными значениями в случае применения данного вещества в максимальной дозе (группа 3) может свидетельствовать об отсутствии выраженного токсического влияния данного соединения у этих животных. Это позволяет усомниться в наличии токсического действия при его использовании в более низких дозах, несмотря на статистически значимые сдвиги некоторых из рассматриваемых показателей в группах 1 и 2. По нашему мнению, в группе 2 сочетание повышенного уровня общего белка со сниженным содержанием мочевины, глюкозы, креатинина и АЛТ при крайне низкой вариабельности уровня белка и мочевины (cv=3%, табл. 1), имеющих прямую метаболическую связь, могло указывать на уменьшение интенсивности катаболических процессов при однократном приеме трополона в промежуточной дозе. Представляется маловероятным, что на фоне перечисленных сдвигов и увеличения веса животных к концу эксперимента значительное повышение активности ЩФ в данной группе могло отражать развитие структурных нарушений в печени и/или костной ткани, с которыми часто связывают резкое повышение активности этого фермента в крови. Более вероятным в данном случае представляется компенсаторное и/или протекторное значение отмеченного сдвига активности ЩФ. На такую возможность указывают данные литературы о защитном действии кишечного пула ЩФ по отношению к естественной микробиоте, о способности фермента активизировать иммунные процессы и положительном влиянии дополнительного введения ЩФ при осложнениях интенсивной антибиотикотерапии [8–10]. В группе 1 при использовании трополона в минимальной дозе потребность в протекторном влиянии ЩФ, очевидно, была ниже, чем в группе 2, что и обусловило менее выраженную активизацию рассматриваемого фермента. Уменьшение уровня мочевины у мышей данной группы так же, как и в предыдущем случае, могло отражать снижение интенсивности белкового обмена. Таким образом, некоторая активизация фермента в группе 1 и весьма заметное повышение его активности в группе 2 на фоне признаков оптимизации метаболических процессов могли отражать положительные регуляторные изменения в организме иммунодефицитных мышей, обусловленные приемом исследуемого вещества.
По нашему мнению, в пользу такого предположения свидетельствуют и результаты анализа гематологических показателей животных исследованных групп, представленные в таблице 2. Обращает на себя внимание сниженное содержание лейкоцитов и мононуклеаров в крови животных всех исследованных групп по сравнению с показателями у иммунокомпетентных мышей линии Balb/c [11]. Как видно из таблицы 2, введение трополона не привело к изменениям общего числа лейкоцитов, а также содержания тромбоцитов и гемоглобина в крови иммунодефицитных мышей через 2 недели после его однократного приема. В то же время в конце эксперимента наблюдались заметные изменения в мононуклеарном составе крови, общим итогом которых явился статистически значимый сдвиг соотношения содержания лимфоцитов и моноцитов в сторону лимфоцитов. При этом так же, как и в случае биохимических показателей, соответствующие изменения были отмечены, прежде всего, в группах 1 и 2 (табл. 2). Так, в группе 1 наблюдалось увеличение относительного числа лимфоцитов при снижении абсолютного и относительного числа моноцитов. В группе 2 было отмечено увеличение абсолютного и относительного числа лимфоцитов при снижении относительного числа моноцитов. В результате отношение относительного числа лимфоцитов к относительному числу моноцитов (лф%/мон%) при введении исследуемого соединения в минимальной и промежуточной дозе увеличилось по сравнению со значением в контроле соответственно в 1,7 и 2,1 раза (табл. 2).
Выбор процентного (а не абсолютного) содержания мононуклеров в качестве компонентов соотношения, характеризующего состояние животных, был обусловлен известными сведениями об информативности относительных гематологических показателей как характеристик интегральных адаптационных процессов [12, 13]. Показатели такого рода, как правило, отличаются большей стабильностью по сравнению с абсолютными характеристиками. Это, в частности, находит отражение и в уровне их вариабельности. Так, коэффициенты вариации относительного числа лимфоцитов и моноцитов у мышей исследованных групп были заметно ниже (в 1,3–7 раз) коэффициентов вариации абсолютного количества этих мононуклеаров (табл. 2). Правомерность сделанного выбора подтверждается результатами анализа гематологических характеристик у животных, получивших изучаемое вещество в максимальной из исследованных доз. В группе 3, отличавшейся наибольшей вариабельностью гематологических показателей, не было отмечено статистически значимых отклонений количественных характеристик мононуклеаров крови от контрольных значений. Тем не менее отношение лф%/мон% в группе 3, так же как и в двух других основных группах, оказалось выше, чем у мышей в контроле (табл. 2). Это может свидетельствовать об иммунотропном действии трополона и отражать его способность активизировать лимфоцитарный компонент иммунной системы животных с Т-клеточным дефицитом.
Таблица 2
Гематологические показатели у мышей линии Balb/c Nude через 14 дней после однократного введения
2-(6,8-диметил-5-нитро-4-хлорхинолин-2-ил)-5,6,7-трихлор-1,3-трополона
|
Группа |
Гемоглобин |
Тромбоциты |
Лейкоциты, 109/л, (cv) |
Лимфоциты |
Моноциты |
Лф%/Мон%, (cv) |
||
|
109/л, (cv) |
%, (cv) |
109/л, (cv) |
%, (cv) |
|||||
|
Контроль |
147±9 (12%) |
381±163 (86%) |
2,7±0,5 (38%) |
1,16±0,2 (36%) |
45,4±1,2 (5%) |
0,58±0,11 (37%) |
17,8±1,2 (13%) |
2,58±0,14 (11%) |
|
1 |
136±8 (12%) |
380±73 (38%) |
3,0±0,6 (37%) |
1,60±0,35 (43%) |
54,6±3,0* (11%) |
0,42±0,07* (31%) |
12,4±0,8* (13%) |
4,46±0,30* (13%) |
|
2 |
146±6 (8%) |
475±164 (69%) |
3,5±0,6 (36%) |
1,94±0,35*◘ (36%) |
60,0±5,0* (18%) |
0,48±0,10 (40%) |
12,3±2,1* (30%) |
5,34±1,38* (51%) |
|
3 |
135±14 (21%) |
494±175 (71%) |
2,5±0,6 (52%) |
1,16±0,28 (49%) |
50,3±6,8 (27%) |
0,44±0,14 (65%) |
14,0±2,1 (33%) |
3,94±0,79* (40%) |
Примечания:* – отличается от значений в контрольной группе, p<0,01; ● – отличается от значений в группе 1, p<0,01, ◘ – отличается от значений в группе 3, p<0,01; критерий Вилкоксона–Манна–Уитни, t-критерий Стьюдента.
Заключение
Физико-химические особенности 2-(6,8-диметил-5-нитро-4-хлорхинолин-2-ил)-5,6,7-трихлор-1,3-трополона, связанные с нерастворимостью в воде и недостаточно высокой способностью к образованию суспензий с 1%-ным крахмальным гелем, обусловили ограничение диапазона исследованных доз. Это не позволило в рамках изучения острой токсичности определить максимально переносимую (МПД) и полулетальную дозу (ЛД50) данного вещества при его однократном приеме. Отсутствие выраженных признаков токсического влияния трополона при его однократном введении в дозах 0,0055, 0,055 и 0,55 мг/г определяет границы применения данного вещества для дальнейшего изучения его кумулятивных и противоопухолевых эффектов. Вызывают интерес признаки оптимизации метаболизма при использовании трополона в дозах 0,0055 и 0,055 мг/г и сдвиг соотношения относительного числа лимфоцитов и моноцитов в сторону лимфоцитов у мышей из всех основных групп. Это может указывать на иммунотропный характер влияния исследованного вещества, особенно выраженный в случае его применения в минимальной и промежуточной дозах. Поскольку исследования проводились на животных с выраженным Т-клеточным дефицитом, речь может идти о возможной активизации В- и НК-клеточного звеньев иммунной системы как одного из механизмов действия исследованного вещества трополонового ряда. Выявленные тенденции влияния 2-(6,8-диметил-5-нитро-4-хлорхинолин-2-ил)-5,6,7-трихлор-1,3-трополона могут быть использованы для поиска эффективных режимов его применения.
Библиографическая ссылка
Жукова Г.В., Минкин В.И., Гончарова А.С., Шевченко А.Н., Лукбанова Е.А., Саяпин Ю.А., Гусаков Е.А., Миндарь М.В., Заикина Е.В., Курбанова Л.З., Волкова А.В., Ходакова Д.В., Пандова О.В. НЕКОТОРЫЕ ДОЗОЗАВИСИМЫЕ ЭФФЕКТЫ НОВОГО ПРОИЗВОДНОГО ТРОПОЛОНОВОГО РЯДА, 2-(6,8-ДИМЕТИЛ-5-НИТРО-4-ХЛОРХИНОЛИН-2-ИЛ)-5,6,7-ТРИХЛОР-1,3-ТРОПОЛОНА, У МЫШЕЙ ЛИНИИ BALB/C NUDE ПРИ ЕГО ОДНОКРАТНОМ ПРИЕМЕ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30573 (дата обращения: 28.01.2026).
DOI: https://doi.org/10.17513/spno.30573



