В настоящее время атеросклероз коронарных артерий и его осложнения являются основной причиной смерти в индустриально развитых странах. По оценкам ВОЗ, ежегодно в мире от сердечно-сосудистых заболеваний погибают более 17 млн человек, из них от ишемической болезни сердца – более 7 млн. В России из-за болезни системы кровообращения умирают 1,3 млн человек, что составляет 54% от всех случаев смерти [1, 2].
Принимая во внимание, что гиперлипидемия является главным провоцирующим фактором, ее последствия и осложнения служат ведущей причиной смертности населения от сердечно-сосудистой патологии [3]. В крупных эпидемиологических исследованиях была обнаружена отчетливая корреляция между концентрацией холестерина в крови и уровнем смертности от ишемической болезни сердца [4].
Использование гиполипидемических лекарственных средств является одним из основных принципов медикаментозной терапии ишемической болезни сердца и атеросклероза.
В качестве холестеринснижающих препаратов активно используют ингибиторы ГМГ-КоА-редуктазы (статины), которые подавляют синтез холестерина на раннем этапе – на стадии образования мевалоновой кислоты [5]. Данные, указывающие на пользу статинов, не всегда коррелируют с их реальным эффектом. Около 30% пациентов в России получают статины, из них только 8% достигают желаемых показателей липидного спектра сыворотки крови [6, 7].
Некоторые ученые из Японии, Европы и США полагают, что употребление статинов вызывает серьезные нежелательные эффекты, а холестерин не является причиной атеросклероза и нарушения сердечно-сосудистой деятельности организма [8]. Исследователи пишут, что при анализе данных испытания статинами они определили, что вместо заявленных 36–54% риск развития атеросклероза действительно снижается только на 1% [9].
При терапии статинами у ряда больных наблюдаются характерные побочные явления, такие как гипергликемия, миалгии, миопатии, а в тяжелых случаях – рабдомиолиз и почечная недостаточность [10]. По данным реестров и наблюдательных исследований частота развития статин-ассоциированных побочных симптомов значительно выше, чем в рандомизированных контролируемых исследованиях. Диагностика некоторых клинических проявлений побочных эффектов иногда затруднена, так как часто базируется на субъективной оценке больного и врача [11, 12].
В настоящее время в России имеются следующие лекарственные средства из группы статинов: симвастатин, правастатин, флувастатин, ловастатин, аторвастатин, розувастатин. Период полувыведения статинов не превышает 2 ч, за исключением аторвастатина и розувастатина, период полувыведения которых составляет более 14 ч, что, вероятно, объясняет их более высокую эффективность по снижению содержания общего ХС и ЛПНП [13]. На основании этих данных можно сделать предположение о мощности и эффективности используемых лекарственных средств.
Цель исследования. Оценить и сравнить влияние гиполипидемических препаратов на динамику концентрации показателей липидного профиля, компонентов остаточного азота и некоторых ферментов сыворотки крови у белых лабораторных мышей.
Материалы и методы исследования. Для исследования были взяты беспородные белые мыши-самцы весом около 25 г, поставляемые виварием СГМУ им. В.И. Разумовского, которые случайным образом были распределены в контрольную группу, опытные группы № 1 и № 2. Дизайн исследования представлен на рисунке 1.
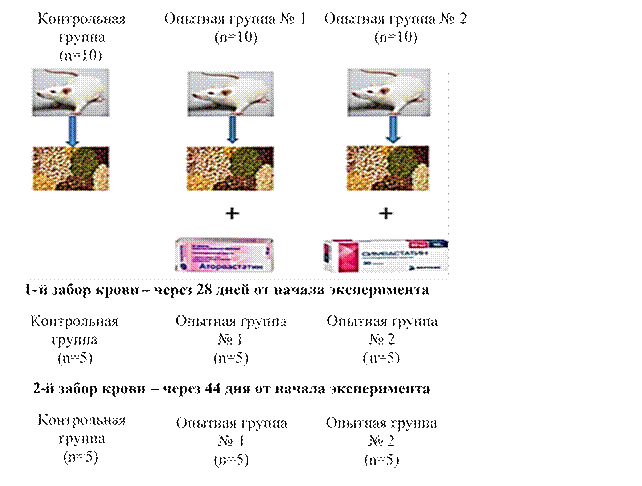
Рис. 1. Дизайн исследования
В течение всего эксперимента контрольная группа животных потребляла только стандартный корм, состоящий из злаков, овощей и воды. Животные в опытных группах на фоне того же питания потребляли дополнительно статины с концентрацией 0,4 мг на 1 кг веса 1 раз в день, что составило 0,02 мг на 1 животное. Для эксперимента были использованы два вида статинов; аторвастатин (опытная группа № 1) и симвастатин (опытная группа № 2).
Забор крови, осуществляемый через 28 дней и 44 дня от начала эксперимента, проводился посредством пункции сердца. После выстригания шерсти и дезинфекции места укола животное наркотизировалось и фиксировалось животом кверху. Пальпаторно определяли место наилучшего ощущения сердечного толчка и на 4–5 мм от этого пункта у левого края грудины выполняли прокол шприцем. Получали кровь в объеме до 0,5 мл в пробирки Vacutainer с соответствующим наполнителем. В течение 30 мин производилось отделение сыворотки путем центрифугирования при 3000 об/мин.
Биохимические исследования проводились на автоматическом биохимическом анализаторе FLEXOR E (Нидерланды) с использованием наборов фирмы «Диакон – ДС».
Статистическая обработка полученных данных проводилась с применением пакета прикладных программ Статистика 6,1 (StatSoft, США, 2003). Для представления качественных данных использовали как абсолютные, так и относительные показатели (доли, %). Для представления количественных данных приводили описательную статистику: среднее (М), стандартное отклонение (σ) при нормальном распределении признака, медиану (Me) и интерквартильный размах (25-й и 75-й процентили) в случае распределения величин, отличном от нормального [14].
Результаты исследования и их обсуждение. В таблице 1 представлены биохимические показатели сыворотки крови, взятой у лабораторных мышей в 3 исследуемых группах. Из представленных данных видно, что как на фоне приема аторвастатина, так и на фоне приема симвастатина имеются значительные изменения исследуемых показателей относительно контрольной группы (табл. 1).
Таблица 1
Биохимические показатели сыворотки крови лабораторных мышей (Me [Q25; Q75])
|
единицы измерения |
Контрольная группа |
Опытная группа № 1 (аторвастатин) |
Опытная группа № 2 (симвастатин) |
|||
|
28-й день |
44-й день |
28-й день |
44-й день |
28-й день |
44-й день |
|
|
Общий белок, г/л |
66,1 [64,5; 67,6] |
73,3 [71,85; 75] |
65,5 [64,7; 68,3] |
68,7 [66; 71,2] |
71,5 [70,1; 77,1] |
69,4 [63,3; 71,8] |
|
Глюкоза, ммоль/л |
6,61 [6,1; 6,78] |
6,71 [6,28; 7,02] |
7,34 [6,68; 7,88] |
11,01 [10,19; 11,75] *(p=0,0369) ***(p=0,0122) |
11,08 [10,39; 11,82] *(p=0,0369) **(p=0,0122) |
10,64 [9,94; 11,15] *(p=0,0369) |
|
Креатинин, мкмоль/л |
25,1 [23,4; 25,9] |
29,2 [27,3; 30,4] |
42,7 [39,9; 45,7] *(p=0,0369) |
42,7 [41,1; 43,8] *(p=0,0369) |
40,8 [39,4; 42,2] *(p=0,0369) |
55,1 [54,3; 58,1] *(p=0,0369) **(p=0,0122) ***(p=0,0122) |
|
Мочевина, ммоль/л |
5,92 [5,18; 6,03] |
5,16 [4,99; 5,24] |
7,01 [6,68; 7,27] *(p=0,0369) |
7,12 [7,02; 7,39] *(p=0,0369) |
9,97 [9,15; 10,16] *(p=0,0369) **(p=0,0122) |
10,61 [9,62; 12,33] *(p=0,0369) **(p=0,0122) |
|
Об. билирубин, мкмоль/л |
8,3 [8; 9,1] |
9,4 [8,95; 10,3] |
12,4 [11,4; 13,3] *(p=0,0369) |
11,7 [11,1; 12,4] |
9,1 [8,8; 9,4] **(p=0,0160) |
8,8 [8,3; 9,3] **(p=0,0216) |
|
АЛТ, МЕ/л |
64,8 [60,35; 68,2] |
72,2 [69,5; 73,1] |
164 [133; 168,7] *(p=0,0369) |
255,4 [214,8; 277,2] *(p=0,0369) ***(p=0,0122) |
182,5 [177,2; 201,3] *(p=0,0369) |
383,4 [312,7; 409,9] *(p=0,0369) **(p=0,0122) ***(p=0,0122) |
|
АСТ, МЕ/л |
90,7 [87,55; 105,4] |
104,7 [100,15; 106,1] |
365,6 [314,7; 382,8] *(p=0,0369) |
478,7 [445,9; 511] *(p=0,0369) ***(p=0,0122) |
420,1 [417,8; 450,8] *(p=0,0369) **(p=0,0122) |
462,9 [433,7; 520,8] *(p=0,0369) |
|
Кальций, ммоль/л |
1,8 [1,79; 2,01] |
1,92 [1,91; 2,17] |
2,12 [1,68; 2,17] |
1,99 [1,99; 2,21] |
2,18 [2,02; 2,33] |
2,07 [1,87; 2,11] |
|
Щелочная фосфатаза, МЕ/л |
217,4 [212,25; 225,45] |
232,2 [222,25; 241,25] |
95,1 [88,9; 99,4] *(p=0,0369) |
166,2 [155,2; 174,4] *(p=0,0369) ***(p=0,0122) |
93,7 [85,7; 96,8] *(p=0,0369) |
112,8 [110,4; 124,2] *(p=0,0369) **(p=0,0368) ***(p=0,0216) |
*– статистически значимое отличие (р<0,05) по сравнению с значениями контрольной группы;
** – статистически значимое отличие (р<0,05) при сравнении двух опытных групп;
*** – статистически значимое отличие (р<0,05) при сравнении показателей в одной группе на 28-й и 44-й дни.
В 1-й и 2-й опытных группах на фоне проведения гиполипидемической терапии в сыворотке крови оказались повышенными показатели глюкозы, креатинина, мочевины, АЛТ, АСТ относительно показателей контрольной группы. При этом показатели сыворотки крови на фоне приема симвастатина (2-я опытная группа) значительно повышены относительно показателей как контрольной, так и 1-й опытной группы (рис. 2).
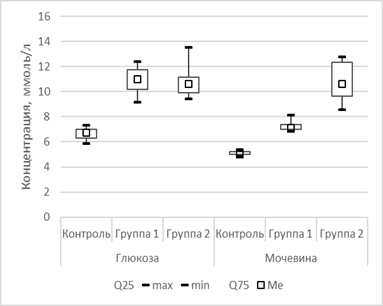
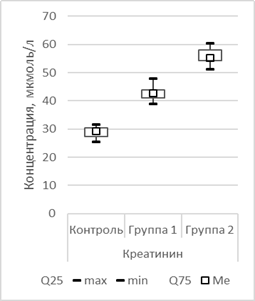
Рис. 2. Сравнительная оценка изменения глюкозы, мочевины, креатинина в сыворотке крови к 44-му дню исследования
Относительно контрольной группы на фоне проведения гиполипидемической терапии в сыворотке крови крыс опытных групп снизилась концентрация щелочной фосфатазы. В опытной группе № 2 снижение более выражено, чем в группе № 1 (табл. 1, рис. 3).
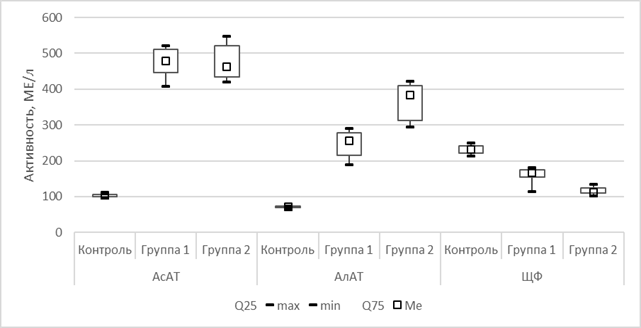
Рис. 3. Сравнительная оценка изменения АСТ, АЛТ, щелочной фосфатазы в сыворотке крови к 44-му дню исследования
Таблица 2
Биохимические показатели сыворотки крови у лабораторных мышей Me [Q25; Q75]
|
Показатель, единицы измерения |
Контрольная группа |
Опытная группа № 1 (аторвастатин) |
Опытная группа № 2 (симвастатин) |
|||
|
28-й день |
44-й день |
28-й день |
44-й день |
28-й день |
44-й день |
|
|
Холестерин, ммоль/л |
2,22 [2,17; 3,09] |
3,17 [2,96; 3,95] |
1,55 [1,47; 2,04] |
1,68 [1,14; 2,01] *(p=0,0369) |
2,55 [2,1; 3,22] |
2,01 [1,88; 2,96] |
|
Триацилглицериды, ммоль/л |
1,14 [1,08; 1,57] |
1,48 [1,36; 1,92] |
1,25 [0,8; 1,75] |
1,12 [0,74; 1,54] |
1,27 [1,02; 2,2] |
1,33 [1,06; 2,14] |
|
ХС – ЛПНП, ммоль/л |
1,08 [0,8; 1,1] |
1,47 [1,08; 1,5] |
1,11 [0,77; 1,22] |
0,72 [0,44; 0,84] |
0,84 [0,51; 0,99] |
0,68 [0,33; 0,72] |
|
ХС – ЛПВП, ммоль/л |
1,57 [1,17; 1,6] |
2,12 [1,78; 2,34] |
0,84 [0,73; 1,07] |
1,28 [0,61; 1,48] |
0,95 [0,7; 1,37] |
0,99 [0,83; 1,59] |
|
Коэффициент атерогенности |
1,44 [0,93; 1,6] |
0,85 [0,68; 0,89] |
0,85 [0,84; 1,05] |
0,49 [0,32; 0,87] |
1,68 [1,47; 1,86] **(p=0,0122) |
1,03 [0,86; 1,14] ***(p=0,0368) |
*– статистически значимое отличие (р<0,05) по сравнению с значениями контрольной группы;
** – статистически значимое отличие (р<0,05) при сравнении двух опытных групп;
*** – статистически значимое отличие (р<0,05) при сравнении показателей в одной группе на 28-й и 44-й дни.
Относительно контрольной группы на фоне проведения гиполипидемической терапии в сыворотке крови отмечены изменения показателей липидного профиля, в частности снижение холестерина, ЛПНП и как следствие – коэффициента атерогенности. Остальные показатели статистически значимо от показателей контрольной группы не отличались. Значения показателей липидного профиля в 1-й опытной группе больше удовлетворяют требованиям проведения гиполипидемической терапии (табл. 2, рис. 4).
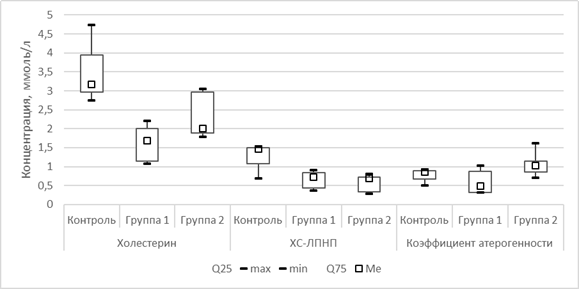
Рис. 4. Сравнительная оценка изменения некоторых показателей липидного профиля в сыворотке крови к 44-й дню исследования
Выводы
1. У белых лабораторных мышей в результате приема препаратов аторвастатина и симвастатина при последующем 2-кратным заборе крови (на 28-й и 44-й день исследования) выявлено снижение некоторых показателей липидного профиля с наилучшим эффектом в 1-й опытной группе (аторвастатин).
2. У белых лабораторных мышей в результате приема препаратов аторвастатина и симвастатина выявлено повышение концентраций глюкозы, мочевины, креатинина, аминотрансфераз в сыворотке крови. Наибольшие концентрации данных показателей наблюдаются во 2-й опытной группе (симвастатин). В этой же группе выявлено и более резкое снижение концентрации щелочной фосфатазы сыворотки крови.
Заключение. В результате проведенного эксперимента на белых лабораторных мышах определено, что наибольшим гиполипидемическим эффектом обладает препарат аторвастатин. Также по сравнению с симвастатином он имеет менее выраженный побочный эффект, что подтверждается изменениями показателей углеводного обмена, остаточного азота и ферментативной системы организма. Действие симвастатина на отдельные органы и системы организма требует более длительного и детального изучения.
Библиографическая ссылка
Коваленко А.В., Кофтин О.В., Бородулин Я.В., Лазаренко Я.С. СРАВНИТЕЛЬНАЯ ОЦЕНКА ДЕЙСТВИЯ ГИПОЛИПИДЕМИЧЕСКИХ ПРЕПАРАТОВ НА ПОКАЗАТЕЛИ СЫВОРОТКИ КРОВИ БЕЛЫХ ЛАБОРАТОРНЫХ МЫШЕЙ // Современные проблемы науки и образования. 2021. № 2. ;URL: https://science-education.ru/ru/article/view?id=30562 (дата обращения: 28.02.2026).
DOI: https://doi.org/10.17513/spno.30562



