Проблема уролитиаза в современном мире сохраняет свою актуальность в связи с неуклонным ростом заболеваемости и неблагоприятными эндемическими условиями [1–3]. В урологическом стационаре больных с мочекаменной болезнью и ее осложнениями, такими как пиелонефрит, цистит и иные, насчитывается от 30% до 50%. В структуре летальных исходов при урологической патологии мочекаменная болезнь стабильно занимает второе место [4–6].
Патогенез развития мочекаменной болезни определяет механизм камнеобразования. В сущности, процесс формирования конкрементов – это биохимический процесс, протекающий в организме, который нарушает коллоидное равновесие в моче [7, 8]. В нормальном состоянии моча является перенасыщенным раствором, и в ней не происходит камнеобразования, так как осуществляется растворение кристаллоидов защитными коллоидами. Недостаточное содержание в моче коллоидов приводит к формированию ядра камня, содержимым которого являются фибрин, сгусток крови, клеточный детрит, аморфный осадок, инородное тело. На сегодняшний день выдвинуты определенные теории камнеобразования. Матричная теория предполагает наличие инфекционного агента, слущенного эпителия, являющегося матрицей для формирования ядра камня. По коллоидной теории, в моче во взвешенном состоянии находятся коллоиды, переходя из лиофильного состояния в лиофобное, они кристаллизуются, так формируется камень. Согласно ионной теории, мочевой камень формируется при изменении pH мочи. Ингибиторная же теория предполагает дисбаланс ингибиторов и промоторов, которые поддерживают мочу во взвешенном состоянии и предотвращают выпадение ее в осадок, который затем приводит к образованию камней. При хроническом обезвоживании моча становится перенасыщенным раствором солей, поэтому, согласно теории преципитации и кристаллизации, мочевой камень может формироваться из кристаллов [9–11].
Однако современные исследования доказывают значимую роль иммуновоспалительного механизма в патогенезе развития и прогрессирования уролитиаза. Данный механизм реализуется посредством активации и взаимодействия эндотелиальных и иммунокомпетентных клеток. К основным функциям эндотелиальных клеток относят транспортную, барьерную, метаболическую, а также определяют их участие в синтезе цитокинов, экспрессии молекул адгезии. VCAM-I, Е-селектин, P-селектин, ICAM-I, ICAM-2 относятся к основным молекулам адгезии. Е-селектин экспрессируется на эндотелиальных клетках и относится к клеточным рецепторам клеток эндотелия, взаимодействует с лигандами, такими как сиалил Льюис Х и L-селектин. Также Е-селектин осуществляет роллинг и адгезию клеток к эндотелию сосудистой стенки. При увеличении в крови концентрации галектина-3 и VCAM-1 увеличивается смертность у пациентов с сердечно-сосудистой патологией. Галектин-3 относится к группе β-галактозид-связывающих протеинов, которые, в свою очередь, связывается с протеинами экстрацеллюлярного матрикса. Происходит экспрессия молекулы sICAM-1 на эндотелиальные клетки и лейкоциты крови, лимфоциты начинают взаимодействовать между собой, увеличивается их миграция через эндотелий сосудистой стенки. ICAM-1 включает в себя пять Ig-подобных внеклеточных доменов, которые мгновенно выявляют разные виды адгезивных лигандов, а также находящиеся на В-лимфоцитах β2-интегрины: CD11a/CD18, CD11b/CD18, что приводит к плотной имплантации клеток [12, 13].
Молекулы адгезии сосудистого эндотелия, относящиеся к семейству иммуноглобулинов, являются трансмембранными гликопротеинам и экспрессируются при развитии воспалительной реакции. Данная реакция осуществляется за счет адгезии лимфоцитов, моноцитов и эозинофилов к эндотелию сосудов и миграции в очаг воспаления. Запускается многоэтапный процесс, включающий в себя прилипание, адгезию и трансэндотелиальную миграцию клеток через сосудистую стенку. Уровень молекул сосудистой адгезии в крови повышается при воспалительном ответе различной этиологии [14, 15].
Недостаточно изученными остаются вопросы патогенеза развития заболевания, в частности активность молекул сосудистой адгезии при формировании камней мочевыделительной системы, что и определило цель данного исследования.
Целью явилось изучить экспрессию молекул сосудистой адгезии при развитии мочекаменной болезни.
Материалы и методы исследования
В группу вошли 90 пациентов, страдающих мочекаменной болезнью (МКБ) и госпитализированных в отделение урологии ЧУЗ «Клиническая больница РЖД-Медицина» города Красноярска в период 2017–2010 гг. Обследование и установка диагноза были проведены согласно клиническим рекомендациям национального руководства по урологии.
Лечение пациентов проводилось с учетом нахождения мочевого камня в мочевыводящих путях, стадии заболевания и сопутствующей патологии. При почечной колике первостепенным является купирование боли. Хорошие результаты показывает применение спазмолитиков и неспецифических противовоспалительных средств (НПВС). НПВС оказывают двойное действие: уменьшают болевой синдром и снижают отек и воспаление слизистой лоханки или мочеточника в месте стояния камня. После проведенного лечения пациенту назначается камнеизгоняющая терапия: если камень самостоятельно не отходит или имеет крупные размеры, то пациенту предлагается провести дробление камня.
Возраст пациентов, страдающих мочекаменной болезнью, в нашем исследовании составлял от 19 до 82 лет, при этом медиана по возрасту составила 54 [37; 69] года. Женщин было 23, что составляло 25,60%. У мужчин мочекаменная болезнь встречалась чаще – в 67 случаях, что составляло 74,40% в группе.
В нашем исследовании пациентов с одиночными камнями было 69 (77,7%), тогда как со множественными – 21 (23,3%), коралловидные камни были диагностированы у 7 (7,8%) пациентов. Первичный уролитиаз был выявлен у 41 (45,6%) больного, рецидивный – у 45 (50,0%), резидуальные камни были диагностированы у 4 (4,4%) пациентов. Инфицированный уролитиаз диагностирован у 22 (24,4%) больных, большинство пациентов были с неинфицированными камнями, их число составило 68 (75,6%).
При анализе результатов рентгенологического обследования пациентов с мочекаменной болезнью были выявлены камни верхней и средней групп чашечек у 15 человек, что составило 16,6%, в почечной лоханке камни находились у 18 (20,0%) человек, а у 6 (6,6%) камни и кальцинаты располагались в чашечках обеих почек. Камни верхней трети мочеточника были у 41 (45,6%) пациента, в средней трети – у 9 (10,0%) и в нижней трети мочеточника – у 1 (1,1%).
Больные были разделены на две клинические группы: I клиническая группа – 45 пациентов с неосложненным течением мочекаменной болезни и II клиническая группа – 45 пациентов с мочекаменной болезнью, осложненной пиелонефритом.
Фенотипирование лимфоцитов проводилось методом непрямой иммунофлюоресценции с помощью мышиных моноклональных антител к молекулам различных CD-рецепторов лимфоцитов.
Проводили иммуногистохимию (ИГХ) биоматериала с античеловеческими CD38 и CD31.
1. Фиксировали биологический материал в 10%-ном растворе формалина, экспозиция составляла 15 мин, затем 2 мин промывали растровом PBS.
2. Материал фиксировали сывороткой, нанося на срез 15 микролитров 10%-ного раствора WGS (whole goat serum) в PBS. Держали во влажной камере 30 мин при температуре 37оС.
3. Добавив первичные мышиные античеловеческие антитела CD38, CD31 на срез, наносили также 15 микролитров первичных антител в пропорции 1:10 в 1%-ном растворе WGS в PBS. Держали 60 мин во влажной камере при температуре 37оС. Затем промывали растровом PBS.
4. Добавляли овечьи, антимышиные FITC-меченые антитела, затем в полной темноте наносили 15 микролитров вторичных антител в пропорции 1:100 в 1%-ном растворе WGS в PBS. Держали 30 мин во влажной камере при температуре 37оС. Затем промывали растровом PBS.
5. После окраски материала DAPI (4’,6-диамидино-2-фенилиндол) проводили микроскопию. Добавляли на срез 15 микролитров глицерин с PBS, в пропорции 1:1, с DAPI в пропорции 1:10. После накрывали стеклом, и материал был готов для флуоресцентной микроскопии, также с помощью зеленого фильтра выполняли окраску DAPI в ультрафиолетовом свете FITC-мечеными антителами.
Было исследовано 30 полей зрения в ультрафиолете и зеленом фильтре, посчитано число клеток с экспрессией CD38 или CD31 (светящихся в зеленом свете) относительно общего числа лимфоцитов, окрашенных DAPI (рис. 1 и 2). Забор крови для исследования проводился на 1-е сутки после госпитализации пациента в стационар и на 5-е сутки нахождения больного в стационаре.
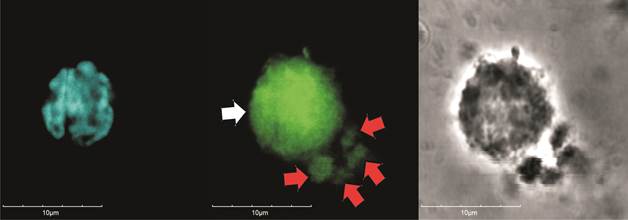
Рис. 1. CD38-экспрессирующий лимфоцит (конфокальная микроскопия, оптическое увеличение х60): слева – окраска ядра DAPI, в центре – CD38-экспрессирующий лимфоцит (белая стрелка), в окружении – CD38-экспрессирующие микрочастицы (красные стрелки), справа – фазово-контрастная микроскопия
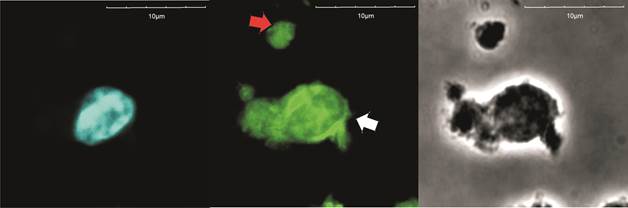
Рис. 2. CD31-экспрессирующий лимфоцит (конфокальная микроскопия, оптическое увеличение х60): слева – окраска ядра DAPI, в центре – CD31-экспрессирующий лимфоцит в блеббинге (белая стрелка), рядом – CD31-экспрессирующая микрочастица (красная стрелка), справа – фазово-контрастная микроскопия
Полученные данные обработаны статистически. Характер распределения исследуемых величин оценивали на основании теста Шапиро–Уилкса. Исследуемые величины не соответствовали нормальному распределению. При характере распределения, отличном от нормального, описательная статистика представлена в виде медианы (Ме), 25-го и 75-го процентилей, описанных как Ме [25 процентилей; 75 процентилей]. Для выявления достоверных различий в группах применяли методы непараметрической статистики – критерии Манна–Уитни. Критический уровень статистической значимости при проверке нулевой гипотезы принимали равным 0,05. Статистический анализ данных проведен с помощью пакета анализа Ms Excel 10.0, программы Statistica for Windows 6.0. и программы SPSS Statistics V. 17.0. Результаты статистической обработки сведены в таблицы.
Результаты исследования и их обсуждение
При оценивании показателей экспрессии лимфоцитами CD 38 было установлено, что в I клинической группе данные соответствовали средним показателям группы контроля (14,24 [11,32; 16,54]). Во II клинической группе было зарегистрировано статистически значимое увеличение экспрессии лимфоцитами CD 38 (17,30 [15,45; 19,20]). Однако экспрессия лимфоцитами CD 31 была увеличена в обеих клинических группах и составила 17,89 [15,35; 21,02] и 25,50 [22,14; 28,31] соответственно (табл. 1).
Таблица 1
Показатели молекул сосудистой адгезии у пациентов с мочекаменной болезнью на момент поступления
|
Показатели |
Контрольная группа |
I группа |
II группа |
|
Лимфоциты, активированные CD 38 |
12,40 [8,82; 15,07] |
14,24 [11,32; 16,54] p¹=0,467 |
17,30 [15,45; 19,20] p¹<0,001 p²=0,028 |
|
Лимфоциты, активированные CD 31 |
8,14 [6,03; 10,22]
|
17,89 [15,35; 21,02] p¹ <0,001 |
25,50 [22,14; 28,31] p¹ <0,001 p²<0,001 |
р¹ – достоверность различия между показателями контроля и исследуемой группой;
р² – достоверность различия между показателями групп I и II.
Отмечалось возрастание экспрессии CD 38, в I клинической группе показатель составил 16,28 [9,28; 19,15], p¹=0,654; во II клинической группе – 25,09 [21,95; 28,34], p¹<0,001. Однако экспрессия маркера CD 31 была более выражена и регистрировалась на показателях 26,31 [21,34; 30,68], 34,58 [31,21; 37,48] p¹<0,001 соответственно. Данные представлены в таблице 2.
Таблица 2
Показатели молекул сосудистой адгезии у пациентов с мочекаменной болезнью на 5-е сутки стационарного лечения
|
Показатели |
Контрольная группа |
I группа |
II группа |
|
Лимфоциты, активированные CD 38 |
12,40 [8,82; 15,07] |
16,28 [9,28; 19,15] p¹=0,654 |
25,09 [21,95; 28,34] p¹<0,001 p²<0,001 |
|
Лимфоциты, активированные CD 31 |
8,14 [6,03; 10,22]
|
26,31 [21,34; 30,68] p¹<0,001 |
34,58 [31,21; 37,48] p¹<0,001 p²<0,001 |
р¹ – достоверность различия между показателями контроля и исследуемой группой;
р² – достоверность различия между показателями групп I и II.
Заключение
Известно, что молекулы клеточной адгезии экспрессируются не только на эндотелиоцитах, но и на лимфоцитах, а затем оказывают влияние на миграцию лимфоцитов в очаг воспаления.
При развитии мочекаменной болезни происходит формирование дисфункции эндотелия, что проявляется значимым увеличением экспрессии CD 31 как на момент поступления больного (p¹<0,001), так и на 5-е сутки проводимого лечения. Можно предположить, что активация трансэндотелиальной миграции лимфоцитов способствует взаимодействию лейкоцитов с CD 31, что и приводит к адгезии лимфоцитов, моноцитов и эозинофилов к эндотелию сосудов.
Процент CD 38 значимо возрастает у пациентов с осложненным течением уролитиаза в результате усиления процесса трансэндотелиальной миграции лимфоцитов в зону воспалительного процесса. Таким образом, можно сделать вывод о наличии взаимосвязи между активностью экспрессии молекул сосудистой адгезии и развитием пиелонефрита при мочекаменной болезни.
Библиографическая ссылка
Бережной А.Г., Дунаевская С.С. ИЗМЕНЕНИЯ ЭКСПРЕССИИ МОЛЕКУЛ СОСУДИСТОЙ АДГЕЗИИ ПРИ МОЧЕКАМЕННОЙ БОЛЕЗНИ // Современные проблемы науки и образования. 2021. № 1. ;URL: https://science-education.ru/ru/article/view?id=30487 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.30487



