Бархатцы распростертые Tagetes patula L. относятся к группе пряноароматических (или пряновкусовых) растений.
T. patula (сем. астровые – Asteraceae) – многолетние растения высотой 30–80 см. В разных частях растения концентрация эфирных масла неодинакова: в надземной части в фазе цветения – 0,30–0,55%, в фазе бутонизации – 0,22–0,30%. Максимальное содержание эфирного масла отмечается в соцветиях (0,45%) и листьях (0,28%). Основными компонентами являются оцимен (50%), а также D-пинен, D-терпинен, n-цимол, мерцен, лимонен, цитраль, линалоол, сабинен и др. [1]. Наличие данных компонентов обусловливает консервирующие, антисептические и бактерицидные свойства растения.
Эфирное масло соцветий T. patula применяют в пищевой, мыловаренной и парфюмерно-косметической промышленности. В народной медицине водный настой соцветий используют в качестве мочегонного, потогонного и противоглистного средства. Бархатцы применяют для борьбы с нематодами земляники, картофеля и других культур, высаживая их совместно. Также T. patula культивируются как декоративные растения [1].
Окраску соцветий бархатцев обусловливает наличие таких биологически активных соединений, как флавоноиды, которые благодаря широкому спектру активности представляют особый интерес для изучения. Флавоноиды относятся к классу полифенольных соединений, а также к вторичным продуктам метаболизма растений [1]. Во многих случаях флавоноиды содержатся в виде гликозидов с остатком глюкозы, галактозы, рамнозы, рибозы или арабинозы, хотя встречаются и в виде агликонов [2-4].
Поиск новых источников биологически активных веществ, в том числе флавоноидных соединений, остается актуальным направлением современной фармакологии и биотехнологии. Растения являются одним из основных видов сырья для получения ценных для человека компонентов.
Флавоноиды играют огромную роль в защите растений от бактериальной, вирусной и грибковой инфекций, от проникновения паразитов и повреждения насекомыми. На сегодняшний день широко изучаются антиоксидантная активность экстрактов соцветий бархатцев [5, 6] и их участие в защите растений от окислительного стресса [4, 7]. Однако противомикробная активность экстрактов соцветий T. patula в нашей стране изучена недостаточно [3]. Исследуются в основном водно-спиртовые экстракты, которые не всегда обладают высокой антибактериальной активностью в отношении ряда грамположительных и грамотрицательных бактериальных культур. При этом вода в качестве экстрагента, имеющая существенные преимущества, такие как безопасность при использовании, дешевизна и фармакологическая индифферентность, практически не применяется. Предложенные способы экстрагирования направлены на выделение как полярных, так и малополярных и неполярных компонентов из соцветий T. patula с выраженной противомикробной активностью. Вышеперечисленное обусловливает актуальность поиска не только новых источников биологически активных веществ, но и легких, безопасных и дешевых способов их извлечения.
В связи с этим целью данной работы являлось исследование химического состава и противомикробной активности экстрактов из соцветий T. patula.
Материал и методы исследования
Объектом исследования являлись соцветия T. patula, собранные в период цветения в августе 2014 г. Соцветия высушили, измельчили и использовали для приготовления экстрактов согласно подобранным методикам [8].
Экстракты из соцветий T. patula готовили с использованием двух видов экстрагентов (70%-ного этанольного спирта и воды) двумя методами. Экстракт № 1 (водно-спиртовой) и экстракт № 3 (водный) готовили следующим образом: 10 г измельченного растительного сырья помещали в колбу вместимостью 200 мл, добавляли 150 мл экстрагента и пятикратно кипятили в течение 1 ч. Извлечение фильтровали через несколько слоев марли, отжимая частицы сырья. Для приготовления экстракта № 2 (водно-спиртового) и экстракта № 4 (водного) 10 г измельченного растительного сырья помещали в емкость из темного стекла объемом 200 мл, добавляли 150 мл 70%-ного этанола и оставляли при периодическом перемешивании на 3 суток. Извлечение фильтровали через несколько слоев марли, отжимая частицы сырья [8].
Исследование содержания в экстрактах основных групп биологически активных веществ проводили с использованием качественных реакций: реакции для определения флавоноидов (реакция с хлоридом железа (III), реакции с аммиаком, борно-лимонная реакция), для определения гликозидов (реакция Келлер-Килиани); реакции осаждения для определения алкалоидов (реакция Вагнера–Бушарда, реакция Марки) [9, 10].
Определение кверцетина проводили методом высокоэффективной тонкослойной хроматографии (ВЭТСХ) на пластинах Sorbfil ПТСХ-П-В-УФ размером 10х15 см [11].
Для приготовления стандартных образцов кверцетина 1 мг стандартного образца растворяли в 5 мл метанола в пикнометре вместимостью 10 мл. Объем пикнометра доводили до метки метанолом и тщательно перемешивали. Полученный раствор содержал 100 мг/л кверцетина. Из этого раствора готовили стандартные растворы в метаноле с концентрациями 25 мг/л; 50 мг/л и 75 мг/л.
Для нанесения образцов использовали автосамплер CAMAG ATS4. Наносимый объем стандартных образцов и исследуемых экстрактов составляет 4 мкл. Пластинку помещали в предварительно насыщенную хроматографическую камеру и элюировали, длина пробега составляла 4,5 см. Пластинку высушивали при комнатной температуре в течение 5–10 мин в вытяжном шкафу, а затем – в сушильном шкафу при температуре 850С в течение 5 мин. Далее пластинки оставляли на 6–12 ч при комнатной температуре в темном месте.
Для количественной обработки хроматограмм использовали сканирующий денситометр CAMAG TLC Scanner 3 при длине волны 410 нм и размером щели 2,00 х 0,2 мм. Прием данных и количественную обработку полученных результатов проводили на компьютере с использованием программы WinCats.
Антибактериальную активность определяли методом прямой диффузии исследуемых образцов в питательную среду [3]. Проводили замеры диаметра задержки роста бактерий. В качестве тест-штаммов были выбраны условно-патогенные штаммы бактерий Escherichia coli Migula СК ВКПМ В-1911, Bacillus subtilis Ehrenberg ВКПМ В-1919 и Staphylococcus aureus Rosenbach ВКПМ В-1899, полученные из Всероссийской коллекции промышленных микроорганизмов ФГУП ГосНИИ генетики [12].
Фунгицидную активность экстракто в исследовали методом диффузии препаратов в питательную среду с использованием лунок в отношении культуры Pythium ultimum Trow. Экстракты объемом 20 мкл вносили в лунки, сделанные в питательной среде (бобовый агар), засеянной «газоном» выбранной культуры микромицета. Степень антагонистической активности оценивали по диаметру зоны ингибирования роста микромицета вокруг лунки с исследуемым веществом [4]. Все опыты проводили в трехкратной повторности.
Результаты исследования и их обсуждение
Предварительно химический состав полученных экстрактов изучали методом качественных реакций на определение веществ фенольной природы (табл. 1). Появление зеленой окраски в результате реакции компонентов экстрактов с хлоридом железа (III) свидетельствует о присутствии флавонолов, коричневой – флавононов и халконов, красноватой или бурой – флавонов. Борно-лимонная реакция позволяет обнаружить 5-оксифлавоны и 5-оксифлавонолы, которые взаимодействуют с борной кислотой в присутствии лимонной кислоты, давая желтую окраску. При взаимодействии с аммиаком такие вещества, как флавоны, флавонолы, флавононы и флавононолы, растворяются с образованием желтой окраски, которая при нагревании изменяется до оранжевой или коричневой.
Таблица 1
Результаты проведения качественных реакций на определение фенольных компонентов
|
Образцы водных и спиртовых экстрактов |
Реакции |
||
|
С хлоридом железа (III) (цвет окрашивания) |
С аммиаком (цвет окрашивания) |
Борно-лимонная (цвет окрашивания) |
|
|
Экстракт № 1 |
Зеленый |
Красный |
Красновато-желтый |
|
Экстракт № 2 |
Зеленый |
Красный |
Красновато-желтый |
|
Экстракт № 3 |
Коричневый |
Красный |
Желтый |
|
Экстракт № 4 |
Коричневый |
Красный |
Желтый |
Следующим этапом работы было проведение ВЭТСХ, результаты которой свидетельствуют о содержании в опытных образцах кверцетина и его гликозида рутина (рис. 1).
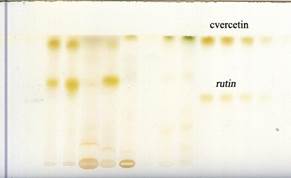
Рис. 1. ВЭТСХ определения кверцетина в экстрактах соцветий T. patula
Показатели Rf контроля кверцетина и опытных образцов совпадают (табл. 2).
Таблица 2
Результаты определения содержания кверцетина в соцветиях T. patula методом ВЭТСХ
|
Образец, № экстракта |
Rf кверцетина |
Среднее содержание кверцетина, мг |
|
Экстракт № 1 |
0,72 |
62,52 |
|
Экстракт № 2 |
0,72 |
60,04 |
|
Экстракт № 3 |
0,74 |
40,40 |
|
Экстракт № 4 |
0,73 |
43,57 |
Как следует из таблицы 2, большее содержание кверцетина наблюдается в водно-спиртовых экстрактах, полученных методом настаивания с нагреванием и без нагревания. Достоверной разницы по содержанию кверцетина в этих видах экстрактов не отмечается. Водная экстракция в результате применения только полярного растворителя – воды (как с нагреванием, так и без него) – позволяет выделить из соцветий T. patula в 1,5–2 раза меньше кверцетина, чем экстракция менее полярными растворителями, подходящими для извлечения таких соединений, как флавоноиды.
Далее проводили исследования антибактериальной активности полученных экстрактов соцветий T. patula, результаты которых представлены в таблице 3.
Таблица 3
Антибактериальная активность экстрактов соцветий T. patula
|
Экстракт |
ДЗЗР1, мм |
|||||
|
Через 48 ч |
Через 7 дней |
|||||
|
S. aureus |
E. coli |
B. subtilis |
S. aureus |
E. coli |
B. subtilis |
|
|
№ 1 (10,1 мг/мл) |
14,0±1,5* |
15,0±3,0 |
20,0±2,3* |
19,8±4,9* |
0,0±0,0 |
20,0±5,7* |
|
№ 2 (12,5 мг/мл) |
11,5±1,7* |
16,0±3,0 |
22,5±2,8* |
12,0±2,0* |
21,1±0,8* |
28,0±1,2* |
|
№ 3 (2,8 мг/мл) |
12,1±2,4* |
23,0±3,7* |
10,8±0,8* |
10,0±1,0* |
0,0±0,0 |
0,0±0,0 |
|
№ 4 (2 мг/мл) |
11,3±1,5* |
35,0±6,4* |
15,0±2,3 |
9,0±1,2* |
0,0±0,0 |
0,0±0,0 |
|
Контроль Спирт 70% |
5,0±1,5 |
16,5±3,0 |
8,3±1,0 |
0,0±0,0 |
0,0±0,0 |
0,0±0,0 |
|
Контроль Вода |
0,0±0,0 |
0,0±0,0 |
0,0±0,0 |
0,0±0,0 |
0,0±0,0 |
0,0±0,0 |
Примечание: 1ДЗЗР (М±m) – диаметр зоны задержки роста бактериальной культуры, мм;
0 – отсутствие антибактериального действия;
* – различия с контролем достоверны при р≤0,05.
Как следует из таблицы 3, все исследуемые экстракты через 48 ч обладали выраженной в разной степени антибактериальной активностью. Причем водно-спиртовой экстракт № 2 проявил пролонгированное ингибирующее действие в отношении всех трех тест-культур бактерий. Наряду с этим процентное содержание кверцетина в нем меньше, чем в экстракте № 1, который обладал пролонгированным антибактериальным действием в отношении только грамположительных бактерий S. aureus и B. subtilis. Общее содержание экстрактивных веществ в водно-спиртовых экстрактах, обладающих антибактериальной активностью, составляло 10,1 и 12,5 мг/мл, что значительно меньше минимальных ингибирующих концентраций (625, 312,5 и 1250 кг/мл), установленных другими авторами [3].
Водные экстракты, хотя и обладали высокой ингибирующей активностью, особенно в отношении грамотрицательной культуры E. coli, но уже через неделю утрачивали свои свойства. Это может быть связано как с низким содержанием флавоноидного компонента, так и с невысокой концентрацией выделенного комплекса биологически активных соединений (сухой вес 2,8 и 2,0 мг/мл). Водно-спиртовая экстракция позволила получить из соцветий T. patula экстракты и с высоким содержанием кверцетина, и с большим в сравнении с водной экстракцией содержанием суммарного количества выделенных соединений (сухой вес 10,1 и 12,5 мг/мл). По данным других авторов, в отношении E. coli водно-спиртовые экстракты соцветий T. patula не оказывали ингибирующего влияния [3], что, скорее всего, связано с наличием более полярных компонентов, обусловливающих антибактериальную активность экстрактов.
Кверцетин – самый распространенный флавоноид растительного происхождения. Нетрудно предположить, что достаточно выраженные противомикробные свойства экстрактов обусловлены содержанием в них веществ флавоноидной природы. Помимо этого, интересным является изучение состава данных экстрактов на наличие других соединений, в том числе и нефенольной природы, которые также могут обусловливать противомикробную активность.
Проведено исследование влияния экстрактов на рост и развитие микромицетов на примере тест-культуры P. ultimum (табл. 4).
Таблица 4
Результаты определения фунгицидной активности экстрактов
|
Экстракт |
ДЗЗР1, мм |
|
№ 1 Спиртовой (10,1 мг/мл) |
10,0±5,0* |
|
№ 2 Спиртовой (12,5 мг/мл) |
15,0±5,0* |
|
№ 3 Водный (2,8 мг/мл) |
0,0±0,0 |
|
№ 4 Водный (2,0 мг/мл) |
0,0±0,0 |
|
Контроль Спирт 70%-ный |
0,0±0,0 |
|
Контроль Вода |
0,0±0,0 |
Примечание: 1ДЗЗР (М±m) – диаметры зоны задержки роста микроорганизмов, мм;
0 – отсутствие противомикробного действия; * – различия с контролем достоверны при р≤0,05.
Водные экстракты не обладали ингибирующим действием в отношении P. ultimum. Водно-спиртовые экстракты, особенно экстракт № 2, показали относительно высокое подавляющее рост и развитие действие. Также экстракты снижали развитие спор на гифах микромицетов (рис. 2).
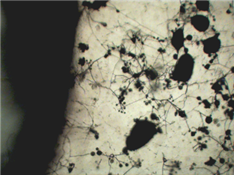 А
А  Б
Б
 В
В
 Г
Г  Д
Д
Рис. 2. Фунгицидная активность экстрактов (18x10)
А – экстракт № 1, Б – экстракт № 2, В – экстракт № 3, Г – экстракт № 4, Д – контроль
В качестве контрольных растворов были выбраны экстрагенты – вода и 70%-ный этиловый спирт, которые не обладали антибактериальной (табл. 3) и фунгицидной (табл. 4) активностью. Полученные результаты демонстрируют отсутствие влияния экстрагентов на действие выделенных биологически активных веществ. Спиртовой раствор благодаря высокой летучести не диффундируется в питательную среду, в отличие от компонентов экстрактов, и, соответственно, почти не оказывает влияния на рост и развитие бактериальной культуры.
Высокая активность водно-спиртовых экстрактов в отношении как бактерий, так и микромицетов, возможно, связана как с высокой концентрацией выделенных компонентов, так и с большим содержанием флавоноидного соединения – кверцетина. Полученные результаты свидетельствуют о перспективности дальнейшего изучения химического состава комплексных и индивидуальных соединений соцветий T. patula и их свойств.
Выводы
1. Водно-спиртовая экстракция позволяет выделять из соцветий T. patula большее количество компонентов с противомикробными свойствами, в том числе флавоноидных компонентов (кверцетин). Содержание кверцетина в водно-спиртовых экстрактах (62,52 и 60,04 мг/кг) в 1,5 раза превышало его содержание в водных экстрактах (40,4 и 43,57 мг/кг).
2. Методами качественных реакций и ВЭТСХ были определены компоненты фенольной природы, в частности флавоноид кверцетин .
3. Компоненты, выделенные спиртовой экстракцией, обладали более выраженной противомикробной активностью (антибактериальной и фунгицидной). Выявленные эффекты обусловлены наличием именно флавоноидных компонентов, в частности кверцетина.
4. На рост и развитие грамположительной спорообразующей культуры B. subtilis большее ингибирующее влияние оказали водно-спиртовые экстракты, причем они обладали пролонгированным действием. В отношении грамотрицательной культуры E. coli антибактериальной активностью обладали только водные экстракты (ДЗЗР=23,0 и 35,0 мм для экстрактов № 3 и № 4 соответственно). На развитие грамположительной тест-культуры S. aureus все исследуемые экстракты оказали почти одинаковое ингибирующее действие.
На основе полученных результатов планируется проведение дальнейших исследований по разделению и идентификации флавоноидов с целью определения формулы действующего вещества с антибиотической активностью, а также изучения механизма воздействия выделенных компонентов на бактериальную клетку.
Библиографическая ссылка
Астафьева О.В., Жаркова З.В., Якимец М.В., Арнаудова К.Ш., Генатуллина Г.Н., Ростошвили Г.А. ИССЛЕДОВАНИЕ ХИМИЧЕСКОГО СОСТАВА И ПРОТИВОМИКРОБНОЙ АКТИВНОСТИ ЭКСТРАКТОВ ИЗ СОЦВЕТИЙ TAGETES PATULA L. // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30430 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.30430



