Во всем мире по числу летальных случаев среди онкологических заболеваний злокачественные новообразования кишечника занимают 4-е место: в 2019 г. зарегистрировано более 550 тыс. случаев смерти от этого заболевания, причем наибольшее количество из них приходилось на опухоли прямой кишки [1]. В последние годы в лечении этих опухолей применяются комбинированные подходы, сочетающие выполнение предоперационной лучевой терапии (ЛТ) и хирургическое вмешательство [2, 3]. Курс лучевой терапии с разовой очаговой дозой (РОД) 2,4 Гр до суммарной очаговой дозы (СОД) 54 Гр входит в стандартную схему лечения. Однако анализ мировой и отечественной радиотерапевтической практики показал, что отсутствие реакции у пациентов на предоперационную ЛТ весьма распространено и связано, как правило, с формированием радиорезистентности опухолевых клеток. Превращение нормального эпителия прямой кишки в предраковое поражение и, в конечном итоге, в инвазивную карциному требует накопления генетических и эпигенетических аномалий. Теория колоректального канцерогенеза включает клональную эволюцию, которая дает преимущество в выживаемости и бессмертии определенным клеткам и позволяет сохранять больше молекулярных аномалий, определяющих признаки данного рака, такие как пролиферация, инвазия, метастазирование и радиорезистентность. Последняя может быть опосредована, в частности, аберрантной транскрипционной активностью генов. Так, ранее нами было установлено, что транскрипционная активность генов, регулирующих репарацию ДНК (BRCA2, H2AX, RBBP8), пролиферацию клеток и апоптоз (CASP9 и BCL2), влияет на эффективность лучевой терапии у больных раком прямой кишки [1]. Соответственно, возможно было бы предложить использование этих показателей в прогнозировании эффективности проводимой терапии. Однако транскрипционная активность генов является не очень стабильным показателем. К тому же матричная РНК достаточно быстро деградирует во внеклеточной среде [4], что делает невозможным применение подходов малоинвазивной диагностики с использованием этих маркеров.
Решение проблемы возможно при переходе на более стабильный маркер, сохраняющий свою целостность в биологических жидкостях организма, например плазме крови. К таким маркерам можно отнести показатель копийности генов (CNV, copy number variation), который возможно определить во внеклеточной ДНК, циркулирующей в плазме крови [5]. К тому же в работе Д.С. Кутилина и соавторов [6] было продемонстрировано важное значение показателя CNV ряда генов в прогнозировании устойчивости опухолевых клеток к облучению. CNV представляет собой особую группу генетических полиморфизмов, не нарушающих функцию белка или некодирующей рибонуклеиновой кислоты, но изменяющих дозу гена (число его копий), а следовательно, и уровень его транскрипционной активности [5, 6]. Так как прогностическое значение уровня экспрессии генетических локусов BRCA2, H2AX, RBBP8, CASP9 и BCL2 уже известно, логично исследовать далее именно показатель копийности этих генов во внеклеточной ДНК, к которой относят ДНК из ядер и митохондрий разрушенных (апоптоз/некроз) соматических и опухолевых клеток, ДНК из эритробластов и лимфоцитов, вирусную и бактериальную ДНК [7].
Целью данной исследовательской работы стала оценка влияния аномалий в уровне копийности указанных выше генов во внеклеточной ДНК на эффективность ЛТ у больных раком прямой кишки.
Материалы и методы исследования
В работе приняли добровольное участие 32 пациента со злокачественными новообразованиями прямой кишки (аденокарцинома G1-2, возраст от 45 до 65 лет), проходившие лечение в ФГБУ «НМИЦ онкологии» МЗ РФ в 2019 г., а также 17 условно здоровых доноров (без онкологических заболеваний). Для исследования использовали препараты внеклеточной ДНК (внДНК) из плазмы крови, полученной от доноров и пациентов до ЛТ, которая проводилось по стандартной схеме (РОД 2,4 Гр, СОД 54 Гр) на линейном ускорителе Novalis TX.
Подготовку препаратов внеклеточной ДНК проводили следующим образом: кровь, полученную путем венопункции, смешивали с фосфатным буфером (10 мМ, рН 7,5), содержащим 150 мМ хлорида натрия и 50 мМ этилендиаминтетрауксусной кислоты. Полученную смесь разделяли центрифугированием (20 мин, 400g, 15°С) на плазму и фракцию клеток [8]. внДНК выделяли фенол-хлороформным методом в модификации Кутилина и соавторов [7]: к плазме добавляли лизирующий раствор (2% SDS, 1% меркаптоэтанол, протеиназы К) и инкубировали 60 мин при 58°С; далее лизат смешивали с щелочным фенолом, центрифугировали (20 мин, 400g); отбирали водную фазу и добавляли к ней 96%-ный изопропиловый спирт и 5 М хлорид натрия (до концентрации 100 mM), инкубировали при -20ºС 60 мин; далее центрифугированием осаждали осадок, содержащий ДНК, высушивали и растворяли в Tris-EDTA-буфере.
Оценку уровня относительной копийности генетических локусов BRCA2, H2AX, RBBP8, CASP9 и BCL2 проводили методом Real-Time qPCR, в основе которого лежит одновременная амплификации целевого и референсного гена в опытной и контрольной пробах, с последующим анализом соотношения сигналов, продуцируемых ампликонами изучаемой и референсной последовательностей [7].
Смесь для Real-Time qPCR включала 2,5 нг внДНК, 0,2 мM dNTP, по 600 нМ праймеров, 2,5 мM MgCl2, однократный ПЦР-буфер, 0,1 ед./µl SynTaq ДНК-полимеразы и однократную концентрацию интеркалирующего красителя EvaGreen®Dye. Real-Time qPCR проводилась по стандартной программе 95°C 3 мин и далее 40 циклов: 95°C 10 с, 58°C 30 с (чтение оптического сигнала, канал FAM), 72°C 30 с.
Праймеры для Real-Time qPCR были разработаны нами с использованием базы данных NCBI GenBank (табл.). Генетический локус GAPDH (кодирующий глицеральдегид-3-фосфатдегидрогеназу) использовался в качестве референсного для нормализации полученных показателей Ct.
Перечень праймеров для определения CNV генов [6]
|
№ |
Праймер |
Последовательность |
Праймер |
Последовательность |
|
1 |
BRCA2_F |
TGCATCCCTGTGTAAGTGCTT |
BRCA2_R |
ACGTACTGGGTTTTTAGCAAGC |
|
2 |
H2AX_F |
AGGCCTCCCAGGAGTACTAA |
H2AX_R |
CTGAAGCGGCTCAGCTCTСT |
|
3 |
RBBP8 _F |
ACCGAGGATTTGGCACTCTG |
RBBP8 _R |
TCCGAGATTGCCTCGGGAСT |
|
4 |
BCL2_F |
GAGTGGGATGCGGGAGATG |
BCL2_R |
GGTGAAGGGCGTCAGGTG |
|
5 |
CASP9_F |
CTCCACTTCCCCTGAAGACG |
CASP9_R |
CTGGGTGTGGGCAAACTAGA |
|
6 |
GAPDH_F |
GCTGAACGGGAAGCTCACT |
GAPDH_R |
GCAGGTTTTTCTAGACGGCAСG |
Примечание: F – прямой (forward) праймер, R – обратный (reverse) праймер.
Среднее геометрическое Ct каждого гена нормализовалось по среднему геометрическому Ct референсного гена для получения величины ΔCt. Показатель копийности генетического локуса (RQ) вычисляли по формуле RQ=Е-ΔCt, где Е – рассчитанный показатель эффективности амплификации: E=10-1/h, где h – коэффициент из уравнения Ct=h*logP0+a. Далее вычисляли медиану RQоп(опухолевых образцов) и медиану RQк(контрольных образцов (плазма условно здоровых доноров)) для каждого гена и рассчитывали соотношение RQоп/RQк [5, 7].
Полученные данные обрабатывали в среде программирования R. Нормальность распределения показателей в каждой из групп определяли с использованием критерия Шапиро–Уилка (n<50). Для описания корреляционных связей применяли коэффициент ранговой корреляции Спирмена (r). Статистическую значимость различий оценивали по критерию Манна–Уитни, для корректировки множественного сравнения применяли поправку Бонферрони [9].
Результаты исследования и их обсуждение
Высокий уровень внДНК в периферической крови – маркер многих видов злокачественных новообразований. Его постепенное повышение часто ассоциировано с прогрессом заболевания, а также уровень внДНК нередко возрастает при метастазировании [10].
У 17 условно здоровых доноров и у 32 больных раком прямой кишки (до видеоколоноскопии и лучевой терапии) путем венопункции собирали кровь, далее из плазмы выделяли внДНК. Анализ отдаленных результатов ЛТ рака прямой кишки у 32 пациентов позволил разделить их на две группы. В первой группе наблюдался полный регресс опухоли после ЛТ (17 пациентов), во второй группе у 8 пациентов наблюдался незначительный регресс опухоли, у 7 пациентов регресс отсутствовал. О степени патоморфоза опухоли или его отсутствии судили по данным МРТ (магнитно-резонансной томографии) и ВКС (видеоколоноскопии) через 1,5–2 месяца после облучения. В выявленных двух группах пациентов и в группе условно здоровых доноров проводилось определение показателя копийности генов BRCA2, H2AX, RBBP8, BCL2 и CASP9 во внДНК плазмы крови (рис.).
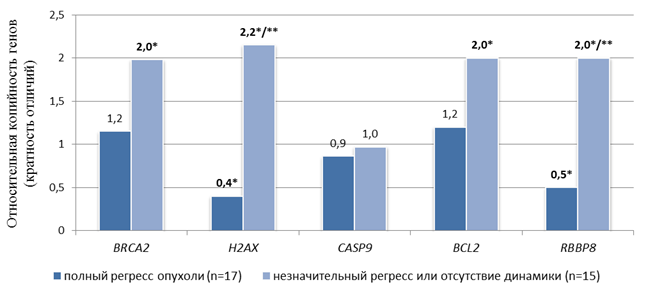
Показатель CNV генетических локусов во внДНК у больных раком прямой кишки, чувствительных и резистентных к лучевой терапии, относительно CNV генетических локусов во внДНК условно здоровых доноров. * – статистически значимые отличия (р<0,05) относительно условно здоровых доноров, ** – статистически значимые отличия (р<0,005) относительно группы с полным регрессом
До лучевой терапии во внДНК больных раком прямой кишки с последующим полным регрессом опухли обнаружено статистически значимое (р<0,05) снижение копийности генов H2AX и RBBP8 в 2,5 и 2,0 раза соответственно относительно группы условно здоровых доноров. При этом копийность генов BRCA2, BCL2 и CASP9 не отличалась от копийности в группе условно здоровых доноров. До лучевой терапии во внДНК больных раком прямой кишки второй группы обнаружено статистически значимое (р<0,05) увеличение CNV генов BRCA2, H2AX, RBBP8 и BCL2 – в 2,0 раза, в 2,2 раза, в 2,0 и в 2,0 раза соответственно – относительно CNV группы условно здоровых доноров. При этом копийность гена CASP9 не отличалась от копийности в группе условно здоровых доноров.
Следует также отметить, что между CNV генов во внДНК плазмы крови и экспрессией генов в опухолевой ткани (биопсия во время видеоколоноскопии [1]) у больных раком прямой кишки практически во всех случаях наблюдалась сильная положительная корреляция: для гена BRCA2 r=0,750 и r=0,890; для гена H2AX r=0,898 и r=0,887; для гена RBBP8 r=0,908 и r=0,901; для гена BCL2 r=0,880 и r=0,704 и для гена CASP9 r=–0,161 (исключение) и r=0,918 соответственно для пациентов с полным регрессом и незначительным регрессом опухоли или отсутствием динамики.
Копийность только двух генетических локусов во внДНК статистически значимо (р<0,005) отличалась в первой группе от этого показателя во второй группе: копийность гена H2AX была меньше в 5,4 раза, а гена RBBP8 – в 4,0 раза.
Возможным эффектом, опосредованным изменением копийности этих генов, может быть изменение последовательности событий, необходимых для репарации двунитевых разрывов ДНК. Ионизирующее излучение, воздействуя на клетку, приводит к индукции двуцепочечных разрывов ДНК, после чего должна запускаться цепь событий, направленных на элиминацию этих структурных аномалий в молекуле. Известно, что для этого хроматин должен быть деконденсирован (ремоделирован), так как конденсированный эукариотический хроматин представляет преграду для многих биологических процессов, связанных с присоединением ферментов к определенным локусам ДНК [1].
В одном из ключевых этапов этого процесса и задействован ген H2AFX (H2AX, H2A histone family member X), кодирующий гистоновый белок, который в ответ на ионизирующее излучение фосфорилируется по серину и переходит в модифицированную форму γH2AX. Из-за этого хроматин становится менее конденсированным, и белковые комплексы, необходимые для осуществления процесса репарации, могут к нему присоединиться [11]. В частности, к модифицированному молекулярным комплексом, состоящим из белков γH2AX и MDC1, хроматину могут присоединиться белки BRCA1 (Breast cancer type 1 susceptibility protein) [12], Mre11, Rad50, Nbs1, RAD51 и АТМ [13]. Важную роль непосредственно в процессе репарации двуцепочечного разрыва в ДНК играет белок RAD51, однако для его перелокализации к месту разрыва требуется образование комплекса BRCA1-PALB2-BRCA2 (Breast cancer type 2 susceptibility protein) [14]. Образованию этого комплекса способствует белок, кодируемый геном RBBP8 (Retinoblastoma-binding protein 8), который оказывает модулирующее воздействие на активность BRCA1 [15].
BRCA2 и BRCA1 экспрессируются в клетках многих тканей, где они участвуют в восстановлении поврежденной ДНК или разрушении клеток, если ДНК не может быть восстановлена. Они играют важную роль в безошибочном восстановлении двуцепочечных разрывов ДНК. У людей белок BRCA2 в первую очередь способствует упорядоченной сборке RAD51 на одноцепочечной ДНК [13, 14]. В ряде исследований установлена гиперэкспрессия BRCA2 в тканях различных спорадических опухолей, в других исследованиях сообщается о гипоэкспрессии BRCA2 [14, 15].
Многие опухоли имеют эпигенетические аномалии в различных генах репарации ДНК. Эти дефекты, вероятно, вызывают увеличение невосстановленных повреждений ДНК. Сверхэкспрессия BRCA2 может отражать компенсаторный эффект, направленный на устранение избыточных повреждений ДНК. Также предполагают, что повышенная экспрессия BRCA2 может быть объяснена нестабильностью генома, часто наблюдаемой при раке, которая индуцирует экспрессию мРНК BRCA2 [15].
Учитывая описанное выше, можно предположить, что повышенное число копий генов BRCA2, H2AX и RBBP8 может усиливать транскрипционную активность соответствующих генов, тем самым увеличивая эффективность работы системы репарации двуцепочечных разрывов ДНК.
Продукт гена BCL2 (B-cell lymphoma 2) является антиапоптозным белком, контролирующим проницаемость митохондриальной мембраны и ингибирующим каспазы за счет предотвращения выхода цитохрома C из митохондрий и за счет связывания белка APAF1, активирующего апоптоз [1]. Поэтому повышенная копийность данного гена может приводить к увеличению его транскрипционной активности и тем самым ингибировать апоптические процессы, запущенные после воздействия ЛТ.
Важно отметить, что статистически значимого изменения копийности гена CASP9 обнаружено не было как по сравнению с уровнем копийности во внДНК плазмы крови условно здоровых доноров, так и между двумя группами пациентов с разной чувствительностью к лучевой терапии. Вероятно, изменение транскрипционной активности CASP9, обнаруженное нами ранее [1], регулируется иными молекулярными механизмами. Ген CASP9 кодирует инициаторную каспазу, критическую для запуска апоптоза [1]: при инициации апоптоза из митохондрий высвобождается цитохром С и активируется белок APAF1, который расщепляет про-фермент каспазы-9, переводя его в активную форму, которая расщепляет каспазы-3, -6 и -7, запуская каспазный каскад, расщепляющий другие клеточные мишени и приводящий к реализации запрограммированной клеточной гибели [1].
В целом, учитывая данные корреляционного анализа, можно предположить, что повышенная копийности генов, регулирующих репарацию ДНК и пролиферацию (BRCA2, H2AX, BCL2, RBBP8) во внДНК плазмы крови у больных раком прямой кишки с незначительным регрессом опухоли или отсутствием динамики, отражает их копийность в тканях опухоли, где она обеспечивает соответствующий уровень транскрипционной активности этих генов, что и приводит в итоге к снижению эффективности проводимой ЛТ.
Заключение
Таким образом, в ходе данного исследования была установлена связь повышенного количества копий генов BRCA2, H2AX, BCL2, RBBP8 во внДНК плазмы крови с низкой эффективностью лучевой терапии у больных раком прямой кишки. При этом показатель копийности генов H2AX и RBBP8 во внДНК больных раком прямой кишки обладает наибольшим потенциалом в качестве малоинвазивного маркера эффективности лучевой терапии.
Коллектив авторов выражает благодарность Д.С. Потемкину (м.н.с. лаборатории молекулярной онкологии «НМИЦ онкологии») за помощь в сборе, систематизации и обработке биологического материала.
Исследование выполнено в рамках гос. задания «Поиск предикторов радиорезистентности рака прямой кишки и разработка персонифицированных неоадъювантных терапевтических подходов».
Библиографическая ссылка
Кошелева Н.Г., Гусарева М.А., Удаленкова И.А., Фатькина Н.Б., Легостаев В.М., Шляхова О.В., Лиман Н.А., Карнаухова Е.А., Крохмаль Ю.Н., Кутилин Д.С. ПОКАЗАТЕЛЬ КОПИЙНОСТИ ГЕНОВ ВО ВНЕКЛЕТОЧНОЙ ДНК ПЛАЗМЫ КРОВИ КАК МАРКЕР ДЛЯ МАЛОИНВАЗИВНОЙ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛУЧЕВОЙ ТЕРАПИИ ОПУХОЛЕЙ ПРЯМОЙ КИШКИ // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30396 (дата обращения: 06.03.2026).
DOI: https://doi.org/10.17513/spno.30396



