Первичные опухоли ЦНС составляют около 2% всех опухолей человека, или, по данным CBTRUS (Central Brain Tumor Register of the United States), 21,4 случая на 100 тыс. населения. Другими словами, каждый год в России появляется примерно 32100 новых случаев первичных опухолей ЦНС [1].
Среди первичных опухолей ЦНС наиболее распространенным злокачественным новообразованием мозга является глиобластома [2]. Ежегодно регистрируется приблизительно 300 000 новых случаев злокачественных опухолей мозга, что в 2018 году составило 1,6% от всех выявленных злокачественных новообразований. Число выявленных глиобластом при этом составило 49% от всех новообразований мозга [3; 4]. Классифицируемая как глиома IV степени злокачественности, глиобластома является чрезвычайно агрессивным типом опухоли с выраженной способностью к инвазии в здоровые ткани, что приводит к крайне низкой пятилетней выживаемости, не превышающей 6% [5].
Считается, что одной из причин плохого ответа на терапию является присутствие популяции так называемых опухолевых стволовых клеток (ОСК). Популяция ОСК глиобластомы способна самообновляться, пролиферировать, а также дифференцироваться в различные типы клеток, что приводит к развитию гетерогенности в опухолевых узлах. Именно ОСК дают начало новым опухолевым клеткам после проведенного лечения, что приводит к рецидивам глиобластомы и плохому ответу на терапию [6].
Успех разработки и внедрения новых эффективных методов лечения глиобластомы во многом зависит от адекватных доклинических моделей. Экспериментальные животные модели остаются важным инструментом в исследовании глиобластомы, поскольку с их помощью возможно моделировать не только течение заболевания, но также изучать способность исследуемых препаратов проникать через гемато-энцефалический барьер [7]. Ксеногенные модели, которые создаются путем введения иммунодефицитным мышам культур клеток глиобластомы или имплантации фрагментов опухолей от пациентов, являются наиболее перспективными. Ксенотрансплантаты, полученные из стандартных клеточных линий (таких как U87), хотя и обладают высокой пролиферацией, но лишены ключевых характеристик глиобластомы человека, таких как некроз и инфильтративный характер роста. Более репрезентативными являются ортотопические модели, в которых диссоциированные опухолевые клетки или фрагменты опухолевой ткани имплантируются в мозг мыши. Предполагается, что, поскольку эти клетки или фрагменты не культивируются in vitro, они лишены недостатков, присущих для клеточных линий. Кроме того, ортотопические пациентоподобные модели в значительной степени сохраняют морфологические характеристики опухоли, из которой они происходят, такие как инфильтративный характер роста, микрососудистые аномалии и некроз, а также сохраняют гистологические, генетические и эпигенетические особенности родительской опухоли [7].
Поскольку в последние годы значительная роль в патогенезе глиобластомы отводится именно опухолевым стволовым клеткам, возникает большая потребность в разработке доклинических моделей с их участием. Существует несколько методов, которые позволяют исследовать роль ОСК глиобластомы in vivo. К этим методам относят создание так называемых нейросфероидов, в которых отобранная популяция ОСК экспрессирует характерные маркеры стволовости, такие как CD133, BMI1, NESTIN, SOX2, SOX9, OLIG2 и ZEB1. В дальнейшем эти нейросфероиды имплантируются в головной мозг экспериментальных животных для моделирования заболевания [7].
Цель исследования: создание ксенографтной модели глиальной опухоли на основе ОСК, выделенных с использованием метода иммуномагнитной сепарации.
Материалы и методы исследования. Для проведения исследования in vivo использовались лабораторные мыши линии Nude, полученные из питомника лабораторных животных «Пущино». В результате спонтанной мутации у мышей-гомозигот (nu/nu) отсутствуют тимус и волосяной покров и, как следствие, подавлен иммунитет и крайне низкое число Т-лимфоцитов. Данная животная модель является подходящей для проведения исследований, связанных с трансплантацией различных видов тканей и опухолей, в том числе и ОСК, поскольку обладает сниженной реакцией отторжения трансплантата.
ОСК выделялись из операционной глиальной опухоли, полученной от больных, проходивших лечение в отделении нейроонкологии ФГБУ «НИЦ онкологии» МЗ РФ, при наличии информированных согласий, с подтвержденным диагнозом – глиома.
Проведение исследования, проходящего в рамках государственного задания «Изучение возможности применения опухолевых стволовых клеток человека для создания модели ксеногенной опухоли в эксперименте», одобрено на заседании биоэтического комитета ФГБУ «НМИЦ онкологии» МЗ РФ 30.01.2020 г.
Для выделения ОСК производился забор послеоперационного опухолевого материала в пробирку с 20 мл раствора для транспортировки (р-р Хенкса (HBSS, Hank's Balanced Salt Solution) + 1% пенициллина/стрептомицина + 1% амфотерицина). Полученные образцы доставлялись в чистую зону, где производилась дальнейшая подготовка - удаление транспортной среды с последующей промывкой 5 мл чистого р-ра Хенкса. Далее образец измельчался с помощью скальпеля в чашке Петри в 1-3 мл буфера для сепарации (БДС). Измельченный образец переносился в медикон с размером пор 50 мкм с добавлением 2 мл БДС и на BD Medimachine измельчался до состояния суспензии. Полученный образец фильтровался через нейлоновый фильтр с диаметром пор 70 мкм. Фильтрат отмывался 10 мл БДС и центрифугировался 5 мин. при 300g. Осадок растворялся в 1 мл БДС для подсчета клеточности с помощью камеры Горяева с окрашиванием 0,4% раствора трипановым синим. Суспензия центрифугировалась. К осадку добавлялись магнитные частицы: 20 мкл CD90 MicroBeads, 20 мкл FcR Blocking Reagent, 20 мкл CD133 MicroBeads, 40 мкл БДС (для доведения объема до 100 мкл). Объемы представлены в расчете на каждые 107 клеток. Далее осадок смешивался с магнитными частицами и помещался в холодильник при 2-8 °С, на 15 минут. После инкубации суспензия отмывалась. Осадок ресуспендировался в 500 мкл БДС.
В магнитное поле сепаратора помещалась Large Cell Column (колонка для крупных клеток), под ней располагался коллектор объемом 15 мл. Колонка промывалась 500 мкл БДС. Далее клеточная суспензия в объеме 500 мкл помещалась в колонку. Целевые клетки оставались в колонке, а остальные – попадали в коллектор. Колонка промывалась 3×500 мкл БДС для вымывания остатков нецелевых клеток. Затем колонка помещалась в центрифужную пробирку на 15 мл с добавлением 1 мл БДС. Объем продавливался с помощью поршня. На выходе получались две пробирки: 1 – с ОСК в объеме БДС 1 мл (CD90+CD133+), 2 – нецелевые клетки в объеме БДС 2 мл (CD90-CD133-). Вымытые из магнитной колонки позитивные на маркеры стволовости клетки откручивались на 300g 5 минут. Получившийся осадок ресуспендировался в 1 мл среды для ОСК (GMP DC (CellGenix, США)), и подсчитывалось количество клеток в счетчике.
Для оценки чистоты сепарации применялся метод проточной цитофлуориметрии с моноклональными антителами к поверхностным маркерам производства BD Biosciences 45-APC-Cy7 (клон 2D1), 133-PE (клон AC133), 90-PerCP-Cy5,5 (клон 5Е10). В пробирку вносили антитела и 50 мкл исследуемого образца, инкубировали 15 минут в темноте при комнатной температуре. Затем добавляли 500 мкл буфера CellWash в каждую пробирку и анализировали на проточном цитофлуориметре BD FACSCanto™ II (Becton Dickinson, США), оснащенном двумя диодными лазерами 488 и 633 нм.
Далее производился посев выделенных клеток в подходящий по объему флакон в среду для ОСК из расчета 70-100 тысяч клеток на миллилитр среды. Клетки культивировались при температуре 37 °С и содержании СО2 5,5%. Замену среды производили по мере истощения, но не реже чем 1 раз в неделю. Опухолевые стволовые клетки в бессывороточной среде образовывали сфероиды на 3-5 день культивирования.
По окончании культивирования, когда рост сфероидов заметно замедляется и/или они начинали оседать на дно культурального сосуда и прикрепляться, производился отбор всего объема культуральной среды, перенос в центрифужную пробирку подходящего объема и откручивание на центрифуге 10 минут при 300g. Далее в осадке производился подсчет клеточности, по описанной выше методике. Суспензию центрифугировали 5 мин. при 300g. Образовавшийся осадок разделялся на две равные части и ресуспендировался в объеме 5 мкл (интракраниальная перевивка) и 200 мкл (подкожная перевивка).
В нашем пилотном исследовании животные были разделены на три группы по 3: интракраниально введение положительной фракции ОСК (CD90+CD133+), интракраниально введение отрицательной фракции ОСК (CD90-CD133-), подкожное введение отрицательной фракции (CD90-CD133-), полученных из опухолевого материала пациентов.
Первая и вторая группы перед наркотизацией предварительно взвешивались, для расчета дозировки препаратов. Для премедикации животным внутримышечно вводился «Ксилазин» в концентрации 20 мг/мл в объеме 40 мкл, а спустя 10-15 минут - внутримышечно «Золетил» в концентрации 22,57 мг/мл в дозе 67,5 мг/кг для введения животных в состояние наркоза. После того как животное уходило в сон и исчезали педальный и хвостовой рефлексы, производилась обработка операционного поля марлевым тампоном, смоченным бетадином. Далее с помощью стерильных пинцета и ножниц делался разрез кожи в области брегмы размером около 1 см (рисунок 1 А, Б).
В области разреза, отступив правее от брегмы около 2 мм, с помощью иглы 25G вкручивающими движениями создавалось аккуратное отверстие в теменной кости. В образовавшееся отверстие при помощи стереотаксической установки погружался шприц Гамильтона 701 RN вглубь мозга на 3 мм. Выполнялась инъекция ОСК в объеме 5 мкл со скоростью 0,5 мкл/минуту. Общее время инфузии составляло 10 минут (рисунок 1 В).
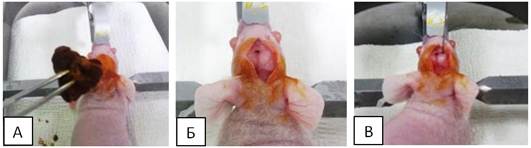
Рис. 1. А - обработка операционного поля бетадином после фиксации в
стереотаксической установке. Б - разрез кожи в области брегмы. В - интракраниальная инъекция с помощью шприца Гамильтона
После окончания инфузии шприц Гамильтона аккуратно извлекался из мозга. Разрез ушивался шовным материалом 4-0. Животное осторожно возвращалось в клетку на грелку и наблюдалось до выхода из наркоза.
Третьей группе производилась подкожная перевивка в область правого бока в объёме 200 мкл. После перевивки животные содержались в SPF виварии ФГБУ «НМИЦ онкологии» МЗ РФ 3 месяца. Три раза в неделю оценивалось общее состояние здоровья животных: изменение массы тела, аппетит, активность, нарушение координации в пространстве, нарушение моторики. В течение длительного периода наблюдения животные были активны, аппетит в норме, вес в норме, видимые признаки роста опухоли отсутствовали.
После эвтаназии образцы мозга и опухоли были помещены в 10% р-р забуференный формалин (производство BioVitrum). По истечении 48 часов образцы в автоматическом режиме обезвоживались, пропитывались минеральным маслом на станции Tissue-Tek Xpress® x120 производства Sakura, а затем заключались в парафиновые блоки. После этого блоки помещались в морозильную камеру на -20 оС на ночь. С помощью ротационного микротома Microm HM 325 фирмы Thermo Shandon Limited изготавливались образцы срезов толщиной 3 мкм (для ИГХ исследований) и 5 мкм (для гистологических исследований).
Результаты исследования и их обсуждение. По данным литературы, при создании ортотопической и гетеротопической модели глиомы, с использованием постоянных культур (глиобластома U251, астроцитома U87MG, глиобластома GS2) выход опухоли наблюдается на 21-44 сутки после перевивки [8-10], в то время как выделенные из глиомы нейтральные стволовые клетки формировали опухолевый узел на 5-20 неделе и даже дольше [11]. В связи с этим нами был выбран интервал времени в три месяца. По истечении срока наблюдения производился плановый вывод животных всех групп из эксперимента путем дислокации шейных позвонков.
В нашем исследовании первый выход опухоли зафиксирован на 49 сутки после операции у животного из второй группы (ОСК (CD90-CD133-)). При внешнем осмотре отмечено наличие экстракраниального роста опухоли в зоне введения (рисунок 2 А). Образование округлой формы имело в сечении ˜ 7 мм. На опухолевом узле отмечена небольшая гематома, которая хорошо просматривалась через кожу в виде потемнения. У животного зафиксировано небольшое снижение активности, снижен аппетит. Нарушений координации и моторики не выявлено.
После выведения животного из эксперимента, при удалении кожных покровов головы наблюдался четко сформированный опухолевый узел с небольшой гематомой (рисунок 2 Б). Опухолевый рост отмечен в зоне введения немного правее брегмы. Образование мягкое по консистенции, плотно прилегает к костям черепа.
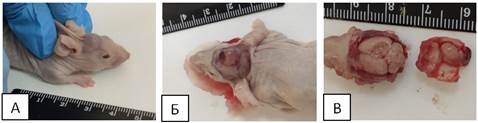
Рис. 2. А - экстракраниальный рост опухоли. Б - экстракраниальный рост опухоли после удаления кожных покровов. В - интракраниальный рост опухоли
После удаления теменной и лобных костей зафиксирован интракраниальный рост. Опухолевый узел выделился единым массивом, который не прирастал к полушариям мозга (рисунок 2 В). Узел хорошо сформирован, имеет овальную форму. Наибольший радиус около 6 мм. Интракраниальный рост опухоли привел к деформации тканей головного мозга. Сформировалось углубление по форме идентичное опухолевому узлу. Сильней всего деформировано правое полушарие (инъекция производилась правее брегмы), левое затронуто частично. Оба узла интимно припаяны к костям черепа в зоне прокола. При вскрытии брюшной полости и грудной клетки новообразований не зафиксировано. Внутренние органы в норме, желудок заполнен на треть. Печень в норме. При вскрытии грудной полости также отклонения отсутствуют.
На 61 сутки зафиксирован рост опухоли в первой группе (ОСК (CD90+CD133+)). Имелась небольшая деформация костей черепа (рисунок 3 А). Животное было вялым, малоподвижным, аппетит плохой. После вывода подопытного из эксперимента и удаления кожных покровов отмечено сильное разрастание кровеносных сосудов (рисунок 3 Б).
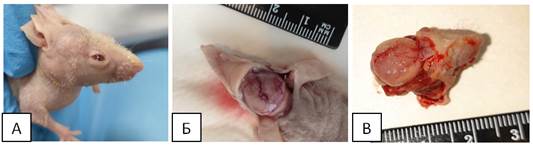
Рис. 3. А - деформированный череп. Б - разросшиеся кровеносные сосуды. В - сильное поражение правой лобной доли опухолью
После удаления лобных и теменной костей зафиксировано прирастание опухоли к твердой мозговой оболочке и полушариям. Правая лобная доля сильно поражена опухолью, частично вытеснена левая лобная доля (рисунок 3 В). Опухоль вытянута от мозжечка до обонятельных луковиц и практически полностью замещала плащ полушария, имела сероватый оттенок, рыхлая. Не выделялась отдельным узлом (по сравнению со второй группой). Некроз отсутствовал.
По истечении срока наблюдения производился плановый вывод оставшихся животных всех групп из эксперимента путем дислокации шейных позвонков.
На вскрытии оставшихся животных 1-2 групп (интракраниальное воздействие) визуальных признаков опухолевого роста не наблюдается. Кожные покровы в норме. В зоне введения нарушений кожных покровов не зафиксировано. При вскрытии брюшной полости отклонений от нормы нет, паховые лимфоузлы не увеличены, печень, почки, селезенка в норме, желудок на треть заполнен, вздутие кишечника отсутствует. При вскрытии грудной клетки также отклонений не зафиксировано: легкие бледно-розовые, без признаков отека, сердце не увеличено.
После вскрытия черепной коробки и удаления лобных и теменной костей у одного животного из 1 группы (ОСК (CD90+CD133+)) отмечено наличие отека правого полушария в зоне введения, что может с определенной вероятностью свидетельствовать о развитии патологического процесса (рисунок 4).
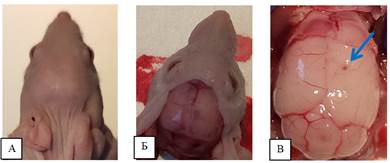
Рис. 4. А – общий вид головы с зоной введения. Б – общий вид макропрепарата с удаленными кожными покровами. В – отек правого полушария с зоной введения
На вскрытие животных группы 3 (подкожное воздействие) макроскопических признаков опухолевого роста в зоне введения не наблюдалось (рисунок 5). При вскрытии брюшной полости и грудной клетки также отклонений не зафиксировано. Головной мозг - без отклонений.
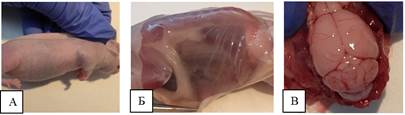
Рис. 5. А – общий вид животного с зоной введения. Б – общий вид макропрепарата с удаленными кожными покровами. В – вид головного мозга без воздействия
У животных всех групп был взят головной мозг для гистологического исследования (окраска гематоксилин/эозин), которое показало, что у животного из группы 1 (ОСК (CD90+CD133+)) опухоль имеет строение, характерное для глиобластомы с мономорфной структурой и с эктазией сосудов. Встречаются патологические некрозы (рисунок 6 А).
У животного из группы 2 (ОСК (CD90-CD133-)) в тканях головного мозга на ограниченных участках определяются структуры злокачественной опухоли – глиобластома. Опухоль состоит из мономорфных клеток с очагами некроза и прорастанием стенок сосудов (рисунок 6 Б). В выделенном от данной мыши опухолевом узле встречаются очаги некроза и кровоизлияние (рисунок 6 В).
У одного животного из группы 1 (интракраниальное воздействие) отмечается наличие перицеллюлярного отека без признаков опухолевого роста (рисунок 6 Г). В группах 1 и 2 отмечена гиперклеточность. У животных из 3-й группы мозг имеет нормальное строение (рисунок 6 Д).
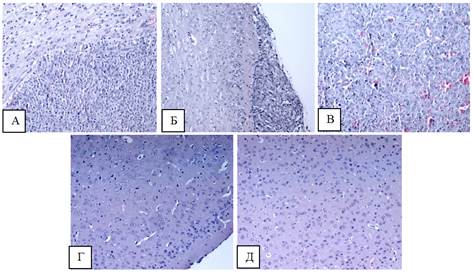
Рис. 6. Лобная доля мыши, окраска ГЭ, ув. Х200. А - лобная доля мыши из 1-й группы, пораженная опухолью. Б - лобная доля мыши из 2-й группы в месте контакта с опухолевым узлом. В - выделенный опухолевый узел (группа 2). Г - интракраниальное воздействие без роста. Д - подкожное воздействие
Выводы. В результате проведенной работы создана ортотопическая мышиная модель с использованием ОСК, полученных методом иммуномагнитной сепарации из опухолевого материала от пациентов. Был достигнут рост опухоли как в случае перевивки положительной фракции ОСК, так и в случае отрицательной фракции ОСК. После перевивки ОСК длительное время находились в покое, однако по истечении времени давали быстрый рост. Полученные результаты указывают на определенную зависимость перевивки ОСК от биологических свойств как самой опухоли, так и организма-реципиента, что требует дальнейшего исследования.
Библиографическая ссылка
Шульгина О.Г., Сагакянц А.Б., Межевова И.В., Лукбанова Е.А., Заикина Е.В., Непомнящая Е.М., Игнатов С.Н., Толмах Р.Е. СОЗДАНИЕ ОРТОТОПИЧЕСКОЙ И ГЕТЕРОТОПИЧЕСКОЙ МОДЕЛИ ОПУХОЛЕВОГО РОСТА ГЛИОМЫ ЧЕЛОВЕКА // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30381 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.30381



