Сахарный диабет 2-го типа (СД2) и хроническая сердечная недостаточность (ХСН) представляют собой важнейшие медико-социальные проблемы и приобретают статус эпидемии XXI в., требуя от здравоохранения высокоразвитых стран значительных затрат на их профилактику и лечение [1]. Ежегодно регистрируется рост распространенности СД2, по данным на 01.01.2019 г. общая численность больных им в Российской Федерации составляла около 4,5 млн человек (3,12% населения), занимая лидирующие позиции в структуре общей смертности и стойкой инвалидизации населения, в том числе трудоспособного возраста [2]. СД2 индуцирует и ускоряет развитие атеросклероза, является предиктором развития дисфункции левого желудочка и ХСН, распространенность которой среди лиц с СД2 достигает 9–22%, что в 4–6 раз выше, чем в общей популяции [1]. При этом связь между СД2 и ХСН является двунаправленной, а их сочетание существенным образом отягощает прогноз: СД2 служит маркером худшего прогноза и независимым предиктором смертности в популяции пациентов с ХСН, увеличивая ее на 50–90% независимо от фенотипа СН [3]. Также развитие ХСН у пациентов с нарушением углеводного обмена повышает годовую смертность до 10 раз по сравнению с пациентами с СД2 без ХСН, что связано с 5-летней выживаемостью всего 12,5% больных [4].
Установлено ведущее прогностическое значение ремоделирования сердца, которое представляет собой процесс комплексного нарушения его структуры и функции, включая увеличение массы миокарда, дилатацию полостей и изменение геометрической характеристики желудочков, не только в возникновении аритмий, становления и прогрессирования ХСН, но и в отношении сердечно-сосудистой смертности [5]. Учитывая высокую распространенность ХСН у пациентов с нарушением углеводного обмена, наличие тесной патогенетической ассоциации между СД2 и ССЗ [6], а также явления патоморфоза ХСН, произошедшие в последние годы с превалированием случаев СН с сохраненной фракцией выброса (СНсФВ), представляется актуальным поиск наиболее ранних и специфичных маркеров СНсФВ у больных СД2 в условиях коморбидности с целью доклинической диагностики, замедления прогрессирования ХСН и дальнейшего определения патогенетических подходов к профилактике и коррекции данных расстройств, что определяет научно-практическую значимость настоящего исследования.
Целью исследования явилось изучение структурно-функциональных параметров левого желудочка у пациентов с ХСН на фоне СД2.
Материал и методы исследования. Проведен ретроспективный анализ медицинских карт стационарных больных СД2 в сочетании с ХСН в возрасте от 18 до 70 лет (средний возраст составил 54±12 лет), проходивших стационарное лечение в БМУ «Курская областная клиническая больница» в период с октября 2016 г. по декабрь 2019 г. Необходимыми условиями для включения в исследование являлись: наличие точных данных методов диагностической визуализации и анамнестических сведений; подписанное информированное согласие на обработку персональных данных в медицинской документации.
Критерии исключения: острые осложнения СД, артериальная гипертензия (АГ) 3-й степени на фоне адекватной медикаментозной терапии, стабильная стенокардия III–IV ФК, ОКС, ИМ, реваскуляризация миокарда в анамнезе, нарушения ритма и проводимости, ХСН IV ФК по NYHA; ХСН, вызванная клапанной этиологией; нарушение функции почек и печени (уровень креатинина выше 133 мкмоль/л; содержание АСТ, АЛТ, билирубина, в 3 раза и более превышающее референсные значения).
В ходе исследования данные из 244 историй болезни, удовлетворявших критериям включения и исключения и отобранных для последующего анализа, вносились в регистрационную карту и оригинальную базу данных Microsoft Excel, специально разработанные для данного исследования. На следующем этапе все пациенты с ХСН и СД2 были разделены на группы: 1-я группа – больные СД2 с АГ и ХСН (n=94); 2-я группа – больные СД2 с ИБС и ХСН (n=81); 3-я группа – больные СД2 с АГ, ИБС и ХСН (n=69). У пациентов, включенных в анализ, диагнозы СД2 (2019), ИБС (2020), АГ (2020), ХСН (2020) рассматривались в соответствии с клиническими рекомендациями Минздрава России [7].
Клиническая характеристика больных СД2 в сочетании с ХСН, включенных в анализ, представлена в таблице 1. Исходно группы были сопоставимы по представленным клинико-демографическим показателям, показатели углеводного обмена больных в 1-й группе соответствовали индивидуальному целевому уровню HbA1c<6,5% у 16 (17%), 6,5<HbA1c<7,5% – у 28 (30%), HbA1c≥7,5% – у 50 (53%) больных. Среди пациентов 2-й и 3-й групп наблюдалась аналогичная тенденция, большинство больных СД2 имели уровень HbA1c≥7,5%, который был определен у 47 (58%) и 44 (64%) лиц соответственно.
Таблица 1
Клиническая характеристика больных СД2 в сочетании с ХСН (n=244)
|
Показатель |
1-я группа (n=94) |
2-я группа (n=81) |
3-я группа (n=69) |
|
Возраст |
54,2± 4,3 |
50,2± 4,2 |
53,7± 4,5 |
|
Мужчины/женщины |
29/65 |
33/48 |
30/39 |
|
Длительность СД (годы) |
6,3± 3,2 |
6,6±1,3 |
8,6±2,3 |
|
Длительность АГ (годы) |
12,3± 3,5 |
– |
12,7± 4,7 |
|
Длительность ИБС (годы) |
– |
4,5±2,4 |
5,2±3,5 |
|
Индекс массы тела (кг/м²) |
32,1± 2,7 |
34,2±3,1 |
32,8±3,7 |
|
HbA1c (%) |
8,1±1,2 |
8,21±0,8 |
8,4±0,4 |
|
Общий холестерин, ммоль/л |
4,7 [4,0;4,9] |
5,0 [4,4;5,2] |
5,1 [4,3;6,0] |
|
АГ степень 1 (n/%) |
39/16 |
– |
28/11 |
|
АГ степень 2 (n/%) |
55/22 |
– |
41/17 |
|
Стабильная стенокардия I ФК (n/%): |
– |
49/20 |
24/10 |
|
Стабильная стенокардия II ФК (n/%): |
– |
32/13 |
45/18 |
|
ХСН I ФК(n/%): |
42/17 |
18/7 |
10/4 |
|
ХСН II ФК (n/%): |
52/21 |
38/16 |
21/9 |
|
ХСН III ФК (n/%): |
– |
25/10 |
38/16 |
|
ШОКС 3 балла, (n/%) |
53/22 |
17/7 |
9/4 |
|
ШОКС 4 балла, (n/%) |
29/12 |
20/8 |
14/6 |
|
ШОКС 5 балла, (n/%) |
12/5 |
32/13 |
22/9 |
|
ШОКС 6 балла, (n/%) |
– |
12/5 |
24/10 |
|
Монотерапия гликлазидом (n/%) |
7/3 |
7/3 |
4/2 |
|
Монотерапия метформином (n/%) |
12/5 |
16/6 |
4/2 |
|
Комбинированная терапия (гликлазид / вилдаглиптин + метформин) (n/%) |
29/12 |
16/7 |
12/5 |
|
Инсулинотерапия (n/%) |
32/13 |
30/12 |
32/13 |
|
Инсулинотерапия + метформин (n/%) |
14/6 |
12/5 |
17/7 |
|
Ингибиторы АПФ (n/%) |
50/20 |
42/18 |
52/22 |
|
БРА (n/%) |
38/16 |
18/7 |
14/5 |
|
Бета-блокаторы (n/%) |
51/21 |
76/31 |
68/28 |
|
Антагонисты кальция (n/%) |
57/24 |
20/9 |
16/6 |
|
АМКР (n/%) |
31/13 |
18/7 |
39/16 |
|
Диуретики (n/%) |
42/18 |
16/6 |
51/21 |
|
Сердечные гликозиды (n/%) |
– |
4/2 |
18/7 |
|
Статины (n/%) |
42/18 |
76/31 |
2/25 |
Примечание: здесь и далее, если не указано иначе – (n/%) – абсолютное число лиц / число лиц, имеющих данный показатель, от общего числа лиц, включенных в анализ. HbA1c – гликированный гемоглобин, ШОКС – шкала оценки клинического состояния при ХСН, АПФ – ангиотензинпревращающий фермент, БРА – блокатор рецепторов ангиотензина II, АМКР – антагонисты минералокортикоидных рецепторов.
Клинические проявления ХСН по данным медицинской документации имели место у 72% больных (n=175), включенных в ретроспективный анализ, среди которых практически у всех (98%) больных отмечалась одышка, у 103 (42%) – отеки нижних конечностей. Все больные СД2 с АГ, ИБС и ХСН получали терапию кардиоваскулярной патологии: частота назначения ингибиторов АПФ / БРА составляла 88% (n=214), бета-блокаторов – 80% (n=195), антагонистов кальция – 38% (n=93), АМКР – 36% (n=88), диуретиков – 45% (n=109), сердечных гликозидов – 9% (n=22), статины принимали 74% пациентов (n=180).
Во всех группах больных с СД2 проанализированы протоколы эхокардиографии (ЭХО-КГ), были изучены и подвергнуты статистической обработке структурно-геометрические показатели; масса миокарда левого желудочка (ММ ЛЖ); индекс массы миокарда левого желудочка (ИММ ЛЖ); относительная толщина стенки левого желудочка (ОТС ЛЖ); фракция выброса левого желудочка (ФВ ЛЖ). ММ ЛЖ, ИММ ЛЖ и ОТС ЛЖ определяли расчетным методом с помощью онлайн-калькулятора [8]. Геометрическую модель ЛЖ оценивали по показателям ОТС ЛЖ и ИММ ЛЖ, выделяя следующие типы ремоделирования ЛЖ: нормальная геометрия ЛЖ (НГЛЖ), концентрическое ремоделирование ЛЖ (КРЛЖ), концентрическая гипертрофия ЛЖ (КГЛЖ) и эксцентрическая гипертрофия ЛЖ (ЭГЛЖ) [9].
Статистическая обработка цифровых данных произведена с применением стандартного пакета прикладных программ Microsoft Еxcel и STATISTICA Base for Windows версия 7.0 (StatSoft). С целью оценки нормальности распределения использован критерий Шапиро–Уилка. Количественные данные при нормальном распределении представлены в виде среднего и стандартного отклонения (М±SD), при его отсутствии – в виде медианы (Ме) с интерквартильным размахом [25Q;75Q]; номинальные (качественные) величины – как частота встречаемости в процентах. Для установления значимости различий между группами применяли непараметрический дисперсионный анализ (ANOVA) по критериям Краскела–Уоллиса. Анализ взаимосвязи между изучаемыми параметрами осуществляли с помощью критерия ранговой корреляции Спирмена (r). Во всех процедурах статистического анализа за критический уровень значимости нулевой статистической гипотезы принимали р=0,05.
Результаты исследования и их обсуждение. По данным протоколов ЭХО-КГ у 68 пациентов 1-й группы (72%) систолическая функция ЛЖ была сохранена (ФВ более 49%) (табл. 2). В то же время у пациентов 2-й группы среднее значение ФВ находилось в диапазоне от 41% до 49%, что по современным данным соответствует СНпФВ. У пациентов 3-й группы в 58% случаев (n=40) имело место СНнФВ, среднее значение составило 390,2 [36,7;44,1], что на 23% (р<0,05) и 16% (р<0,05) было ниже, чем у больных 1-й и 2-й группы соответственно.
Таблица 2
Морфофункциональные параметры сердца у больных СД2 в сочетании с ХСН (n=244)
|
Показатели |
1-я группа (n=94) |
2-я группа (n=81) |
3-я группа (n=69) |
|
КДР, мм |
44,1 [41,6;46,2] |
49,7 [42,1;54,8] |
55,3 [48,2;57,1]*# |
|
КСР, мм |
34,1 [33,9;37,7] |
31,3 [30,3;32,2]* |
37,5 [36,2;38,2]*# |
|
ТЗСЛЖ, мм |
11,6 [11,2;12,1] |
10,9 [10,5;11,5]* |
12,1 [11,8;12,5]*# |
|
ТМЖП, мм |
11,81 [11,4;12,18] |
11,1 [10,2;11,41]* |
12,4 [11,9;12,7]*# |
|
ФВ, % |
51,6 [49,1;56,4] |
46,6 [44,8;52,2] |
390,2 [36,7;44,1]*# |
|
ММ ЛЖ, г |
259,4 [231,6;289,6] |
221,9 [212,3;236,7] * |
301,4 [298,9;321,3]*# |
|
ИММ ЛЖ, г/м2 |
151,1 [138,1;188,09] |
136,4 [108,1;148,09]* |
169,8 [152,8;183,9]* # |
|
ОТС ЛЖ |
0,5 [0,49;0,54] |
0,46 [0,40;0,48] |
0,49 [0,43;0,49]* |
Примечание: р<0,05 по сравнению с аналогичным показателем: * – в 1-й, # – во 2-й группе.
В ходе анализа у большинства пациентов 2-й группы – в 65 случаях (80,2%) и у всех (100%) пациентов 1-й и 3-й групп была выявлена ГЛЖ, которая является одним из важных предикторов кардиоваскулярных осложнений [10]. ГЛЖ и последующее ремоделирование сердца является ключевым звеном развития диастолической дисфункции с последующим нарастанием интерстициального фиброза миокарда и неизбежным прогрессированием ХСН. При этом в последние годы обсуждается стереотипность механизмов ремоделирования сердца, что диктует целесообразность персонифицированного изучения патофизиологии данного процесса. Анализ индивидуальных данных ОТС ЛЖ и ИММ ЛЖ выявил геометрическое ремоделирование ЛЖ у 92 (98%) пациентов 1-й группы и у 69 (100%) пациентов 3-й группы (рис.).
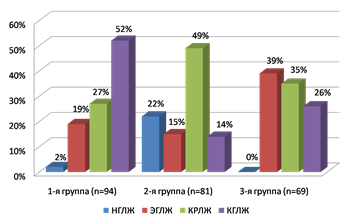
Частота вариантов геометрического ремоделирования сердца у больных СД2 в сочетании с ХСН
При этом у больных СД2 в сочетании с ХСН и АГ достоверно чаще встречалась КГЛЖ не только среди других вариантов нарушения геометрии сердца у данной категории пациентов (р<0,01), но и в сравнении с пациентами 2-й и 3-й групп (р<0,01 и р<0,05 соответственно). Во 2-й группе доминировало КРЛЖ, а КГЛЖ и ЭГЛЖ встречались гораздо реже и с одинаковой частотой. Наиболее выраженные изменения выявлены в 3-й группе, в которой ни в одном случае не было зарегистрировано нормальной геометрии сердца и с приблизительно одинаковой частотой регистрировалась как ЭГЛЖ, так и КРЛЖ. Отмечена взаимосвязь между уровнем HbA1с и наличием ГЛЖ у больных СД2 в сочетании с ХСН (r=0,68, p=0,003) без четкой зависимости типов ремоделирования ЛЖ от показателя HbA1с. Установлена корреляционная связь между ИММ ЛЖ, величиной ФВ ЛЖ и длительностью СД2 (r=0,42, p=0,02; r=0,48, p=0,04 соответственно), АГ (r=0,56, p<0,001; r=0,42, p=0,008 соответственно) и ИБС (r=0,42, p=0,032; r=0,54, p=0,004 соответственно); ОТС ЛЖ с длительностью АГ (r=0,64, p=0,04).
Выявленные нами в ходе ретроспективного анализа структурно-функциональные изменения сердца при СД2 в сочетании с ХСН можно объяснить целым рядом механизмов, в основе которых лежат гипергликемия, инсулинорезистентность и гиперинсулинемия, липотоксичность и окислительный стресс с последующей активацией симпатоадреналовой и ренин-ангиотензин-альдостероновой систем, развитием дисфункций эндотелия и микроциркуляции, которые в итоге приводят к КГЛЖ у больных СД2 [10]. Бессимптомная КГЛЖ, надежно «оберегая» насосную функцию ЛЖ с физиологической точки зрения, рано или поздно приводит к снижению сократимости. Это связано с истощением адаптационных резервов миокарда и развитием его фиброза, изначально возникающим как компенсаторная реакция с целью поддержания сокращения желудочков [11]. Структурным проявлением этой компенсаторной реакции служит переход от КГЛЖ к ЭГЛЖ, что наблюдается по мере прогрессирования СД2 и развития ИБС, аналогичные результаты демонстрируются и в исследованиях А.Г. Денисовой [6]. Однако КГЛЖ и ЭГЛЖ, доминирующие у коморбидных больных с СД2, свидетельствуют о переходе адаптивной ГЛЖ к дезадаптивной, что приводит к прогрессированию ХСН.
Заключение. Таким образом, полученные данные демонстрируют особенности ремоделирования ЛЖ у больных с ХСН на фоне СД2 при присоединении АГ и ИБС, что определяет необходимость исследования показателей кардиогемодинамики на ранних этапах развития СД2, которые должны учитываться в оценке сердечно-сосудистого прогноза с целью последующей разработки методов кардиоваскулярной профилактики и персонифицированного лечения данной категории коморбидных пациентов.
Библиографическая ссылка
Мещерина Н.С., Гусейнова Н.С. СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ПАРАМЕТРЫ СЕРДЦА У КОМОРБИДНЫХ БОЛЬНЫХ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ И САХАРНЫМ ДИАБЕТОМ 2-ГО ТИПА // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30371 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.30371



