Для культивирования бактерий применяются искусственные питательные среды. Они представляют собой твердую или жидкую смесь питательных веществ, необходимых для роста, транспорта и хранения микроорганизмов. Большая часть исследований в микробиологии зависит от способности микроорганизмов расти в лабораторных условиях, а это возможно только при наличии соответствующей культуральной среды. Чтобы быть эффективной, эта среда должна содержать все питательные вещества, которые необходимы данному микроорганизму для роста [1, 2]. Речь идет об источниках энергии, углерода, азота, фосфора, серы и различных минералов, точный состав применяемых питательных средств зависит от микроорганизмов, для которых эти среды предназначаются. И, поскольку потребности микроорганизмов в питании могут очень сильно отличаться, необходимо подбирать культуральную среду исходя из информации о среде обитания микробов. Кроме того, культивирование микроорганизмов требует тщательного контроля факторов окружающей среды, соблюдение которых обеспечит хороший рост бактериальных колоний. Например, чем выше температура, тем легче микроорганизмы могут расти до определенного момента [3]. В дополнение к температуре, влажности и pH микроорганизмы, как правило, требовательны к составу питательных сред. Для их культивирования нужны среды сложного состава, содержащие определенные химические элементы, необходимые для синтеза компонентов бактериальной клетки. Поэтому микробиологические питательные среды, являясь селективными для определенных микроорганизмов, могут содержать растворы неорганических солей или могут быть дополнены каким-либо органическим соединением [4]. В качестве таких органических соединений могут выступать аминокислоты, углеводы, витамины и ряд соединений, проявляющих биологическую активность.
В настоящее время активно продолжается изучение органических соединений, имеющих в основе индольный и хинолиновый фрагменты, в связи с тем, что большинство из них проявляют биологическую активность. Соединения, включающие одновременно оба этих фрагмента, объединенных в пирролохинолиновое кольцо, также проявляют биологическую активность. Например, в основе витамина В14 (PQQ), входящего в состав бактериальных окислительно-восстановительных ферментов, а также входящего в состав продуктов растительного и животного происхождения, лежит структура пирроло [2,3-f]хинолина.
Данный витамин был открыт достаточно недавно (в 1973 г.), и изучение его свойств продолжается, что подтверждается многочисленными публикациями, посвященными биологическому действию витамина PQQ и его синтетических структурных аналогов. Имеются сведения о роли PQQ в клеточном апоптозе клеток хондросаркомы и вовлеченных в нее основных путей [5], в лечении при повреждении центральной нервной системы [6]. Согласно данным, приведенным в другой публикации, PQQ проявляет сильную антифиброзную и поглощающую АФК активность на моделях фиброза печени у мышей Balb / C. PQQ подавляет окислительный стресс и фиброгенез печени у мышей, что дает обоснование для клинического применения PQQ в профилактике и лечении фиброза печени [7].
В литературе также имеется информация о физиологическом действии некоторых соединений пирролохинолинового ряда. Так, известно о противоопухолевой и радиозащитной активности, противомикробных свойствах некоторых замещенных пирролохинолинов [8]. Однако наряду с этим выявлено, что 7-гидроксикарбонил-1,2,3-триметил-5-метокси-1Н-пирроло[2,3-f]хинолин (1) оказывает стимулирующее действие в отношении роста и развития гриба L.tigrinus, проявляя себя как аналог витамина PQQ [9].
В связи с этим интересно было исследовать химически синтезированные замещенные пирролохинолины – аналоги витамина PQQ – в качестве стимуляторов роста микроорганизмов.
Цель исследования. Целью нашего исследования было изучение биологической активности калиевых солей замещенных пирроло[2,3-f] и [3,2-f]хинолинкарбоновых кислот в отношении тест-штамма и опытных штаммов Streptococcus pyogenes (Rosenbach 1884).
Материал и методы исследования. В качестве тест-штамма использовался S. pyogenes 1238 АТСС, опытные штаммы были получены от больных с неспецифическими заболеваниями верхних дыхательных путей. Изучение биологической активности проводилось с использованием ряда серийных разведений исследуемых соединений, Мюллер-Хинтон бульона (МХБ) без бараньих эритроцитов (в объеме 1 мл) и бактериальной суспензии с конечной концентрацией исследуемого микроорганизма примерно 5х105 КОЕ/мл.
Для исследования нами были синтезированы следующие соединения: калиевая соль 1,2,5-триметил-9-оксо-6,9-дигидро-1Н-пирроло[2,3-f]хинолин-7-карбоновой кислоты (2); калиевая соль 2,5-диметил-9-оксо-6,9-дигидро-1Н-пирроло[2,3-f]хинолин-7-карбоновой кислоты (3); калиевая соль 1,2,3-триметил-9-оксо-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-7-карбоновой кислоты (4); калиевая соль 1,2-диметил-9-оксо-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-7-карбоно-вой кислоты (5). Синтез осуществлялся на основе взаимодействия щавелевоуксусного эфира и замещенных аминоиндолов согласно методике, описанной в литературе [10]. Полученные этиловые эфиры пирролихинлинкарбоновых кислот были подвергнуты щелочному гидролизу.
Для количественного подсчета биомассы использовали оптический метод, который позволяет достаточно быстро и точно определить концентрацию клеток в культуральной жидкости [11]. В работе применяли фотоэлектроколориметр АР-101 производства Apel Сo. LTD (Япония). Фотоэлектроколориметры (ФЭК) предназначены для измерения пропускания или оптической плотности растворов в диапазоне 315–630 нм и определения концентрации растворов фотоколориметрическим методом. Очень важно, чтобы среда для культивирования была оптически прозрачной.
Перед началом проведения измерений нам необходимо было выбрать светофильтр. Светофильтры выбирались так, чтобы максимум пропускания и минимум поглощения светофильтра совпадали бы с максимумом поглощения определяемого вещества, проще говоря, была определена длина волны, при которой поглощение света данной суспензией клеток было минимальным. Состав Мюллер-Хинтон бульона (МХБ), который использовался в исследовании, следующий: мясной настой, гидролизат казеина, крахмал, агар-агар, дистиллированная вода. Так как раствор питательной среды приготовлен на основе дистиллированной воды, значит, именно по ней необходимо настраивать ФЭК для подбора длины волны светофильтра. Поочередно нами были использованы светофильтры с разными длинами волн (460, 540 и 600 нм). Для этого в стерильную кювету наливали дистиллированную воду и настраивали нулевые показатели ФЭК (Т=100%, А=0,00), далее вместо воды в кювету наливали МХБ и отмечали значение оптической плотности. Результаты измерения оптической плотности представлены таблице 1.
Таблица 1
Оптическая плотность МХБ
|
Длина волны (нм) |
Оптическая плотность МХБ |
|
460 |
0,112 |
|
540 |
0,035 |
|
600 |
0,014 |
Следовательно, поглощение света данной питательной средой было минимальным при длине волны, равной 600 нм. Поэтому именно этот светофильтр использовался в наших дальнейших опытах.
После выбора светофильтра мы приступили к исследованию оптической плотности растворов. Для этого брали исследуемую соль и добавляли ее в МХБ в разных концентрациях, у каждого раствора измеряли оптическую плотность. Далее точно так же измеряли оптическую плотность у контроля микроорганизмов [11]. Исследование проведено в трех повторностях. Статистическую обработку полученных результатов проводили методами вариационной статистики, достоверность результатов оценивали с помощью метода определения t-критерия Стьюдента [12]. В работе использовали персональный компьютер и стандартный набор программ по статистике.
Результаты исследования и их обсуждение. В качестве синтетических аналогов витамина PQQ нами были использованы следующие соединения: калиевая соль 1,2,5-триметил-9-оксо-6,9-дигидро-1Н-пирроло[2,3-f]хинолин-7-карбоновой кислоты (1); калиевая соль 2,5-диметил-9-оксо-6,9-дигидро-1Н-пирроло[2,3-f]хинолин-7-карбоновой кислоты (2); калиевая соль 1,2,3-триметил-9-оксо-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-7-карбоновой кислоты (3); калиевая соль 1,2-диметил-9-оксо-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-7-карбоновой кислоты (4).
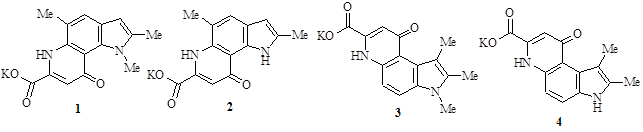
Для количественного подсчета биомассы применяли оптический метод, который позволяет достаточно быстро и точно определить концентрацию клеток в культуральной жидкости.
Исходя из данных таблицы 2 при культивировании микроорганизмов в питательной среде, содержащей соединение 2 в концентрации выше 5 мкг/мл, наблюдалось увеличение оптической плотности исследуемой культуральной среды по сравнению с контролем (Р<0,05). Следовательно, соединение 2 оказывает стимулирующее воздействие на рост исследуемых штаммов пиогенного стрептококка [13, 14].
Таблица 2
Оптическая плотность калиевой соли 1,2,5-триметил-9-оксо-6,9-дигидро-1Н-пирроло[2,3-f]хинолин-7-карбоновой кислоты (1)
|
Концентрация соли в МХБ с м/о (мкг в 1 мл) |
Контроль S. pyogenes |
Оптическая плотность соли с S. pyogenes |
|
2,5 |
0,025 |
0,025±0,01 |
|
5 |
0,025 |
0,029±0,015 |
|
10 |
0,025 |
0,126±0,024* |
|
20 |
0,025 |
0,836±0,027* |
Примечание: * – отличие от контроля статистически достоверно при Р<0,05
На рисунке 1 представлено прямо пропорциональное изменение оптической плотности культуральной жидкости при увеличении концентрации соединения 1, что свидетельствует об увеличении численности микробной популяции.
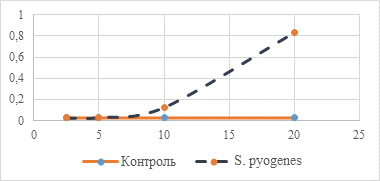
Рис. 1. Изменение оптической плотности культуральной среды при добавлении соединения 1
При культивировании микроорганизмов в питательной среде с соединением 2 в концентрации выше 5 мкг/мл наблюдалось уменьшение оптической плотности культуральной среды по сравнению с контролем (Р<0,05), которое свидетельствует об угнетении роста исследуемых микроорганизмов (табл. 3).
Таблица 3
Оптическая плотность калиевой соли 2,5-диметил-9-оксо-6,9-дигидро-1Н-пирроло[2,3-f]хинолин-7-карбоновой кислоты (2)
|
Концентрация соли в МХБ с м/о (мкг в 1 мл) |
Контроль S. pyogenes |
Оптическая плотность соли с S. pyogenes |
|
2,5 |
0,025 |
0,025±0,01 |
|
5 |
0,025 |
0,022±0,014 |
|
10 |
0,025 |
0,015±0,001* |
|
20 |
0,025 |
0,009±0,005* |
Примечание: * – отличие от контроля статистически достоверно при Р<0,05
На рисунке 2 изображена кривая изменения оптической плотности исследуемого раствора при увеличении концентрации соединения 2 от 2,5 мкг/мл до 20 мкг/мл. Наблюдается снижение оптической плотности культуральной среды, что обусловлено замедлением роста микроорганизмов и их гибелью. Вероятно, соединение 2 проявляет противомикробные свойства относительно S. pyogenes.
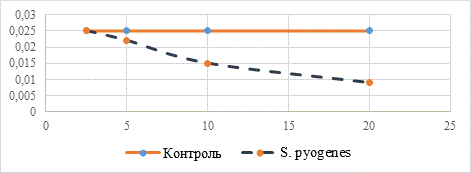
Рис. 2. Изменение оптической плотности культуральной среды при добавлении соединения 2
Таким же способом были протестированы соединения 3 (калиевая соль 1,2,3-триметил-9-оксо-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-7-карбоновой кислоты) и 4 (калиевая соль 1,2-диметил-9-оксо-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-7-карбоновой кислоты), но полученные данные показали, что добавление этих соединений не оказывает влияния на рост исследуемых микроорганизмов (табл. 4 и 5).
Таблица 4
Оптическая плотность калиевой соли 1,2,3-триметил-9-оксо-6,9-дигидро-3Н-пирроло[3,2-f] хинолин-7-карбоновой кислоты (3)
|
Концентрация соли в МХБ с м/о (мг в 1 мл) |
Контроль S. pyogenes |
Оптическая плотность соли с S. pyogenes |
|
2,5 |
0,025 |
0,025±0,015 |
|
5 |
0,025 |
0,022±0,012 |
|
10 |
0,025 |
0,019±0,013 |
|
20 |
0,025 |
0,026±0,016 |
Кривая изменения оптической плотности культуральной среды, представленная на рисунке 3, показывает незначительное влияние соединения 3 на численность микробной популяции.
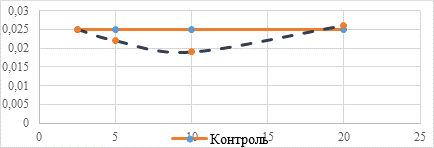
Рис. 3. Изменение оптической плотности культуральной среды при добавлении соединения 3
Таблица 5
Оптическая плотность калиевой соли 1,2-диметил-9-оксо-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-7-карбоновой кислоты (5)
|
Концентрация соли в МХБ с м/о (мг в 1 мл) |
Контроль S. pyogenes |
Оптическая плотность соли с S. pyogenes |
|
2,5 |
0,025 |
0,027±0,015 |
|
5 |
0,025 |
0,025±0,011 |
|
10 |
0,025 |
0,018±0,016 |
|
20 |
0,025 |
0,020±0,013 |
Незначительные изменения оптической плотности культуральной среды, представленные на рисунке 4, показывают незначительное влияние соединения 4 на численность микробной популяции.
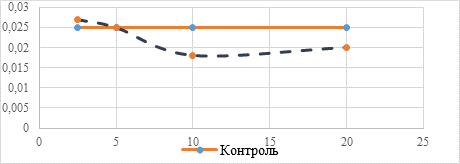
Рис. 4. Изменение оптической плотности культуральной среды при добавлении соединения 4
Заключение
Таким образом, в ходе микробиологического исследования нами выявлено, что соединение 1 статистически значимо (Р<0,05) стимулирует рост исследуемых штаммов S.pyogenes, соединение 2 статистически значимо (Р<0,05) угнетает рост исследуемых штаммов S.pyogenes. Соединения 3 и 4 практически не оказывают влияния на скорость роста исследуемых микроорганизмов.
Определено, что калиевая соль 1,2,5-триметил-9-оксо-6,9-дигидро-1Н-пирроло[2,3-f]хинолин-7-карбоновой кислоты активирует рост и размножение исследованных штаммов S.pyogenes, поэтому данное соединение в перспективе может использоваться как более доступный фактор роста для прихотливых микроорганизмов.
Работа выполнена в рамках гранта на проведение научно-исследовательских работ по приоритетным направлениям научно-исследовательской деятельности вузов – партнеров по сетевому взаимодействию (ЧГПУ им. И.Я. Яковлева и МГПУ им. М.Е. Евсевьева) по теме «Целенаправленный синтез препаратов с противомикробным действием на основе замещенных 1Н-индол-6-иламинов».
Библиографическая ссылка
Степаненко И.С., Ямашкин С.А., Жукова Н.В., Сластников Е.Д., Масейкина А.А. ИЗУЧЕНИЕ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ КАЛИЕВЫХ СОЛЕЙ ЗАМЕЩЕННЫХ ПИРРОЛО[2,3-F]- И [3,2-F]ХИНОЛИНКАРБОНОВЫХ КИСЛОТ // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30345 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.30345



